一种离心式微流控生化分析芯片
戴永辉陈 坦王战会
1(广东省中医院检验科 广州 510120)
2(天津微纳芯科技有限公司 天津 300457)
3(中国科学院深圳先进技术研究院 深圳 518055)
一种离心式微流控生化分析芯片
戴永辉1陈 坦2王战会3
1(广东省中医院检验科 广州 510120)
2(天津微纳芯科技有限公司 天津 300457)
3(中国科学院深圳先进技术研究院 深圳 518055)
文章介绍了一种低成本、快速、自动化的离心式微流控生化分析芯片。该芯片通过整合样本前处理和多生化指标检测,采用了多级微流道与虹吸微阀相结合的方式把样本的前处理、样本输送、样本与生化试剂反应等过程集成于一体,并通过比色检测获得各个生化检测项目的结果。实验结果显示芯片比色孔光程的精密度的变异系数在 0.08%~0.52%,通过血糖结果的精密度评估的芯片对样本和稀释液定量以及两者混合的精密度变异系数为 1.4%,同时使用芯片测定 15 个生化项目的日间和批内精密度均小于 3.5%,这表明该离心式微流控生化分析芯片符合临床检测要求。
微流控芯片;生化分析;床旁诊断
1 引 言
近年来微流控芯片技术迅速发展,微流控分析芯片已经开始从基础与应用基础研究阶段进入深度产业化及市场开发阶段[1,2]。微流控芯片技术具有消耗试剂少、检测速度快、容易集成等优点[3,4]。微流控芯片技术的迅速发展,促进了即时检验(Point-of-Care Testing,POCT)技术的进一步发展。1995 年,在加利福尼亚召开的美国临床化学协会年会展览会上辟出一个特殊的展区,专门展示最新 POCT 技术与设备,带给所有参观者以崭新的概念。2006 年中国 POCT 委员会筹建,2007 年起中国 POCT 高峰论坛每年举办一次。中华医学会检验分会主任委员丛玉隆教授认为:“在未来 5~10 年内,POCT 应该达到检查方法的 70%~80%,基本改变目前的检验格局”。
POCT 技术的发展使其应用领域不断扩展,从最初的隐血、血糖、尿糖检测发展到医学检验的各个方面[5-8]。POCT 快速便捷,能随时随地对患者进行检测,且一般只需少量样本即可在数分钟内获得检测结果。检测时间短,可快速报告结果,极大地方便了患者和一些特殊人群的需要,尤其重要的是能够对急诊的危重患者实施更加及时地抢救和治疗[2,6]。POCT 诊断的一个重要发展方向是整合取样、检测、校准和报告于一体的微型化、集成化的芯片实验室技术[9]。微流控分析芯片已经广泛应用于生化分析、免疫分析、蛋白分析以及核酸检测等临床检测的各个方面。在生化检测方面,Lee 等[6]研制的生化及免疫分析微流控分析芯片实现了对相关项目的快速、低成本检测;方群等[10]研制了一种激光诱导荧光检测微流控分析芯片也实现了对有关项目的便捷、低成本检测。但这两款芯片都尚未进行相关的临床应用研究。在本研究中,操作者将待测样本添加到试剂芯片中,并将其置于 Celercare M1 分析仪上进行检测。通过毛细管作用和检测芯片转动时的离心力,芯片会将未计量的血液样本转换成多等份精确稀释的血浆,并通过反应孔的光学检测同时进行多种化学成分的分析。本研究从芯片检测原理、临床项目检测等方面来探讨该微流控分析芯片临床应用的可行性。
2 材料和方法
2.1 生化分析芯片
检测芯片是一种直径为 7 cm 且包含检测所需的冻干试剂的一次性使用芯片。该芯片由两个注塑成型的塑料部件通过超声焊接而成。芯片基底和上盖均由聚甲基丙烯酸甲酯塑料经模塑成型制成。经焊接的基体和上盖构成的芯片包括样本槽、稀释液槽、定量槽、混合槽、废液槽、液流通道以及比色孔等结构(如图 1),它们可对液体进行处理控制。
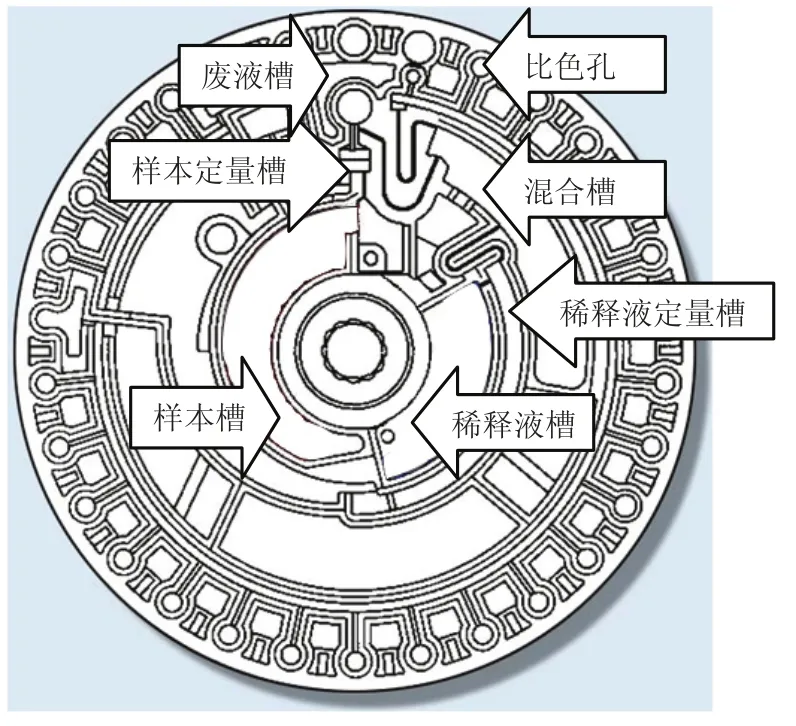
图 1 检测芯片Fig. 1 Microfluidic chip for assay
每个模塑生产的试剂芯片中包含 30 个圆柱形小孔,小孔中可存放冻干试剂小球,样本进入小孔之后发生生化反应,检测时小孔作为比色孔使用。每个芯片包含 23 个能填充稀释血浆的反应比色孔和 4 个填充稀释液的比色孔。反应比色孔有 6 种不同的深度,分别为 0.5 mm、1.7 mm、2.1 mm、3.1 mm、4.3 mm 和 5.0 mm,以适应不同试剂的敏感性和分析物的浓度。在生产试剂芯片时,将各生化检测项目相应的冻干试剂装入芯片的比色孔中。
2.2 芯片检测过程
使用该芯片进行检测时,无需对样本进行离心等预处理即可进行检测,因而血清、血浆或全血都可用于检测。通常经静脉穿刺获得全血样本可在采集后 60 min 内进行分析,而指尖末梢血样本则应在采集后立即进行分析。使用移液器将样本和稀释液分别经芯片的样本孔和稀释液孔加入至芯片的样本槽和稀释液槽中。 其中,检测所用的稀释液为蒸馏水。添加样本和稀释液时操作者不必准确计量样本:通常最少需添加 90 μL 样本和 450 μL 稀释液,最多可向芯片中添加 120 μL样本和 600 μL稀释液,如图 2。

图 2 加入样本(红色)和稀释液(蓝色)Fig. 2 Adding sample (red) and diluent (blue)
加样后操作者可将芯片放入 Celercare M1 分析仪的检测仓中。检测仓关闭,芯片装载至分析仪主轴上固定,接下来仪器会对样本和稀释液进行处理。分析开始时,分析仪会使芯片沿逆时针方向加速至 5000 rpm,并以该速度保持 2 min。离心力会使稀释液从稀释液槽进入稀释液定量槽。该定量槽径向最外侧的微流通道使稀释液以受控的方式填充该定量槽。325.75 μL 稀释液即可完全填充稀释液定量槽。剩余的稀释液会溢出稀释液定量槽,并经通道顺序填充 4 个比色孔,而最终剩下的稀释液则流入与芯片的其余部分隔离的废液槽中。这 4 个比色孔用于内部芯片的质量控制。
在稀释液定量的同时,离心力会使样本流出样本槽,并经芯片上的 U 形微流通道流入样本定量槽。完全充满样本定量槽需要 17.5 μL 样本,其余样本将溢流进入“样本充足”比色孔中。多余的样本则会被阻隔在分离的样本废液槽中。如果在“样本充足”比色孔中没有检测到样本,则检测分析会因样本量不足而中止;如果所添加的样本为全血,则通过离心力,可使样本定量槽中定量的全血的血浆和红细胞分隔开来。大多数样本仅需 30 s 即可被充分分离。为了提供检测所需的 20 μL 左右的澄清血浆,血细胞比容更高的样本需要的分离时间更长。通常芯片旋转 2 min 足以分离血细胞比容高达 60%的样本,如图 3 和图 4。

图 3 芯片旋转开始分离血细胞、血浆定量及稀释液定量Fig. 3 Blood cells separating, plasma and diluent metering

图 4 完成分离血细胞(红色)、血浆(黄色)定量及稀释液定量Fig. 4 Blood cells (red) separating, plasma(yellow) and diluent metering completed
下一步是混合稀释液和血浆。两个毛细管大小的虹吸入口分别位于稀释液定量槽的径向最外侧点处和样本定量槽的旁路下方位置。在芯片第一次旋转期间,这两个虹吸管都没有填充液体,因为向外的离心力远远大于向内的毛细作用力。分离步骤结束后,试剂芯片停止旋转,则虹吸微阀产生的毛细力会牵拉液体通过 U 形微流通道,两个微流通道的出口通向芯片混合槽。
既然是求E点的坐标,理所当然想到过点E作ES⊥x轴,垂足为S,则问题转化为求ES与AS的长,易知△ASE为等腰直角三角形,即ES=AS,所以问题转化为求FS的值.由正方形的特征想到延长SE交CD于点R,易证△ESF≌△DRE且△REC也为等腰直角三角形,则FS=ER=CR=BS=1,所以点E的坐标为(3,3).依此类推,求M坐标自然要过点M作MK⊥x轴,垂足为K,则需求FK与MK的值.由△ESF≌△DRE想到ED=EF,即△DEF为等腰直角三角形,所以∠DFM=
然后,芯片以 5000 rpm 的速度沿顺时针方向旋转,这时稀释液定量槽会被完全清空。因为U 形微流通道的出口离芯片中心的距离比稀释液定量槽离芯片中心的距离更远。样本定量槽排空至血浆定量 U 形微流通道出口处的径向距离位置。定量的血浆体积是 17.5 μL,其余的血浆和红细胞被分隔于血浆定量槽的下半部分。
接下来,改变芯片的转速以混匀混合槽中定量的稀释液和血浆。芯片转速急速降至 1000 rpm,再慢慢升至 4000 rpm,这种混合模式重复 12次。急减速提供了足够的切向力来移动和混匀混合槽中的液体。在混合过程中所需的最低转速为1000 rpm,目的是确保所施加的离心力超过最后一个 U 形微流通道的毛细作用力。这样混合能够防止 U 形微流通道发生虹吸,直到液体被均匀地混合为止,如图 5。

图 5 完成血浆(黄色)和稀释液(蓝色)混合(绿色)Fig. 5 The mix(green) of the plasma (yellow) and diluent (blue)
当混合完全且芯片停止后,通过 U 形微流通道的毛细力引发虹吸作用。然后再以 3000 rpm的转速沿顺时针方向旋转芯片 40 s。稀释的血浆流出混合槽,并进入分离通道,填充 21 个比色孔和隔离的废液池。其中,21 个比色孔按顺序填充,而剩余的稀释血浆流入废液池,如图 6。
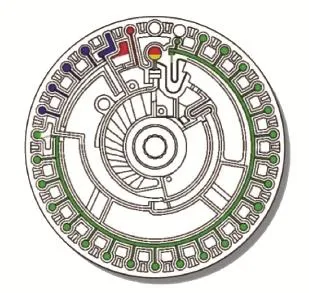
图 6 完成稀释后的血浆(绿色)进样Fig. 6 The diluted plasma(green) entering into the cuvettes
各比色孔都有一个单一通道,液流和空气可经该通道进入和排放。通过电机对芯片的控制,液流从通道入口的一侧向下流,空气则从另一侧排出。液流束的大小可通过虹吸的阻力、芯片的旋转速度和其余流体前端的压力来进行控制。同时芯片必须旋转得足够快,以克服通道入口(宽0.50 mm 和高 0.14 mm)的毛细力。芯片的每个比色孔中含有一个或两个适合于特定检测项目的冻干试剂小球,这些小球在稀释血浆填充比色孔时随即完全溶解。
所有的比色孔充满之后,过量的稀释血浆被分隔于废液池中,并使芯片从 1000 rpm 顺时针方向旋转变为 1000 rpm 逆时针方向旋转,持续60 s。这种混合会在比色孔中形成漩涡模式,它能够使试剂和稀释液充分混合,并完成生物化学反应,如图 7。
分析仪的分光光度计通过与芯片旋转同步闪烁的氙灯来监测所有比色孔中的反应,持续时间为 3.5 min。同时分析仪通过感测芯片比色孔间 45 度楔形件来对比色孔进行定位。每次旋转时,处理器会选择对特定的比色孔进行曝光,同时选择特定的波长进行测定。

图 7 稀释血浆和试剂混合并完成生化反应Fig. 7 The mix of diluted plasma and reagents and biochemical reactions fulfilled
3 结 果
3.1 比色孔光程的重复性
3.2 液体定量和混合的精密度
由于光程和仪器所产生误差是较小的,我们使用芯片在 Celercare M1 分析仪上通过测定英国朗道公司水平 3 质控血清样本(批号 496UE)血糖结果的精密度来粗略评估芯片对样本和稀释液定量以及两者混合的精密度。使用质控样本在Celercare M1 分析仪上重复测定 20 次,血糖的平均值为 7.1 mmol/L,变异系数为 1.4%。
3.3 使用芯片测定生化项目的精密度
在测量过程中误差的来源包括:血浆定量、稀释液的定量、血浆和稀释液混合的均匀程度,试剂和样本空白比色孔的光程,试剂的不精密度,仪器与仪器间的差异,仪器噪声以及在分析仪上测定质控品的变化。我们依据 CLSI EP5-A 文件[11]的要求进行精密度试验,选择英国朗道公司水平 2 和水平 3 质控血清(水平 2 批号729UN,水平 3 批号 496UE)作为实验样本,使用检测芯片在 Celercare M1 分析仪上对此 2 个水平的样本重复测定 20 次,计算均值()、标准差(s)和变异系数(CV),得到各生化项目批内精密度相关数据。对此两个浓度水平的样本每天测定1 次,连续测定 20 天,计算均值、标准差和变异系数,得到各生化项目日间精密度相关数据。我们对 15 项生化检测项目的精密度进行了测定,包括葡萄糖(GLU)、羟丁酸脱氢酶(α-HBDH)、乳酸脱氢酶(LDH)、天门冬氨酸氨基转移酶(AST)、肌酸激酶(CK)、总蛋白(TP)、清蛋白(ALB)、总胆红素(TBIL)、丙氨酸氨基转移酶(ALT)、γ-谷氨酰基转移酶(GGT)、碱性磷酸酶(ALP)、尿素(UREA)、肌酐(Cr)、尿酸(UA)、胆固醇(CHOL)。各项目的批内精密度和日间精密度结果见表 1。
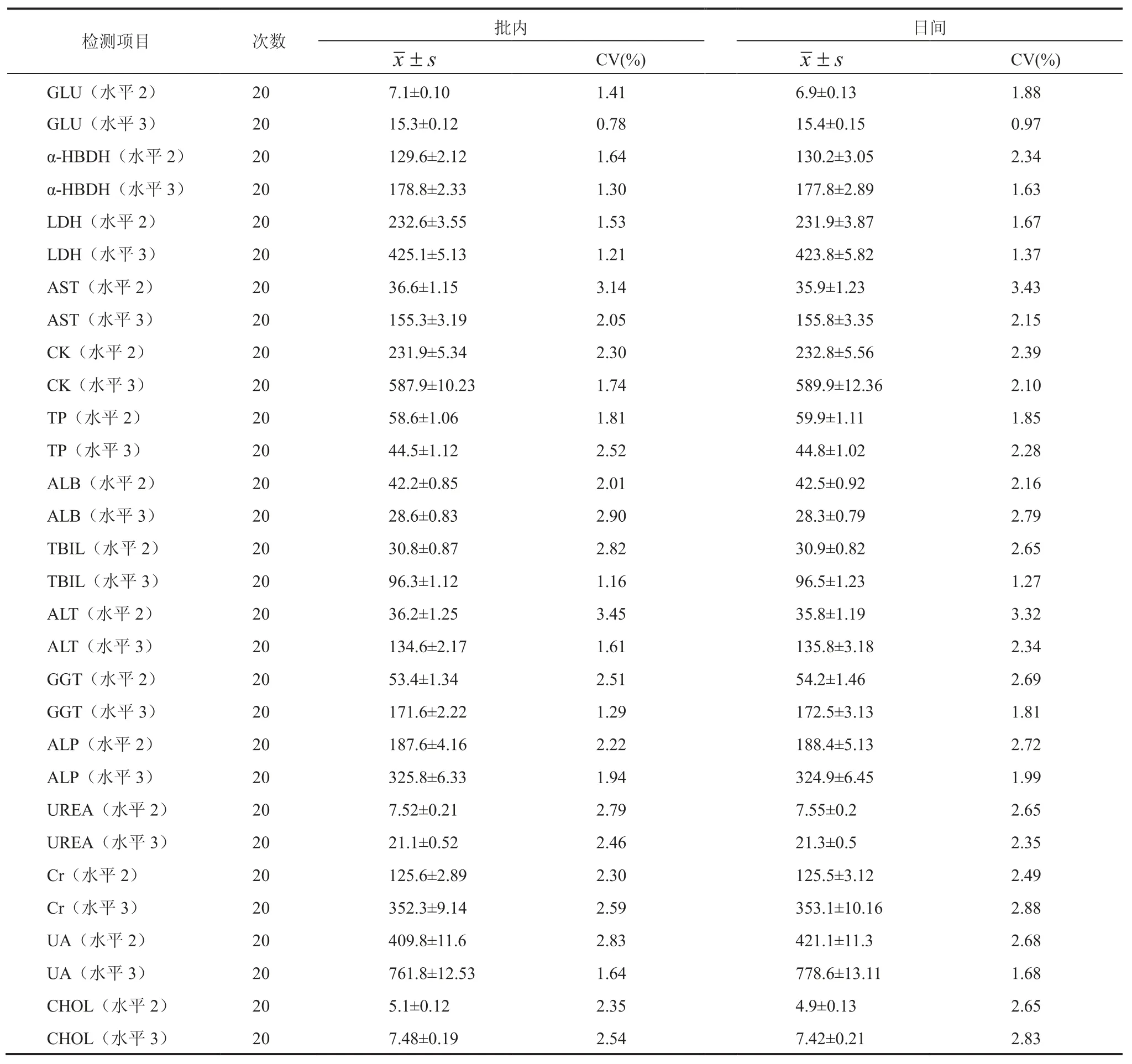
表 1 检测芯片测定生化项目批内和日间精密度结果Table 1 The results of within-run and day-to-day precision for biochemical items by microfluidic chip
4 讨 论
微流控芯片技术具有消耗试剂少、所需样本少、检测时间短、成本低、操作简便以及易于集成等优点[3,4]。该芯片将样本预处理和检测过程集成于一体,全血、血清及血浆等样本都可用于测定。分析时只需将 90 μL 样本经样本孔注入含冻干试剂的芯片中,并经稀释液孔将 450 μL 稀释液注入芯片中就可进行定量分析。该芯片与便携式 Celercare M1 分析仪配套使用,10 分钟左右即能完成同一患者样本的多项测试,最多可一次性获得 14 项生化分析结果,操作简便,检测效率高,且可以在各种不同场合使用。然而该芯片仍然有需要进一步改进的地方,例如需要手工进样等。另外该芯片为一次性使用芯片,每次只能检测一份样本,因此该检测芯片不适用于批量标本的快速检测。
使用芯片进行测定时,芯片本身对测定结果不精密度的影响因素包括不同芯片之间比色孔光程的重复性,以及血浆和稀释液定量的精密度和两种液体混合均匀的一致程度。经试验芯片比色孔光程精密度的变异系数在0.08%~0.52%。血浆和稀释液定量和混合的精密度变异系数小于 2%。
使用英国朗道公司水平 2 和水平 3 质控血清样本作为实验样本,用检测芯片在 Celercare M1分析仪上测定各生化项目在两个水平下的批内和日间精密度。结果显示,15 个生化项目批内精密度的变异系数在 0.78%~3.45%,而日间精密度的变异系数在 0.97%~3.43%。这表明使用该芯片用于临床生化项目的检测时各项目的精密度符合临床检测的要求。
本文从芯片检测原理、特点以及临床应用评估等方面介绍了 POCT 生化检测芯片。该微流控生化芯片与传统检验发挥各自优势,根据不同的需要,形成相辅相成的互补形式。随着芯片实验室以及家庭诊疗的日益发展,相信该微流控芯片未来在临床检测领域必有广阔的应用前景,并推动检验医学的发展。
[1] Chin CD, Linder V, Sia SK. Commercialization of microfluidic point-of-care diagnostic devices [J]. Lab on a Chip, 2012, 12: 2118-2134.
[2] Brouwer N, van Pelt J. Validation and evaluation of eight commercially available point of care CRP methods[J]. Biosensors and Bioelectronics, 2015, 439: 195-201.
[3] Mirasoli M, Guardigli M, Michelini E, et al. Recent advancements in chemical luminescence-based labon-chip and microfluidic platforms for bioanalysis [J]. Journal of Pharmaceutical and Biomedical Analysis, 2014, 87: 36-52.
[4] Luppa PB, Müller C, Schlichtiger A, et al. Pointof-care testing (POCT): current techniques and future perspectives [J]. TrAC Trends in Analytical Chemistry, 2011, 30(6): 887-898.
[5] Anderson DA, Crowe SM, Garcia M. Point-ofcare testing [J]. Current HIV/AIDS Reports, 2011, 8(1): 31-37.
[6] Lee BS, Lee YU, Kim HS, et al. Fully integrated lab-on-a-disc for simultaneous analysis of biochemistry and immunoassay from whole blood [J]. Lab on a Chip, 2011, 11(1): 70-78.
[7] Jin SQ, Guo SM, Zuo P, et al. A cost-effective Z-folding controlled liquid handling microfluidic paperanalysis device for pathogen detection via ATP quantification [J]. Biosensors and Bioelectronics, 2015, 63(2): 379-383.
[8] Srinivasan V, Pamula VK, Fair RB. An integrated digital microfluidic lab-on-a-chip for clinical diagnostics on human physiological fluids [J]. Lab on a Chip, 2004, 4(4): 310-315.
[9] Sia SK, Kricka LJ. Microfluidics and point-of-care testing [J]. Lab on a Chip, 2008, 8(12): 1982-1983.
[10] 陈永强, 张涛, 王鹗, 等. 激光诱导荧光检测微流控芯片生化分析仪的研制 [J]. 分析化学, 2008, 36(1): 127-131.
[11] EP5-A. Evaluation of precision performance of quantitative measurement methods: approved guideline-second edition [S]. CLSI, 2004.
A Centrifugal Microfluidic Chip for Biochemical Analysis
DAI Yonghui1CHEN Tan2WANG Zhanhui3
1(The Clinical Laboratory of Guangdong Provincial Hospital of Chinese Medicine,Guangzhou510120,China)
2(Tianjin Mnchip Technologies Company Limited,Tianjin300457,China)
3(Shenzhen Institutes of Advanced Technology,Chinese Academy of Sciences,Shenzhen518055,China)
In this paper, a low-cost, rapid, automated centrifugal microfluidic chip for biochemical analysis was presented. The chip integrates sample pre-processing and multi-biochemical items assay. Through multi-level microfluidic channels and micro-siphon valves, the chip combines the pre-treatment of samples, sample transportation and the reaction processes between sample and biochemical reagent. The results are obtained by colorimetric detection. It is shown that the reproducibility of cuvette pathlength for chip is from 0.08% to 0.52%. The coefficient of variation (CV) of sample, diluents metering and mixing for chip by the CV of blood glucose results is 1.4%. The CV of day-to-day and within-run precision for 15 biochemical items are less than 3.5%. Therefore, it is concluded that the centrifugal microfluidic chip for biochemical analysis can satisfy the clinical testing requirements.
microfluidic chip; biochemical analysis; point-of-care testing
R 331
A
2014-05-24
:2015-03-17
戴永辉,硕士,研究方向为 POCT 诊断技术及其临床应用;陈坦,硕士,研究方向为 POCT 微流控生化分析芯片;王战会(通讯作者),研究员,博士生导师,研究方向为微流控检测技术和 POCT 医疗器械,E-mail:zh.wang@siat.ac.cn。

