外部因素对酒精酵母GJ2008果糖与葡萄糖酒精发酵的影响
左 松, 伍时华, 张 健, 赵东玲, 粱发剑, 黄翠姬
(广西科技大学 生物与化学工程学院,广西 柳州545006)
外部因素对酒精酵母GJ2008果糖与葡萄糖酒精发酵的影响
左 松, 伍时华, 张 健, 赵东玲*, 粱发剑, 黄翠姬
(广西科技大学 生物与化学工程学院,广西 柳州545006)
在高体积分数乙醇胁迫下,考察糖比例、微通氧和温度等外部因素对果糖与葡萄糖利用及其差异性的影响,旨在为高浓度甘蔗汁发酵生产酒精提供参考和依据。用YPDF培养基模拟甘蔗汁,调节乙醇体积分数为11.2%,初始酵母数为1.40×108个/mL进行酒精发酵,测定发酵过程中果糖与葡萄糖质量分数,并采用曲线下面积法对果糖与葡萄糖代谢曲线进行分析。在高体积分数乙醇胁迫条件下,葡萄糖质量分数占初总糖质量分数40%及以上时,果糖代谢会严重地受到葡萄糖的代谢阻遏;微通氧可有效地缩小发酵后期果糖/葡萄糖利用差异性,提高乙醇产率61.70%;较低温度明显有利于发酵后期酵母数的维持;相比外源乙醇,糖的代谢更易受到内源乙醇的影响。酒精酵母GJ2008对葡萄糖有一定偏好性,然而此种偏好性不会受到外部因素的影响。对高体积分数甘蔗汁酒精发酵而言,发酵后期需保证微通氧和较低温环境,并应尽可能减少发酵后期葡萄糖的含量,从而去除葡萄糖对果糖的代谢调控作用。
糖比例;果糖;葡萄糖;微通氧;酒精发酵
甘蔗汁主要含糖为蔗糖,酒精发酵过程中,1分子蔗糖水解为1分子果糖和1分子葡萄糖,果糖和葡萄糖共用一套膜运输和酶催化体系[1],但葡萄糖对膜运输和酶的亲和力均大于果糖,因而酵母往往优先利用葡萄糖,使得果糖成为发酵后期主要残糖,此时发酵液营养缺乏和乙醇浓度高更使得果糖代谢缓慢甚至停滞(此种现象被定义为果糖/葡萄糖利用差异性)。在以蔗糖为基质的高浓度酒精发酵过程中均不可避免地遇到上述问题,但并没有引起足够的重视,主要是由于蔗糖的水解过程限制了果糖/葡萄糖利用差异性的研究(葡萄汁中含有几乎等量果糖和葡萄糖,其果糖/葡萄糖利用差异性的研究被广泛开展)。
目前,甘蔗汁酒精发酵过程中蔗糖的消耗已得到了初步研究[2-3],普遍表明在发酵过程中随着蔗糖的水解,果糖积累的速度要明显高于葡萄糖,但无法证明是否为葡萄糖对果糖的竞争性抑制作用导致了酵母对果糖的消耗速率降低。为了消除葡萄糖的竞争性抑制作用对果糖消耗的影响,进行了高浓度果糖或葡萄糖单糖酒精发酵 (糖质量浓度≥250 g/L),发酵至后期,果糖消耗速率明显低于葡萄糖消耗速率,说明果糖/葡萄糖利用差异性在逐步拉大,分析认为可能是由于高浓度乙醇造成了上述现象的产生。作者采取“模拟高浓度甘蔗汁酒精发酵后期”的方法,以果糖、葡萄糖和果糖与葡萄糖为底物进行单糖和混合糖酒精发酵,研究过程中果糖与葡萄糖消耗及果糖/葡萄糖利用差异性受糖比例、微通氧和温度等的影响,以期解释清楚上述现象,并为高浓度甘蔗汁酒精发酵工业提供参考和依据。
1 材料与方法
1.1 菌株
酒精酵母GJ2008(Saccharomyces cerevisiae),为甘蔗汁酒精发酵高产菌株,由广西科技大学发酵工程研究所提供。
1.2 培养基
斜面活化培养基:葡萄糖20 g/L,蛋白胨20 g/ L,酵母浸膏10 g/L,琼脂20 g/L。一级种子培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸膏10 g/L,自然pH。二级种子培养基:葡萄糖100 g/L,蛋白胨20 g/L,酵母浸膏10 g/L,自然pH。YEP溶液:蛋白胨400 g/L,酵母浸膏200 g/L。以上培养基和溶液均在115℃下高压蒸汽灭菌30 min。
YPDF培养基1:无菌水配制乙醇溶液的体积分数为12%,取180 mL加入500 mL锥形瓶中,后加入YEP溶液10 mL,设定果糖与葡萄糖质量比分别为100∶0、4∶1、3∶2、2∶3、1∶4和0∶100,加入食品级果糖与葡萄糖调节总糖质量浓度为(83.28±2.32)g/L。
YPDF培养基2:无菌水配制乙醇溶液的体积分数为12%,取180 mL加入500 mL锥形瓶中,后加入YEP溶液10 mL,设定果糖与葡萄糖质量比为1∶1,加入食品级果糖与葡萄糖调节总糖质量浓度为(81.40±0.70)g/L。
YPDF培养基3:无菌水配制乙醇溶液的体积分数为12%,取180 mL加入500 mL锥形瓶中,后加入YEP溶液10 mL,加入食品级果糖或葡萄糖调节总糖质量浓度为(85.85±2.39)g/L。
YPDF培养基4:蒸馏水配制果糖或葡萄糖溶液300 g/L,取190 mL加入500 mL锥形瓶中,后加入YEP溶液10 mL,实际果糖或葡萄糖质量浓度为(294.90±11.04)g/L。
1.3 发酵方法
将实验室保存菌种接至斜面活化培养基上,30℃条件活化培养1~2 d,待其斜面上长出白色菌落,即菌种培养成熟。将已活化的斜面种子转接至一级种子培养基中,32℃,摇床120 r/min,培养12 h后10%接种量转接至二级种子培养基中,32℃,摇床120 r/min,培养10 h后离心弃上清,湿酵母泥备用。
糖比例实验培养方法:将湿酵母泥 (50%接种量)转接至200 mL YPDF发酵培养基1中(500 mL锥形瓶)进行果糖与葡萄糖混合发酵,初始酵母数为1.70×108左右,28℃,摇床120 r/min培养,每份2个平行,测定结果取平均值。发酵过程中每隔4 h取样并测CO2失重,至CO2失重小于0.2 g时,即发酵结束。培养条件为非严格厌氧即微通氧,用透气封口膜(16 cm×16 cm,透气率85%)和牛皮纸包扎。
微通氧实验培养方法:接种方法同上 (接入YPDF发酵培养基2中),初始酵母数为1.11×108左右,32℃,摇床120 r/min培养,每份2个平行,测定结果取平均值。取样方法同上。培养条件为厌氧与微通氧对比,厌氧条件为发酵栓密封锥形瓶(发酵栓内加入浓硫酸液封),瓶口塞上有取样口;微通氧条件为透气封口膜(16 cm×16 cm,透气率85%)和牛皮纸包扎锥形瓶。
温度实验培养方法:接种方法同上(接入YPDF发酵培养基3中),初始酵母数为1.33×108左右,28、32、36℃,摇床120 r/min培养,每份2个平行,测定结果取平均值。取样方法同上。培养条件为非严格厌氧即微通氧,用透气封口膜(16 cm×16 cm,透气率85%)和牛皮纸包扎。内源乙醇实验接种方法同上(接入YPDF发酵培养基4中),发酵温度为32℃,其余的同温度实验。
1.4 分析方法
还原糖采用SGD-IV全自动还原糖测定仪测定:标准葡萄糖质量浓度为10 g/L,发酵上清液稀释至合适浓度进样分析;葡萄糖采用SBA-40C生物传感分析仪测定:标准葡萄糖质量浓度1 g/L,发酵上清液稀释至合适浓度进样分析,故果糖质量浓度(g/L)=还原糖质量浓度 (g/L)-葡萄糖质量浓度(g/ L)。生物量的测定:取发酵液1 mL,12 000 r/min离心2 min,上清液-60℃冷冻(用以测糖质量浓度和乙醇体积分数),无菌水洗涤酵母泥并离心弃上清,酵母泥在80℃烘箱烘干至恒重。酒精度采用生物传感分析仪SBA-40C测定:标准乙醇体积分数0.075%,发酵上清液稀释至合适浓度进样分析。
1.5 糖代谢曲线分析
采用“曲线下面积法”来评估外部因素对果糖与葡萄糖利用及其差异性的影响,此法为Liccioli首次在葡萄汁(等量果糖与葡萄糖)发酵中提出[4],果糖和葡萄糖的代谢曲线运用GraphPad Prism 5软件进行绘制,并分别获得果糖与葡萄糖代谢曲线下面积(Area under the fermentation curve/AUC),记做果糖AUC和葡萄糖AUC(AUC越小,表明糖利用速率越快)。
2 结果和讨论
2.1 糖比例对果糖与葡萄糖酒精发酵的影响
2.1.1 糖比例对糖代谢的影响 在高体积分数乙醇和不同糖比例条件下,酵母GJ2008果糖和葡萄糖代谢曲线见图1,随着培养基中葡萄糖比例的提高,发酵初期,酵母GJ2008对果糖的利用逐步变慢,至葡萄糖质量分数占总糖3/5时,果糖利用完全停滞,表明葡萄糖的存在严重地影响了果糖的代谢。分析如下,在培养基中果糖比例由1/5提高至3/ 5时,果糖运输的机会增加,但果糖利用没有明显加快,在培养基中果糖比例由3/5提高至4/5~5/5时,果糖运输的机会再次增加,果糖利用加快。酵母GJ2008在0~4 h发酵时间段内消耗的总糖基本相同,说明在这段时间内,酵母代谢所需糖的量是一定的,当葡萄糖的量可以满足酵母发酵时,酵母对果糖几乎不利用,当葡萄糖的量不能满足酵母发酵时,饥饿的酵母不得不利用无偏好性的果糖。从目前掌握的信息来看,等浓度果糖或葡萄糖单糖发酵,无论是正常发酵,还是高体积分数乙醇胁迫下发酵,发酵初期果糖与葡萄糖消耗速率相当,因此上述现象的产生只能归因与一定比例的葡萄糖存在代谢调控机制,证实了Liccioli的说法[4](混合发酵时葡萄糖代谢调控作用很大程度上影响了果糖的代谢)。从表1可知,在不同糖比例条件下,葡萄糖AUC总是小于对应的果糖AUC,而且总糖中葡萄糖比例越高时,果糖AUC与葡萄糖AUC之和越小,表明酵母GJ2008对葡萄糖有一定的偏好性,且此种偏好性不会受到果糖与葡萄糖比例的影响。
另一方面,乙醇会影响果糖/葡萄糖利用差异性,Berthels指出,乙醇对果糖或葡萄糖的膜运输蛋白的作用不同,从而差异性地影响了其与果糖和葡萄糖的亲和性[5],但作者研究表明,全果糖或全葡萄糖发酵时,发酵初期,果糖与葡萄糖的利用并不存在差异性,反而是发酵后期,果糖/葡萄糖利用差异性逐渐拉大,表明除了酵母本身偏好葡萄糖的内在特性外,发酵过程中酵母所产生的内源乙醇更可能是导致后期果糖/葡萄糖利用差异性拉大的原因。

图1 不同糖质量比条件下酵母GJ2008果糖与葡萄糖消耗曲线Fig.1 Profiles of fructose and glucose concentrations during theethanolfermentation from YPDF media by S.cerevisiae GJ2008 atthe sugar concentration of 80g/L with different hexose ratios
2.1.2 糖比例对细胞生成和CO2生成的影响 在不同糖质量比条件下,酵母GJ2008果糖与葡萄糖发酵时,酵母干重和CO2生成曲线见图2,随着总糖中果糖比例的增加,最终发酵所得酵母干重和CO2生成量均逐渐略微提高,表明果糖发酵乙醇具有一定的潜力,虽然其糖利用完全时间相对延长。

表1 不同糖质量比条件下酵母GJ2008果糖与葡萄糖代谢曲线下面积Table 1 Area under the metaboliccurves for fructose and glucose fermentations by S.cerevisiae GJ2008 of media at the sugar concentration of 80g/L with different hexose ratios

图2 不同糖质量比条件下酵母GJ2008果糖与葡萄糖混合发酵细胞生成和CO2生成曲线Fig.2 Profiles of biomass production and CO2accumulation during the ethanol fermentation from YPDF media by S.cerevisiae GJ2008 at the sugar concentration of 80 g/L with different hexose ratios
2.2 微通氧对果糖与葡萄糖酒精发酵的影响
2.2.1 微通氧对糖代谢的影响 在高体积分数乙醇胁迫下,酵母GJ2008果糖和葡萄糖代谢曲线见图3。厌氧与微通氧条件下,发酵0~8 h,果糖与葡萄糖代谢曲线几乎重合,这一现象的出现应该是由于发酵初期锥形瓶内有一定的氧气(即两种培养条件下发酵初期内环境几乎没有差别),造成发酵初期糖代谢曲线重合;当发酵至12 h,发酵栓所包扎的锥形瓶内部氧气被酵母消耗殆尽,故两种培养条件下果糖与葡萄糖利用曲线开始逐步拉开,并且后期果糖曲线拉开程度明显大于葡萄糖。发酵8~12 h,果糖利用明显停滞,这一现象的出现应该与葡萄糖代谢调控有关(见2.1论述部分)。发酵12~16 h,果糖利用又开始加快,分析认为葡萄糖代谢阻遏效应是有条件的,后期总糖含量不能满足酵母代谢所需,葡萄糖代谢阻遏效应减弱,故果糖代谢加快。
另一方面,厌氧与微通氧条件下,葡萄糖AUC总是小于对应的果糖AUC(表2),而且微通氧条件下,葡萄糖AUC或果糖AUC均明显小于厌氧条件下的,表明在高体积分数乙醇胁迫下,酵母GJ2008对葡萄糖有明显的偏好性,且此种偏好性不会受到氧气条件的影响。

图3 厌氧与微通氧条件下酵母GJ2008果糖与葡萄糖消耗曲线Fig.3 Profiles of fructose and glucose concentrations during theethanolfermentation from YPDF media by S.cerevisiae GJ2008 under anaerobic and micro-aeration conditions

表2 厌氧与微通氧条件下酵母GJ2008果糖与葡萄糖代谢曲线下面积Table 2 Area under the metabolic curves for fructose and glucose fermentations by S.cerevisiae GJ2008 of media under anaerobic and micro-aeration conditions
2.2.2 微通氧对细胞生成和CO2生成的影响 在厌氧与微通氧条件下,酵母GJ2008果糖与葡萄糖混合发酵时,酵母干重和CO2生成曲线见图4。发酵前期,两种培养条件下干重或CO2累积差值较小,与糖代谢曲线对应(图3);发酵至后期,两种培养条件下干重或CO2累积差值逐渐拉大,结果厌氧条件下所产生物量要明显高于微通氧条件下的,但前者CO2累积速率明显低于后者,表明在微通氧条件下,其细胞增殖略慢,但发酵速率较快。
在高体积分数乙醇条件下,酵母的发酵活力会受到影响,其影响的程度与酵母菌的耐乙醇性能相关[6]。Damore等[7]指出酵母菌的耐乙醇性能与类固醇和不饱和脂肪酸等密切相关,特别是不饱和脂肪酸,其作用为能增加细胞膜流动性,使细胞膜紧凑,会明显改善酵母的耐乙醇性能。在厌氧条件下,类固醇和不饱和脂肪酸不能得到合成[8],从而酵母的耐乙醇性能会受到影响,导致酵母的发酵活力不能得到有效维持,因此厌氧条件下发酵较为缓慢。
2.3 温度对果糖或葡萄糖单糖酒精发酵的影响
不同温度下,酵母GJ2008果糖与葡萄糖单糖发酵时,酵母干重和CO2生成曲线见图5。从图5(a)~(d)可以看出,发酵初期,不同温度下干重或CO2累积差值均较小,与糖代谢曲线对应(温度对糖代谢的影响不明显,故未给出);发酵至后期,不同温度下酵母数维持值逐渐拉大,表现为低温条件下所产生物量要明显高于高温条件下的,但后者发酵过程中CO2累积要略快于前者,表明低温发酵有利于酵母数的维持,但发酵速率略慢。需要指出的是,在28℃时,果糖所产生物量比葡萄糖所产生物量高出4.76%,而在32~36℃时,果糖所产生物量与葡萄糖所产的生物量相等,表明在28℃,以果糖进行高浓度酒精发酵可获得最多酵母数。对于高浓度甘蔗汁酒精发酵而言,发酵至后期,发酵液中主要残糖为果糖,因此可根据此信息调整发酵温度。
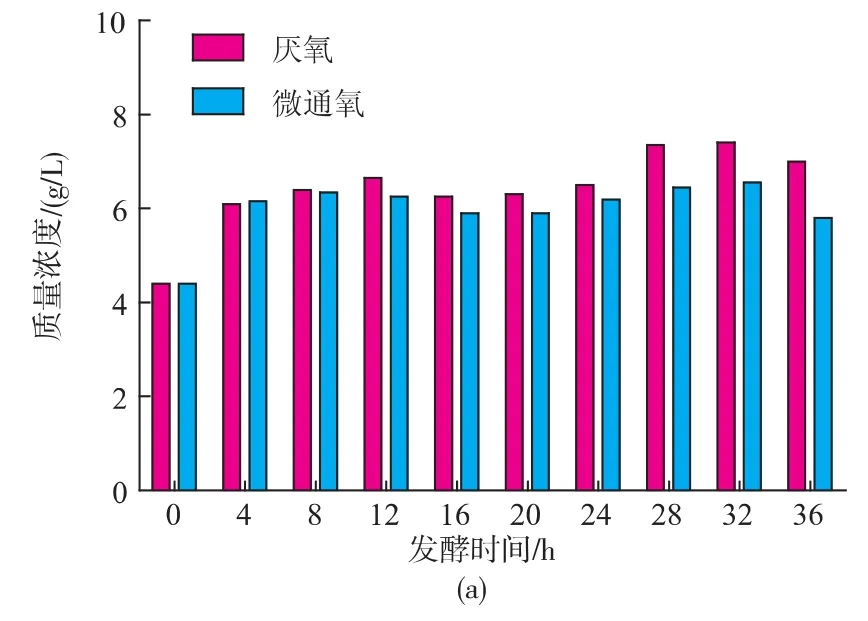

图4 厌氧与微通氧条件下酵母GJ2008果糖与葡萄糖混合发酵细胞生成和CO2生成曲线Fig.4 Profiles of biomass production and CO2accumulation during the ethanol fermentation from YPDF media by S.cerevisiae GJ2008 under anaerobic and micro-aeration conditions
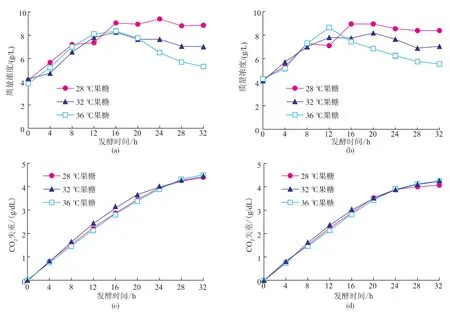
图5 不同温度下酵母GJ2008果糖与葡萄糖混合发酵细胞生成和CO2生成曲线Fig.5 Profiles of biomass production and CO2accumulation during the ethanol fermentation from YPF and YPD media by S.cerevisiae GJ2008 at different temperature ranging from 28~36℃ (A-biomass from fructose,B-biomass from glucose,C-CO2release from fructose and D-CO2release from glucose)
2.4 不同条件下最终发酵结果
不同糖比例条件下发酵结果表明(表4),随着果糖比例在培养基中的提高,最终乙醇产率和发酵效率均随之提高(质量比为4∶1组例外),表明果糖用于产乙醇具有一定的优势;厌氧与微通氧条件下发酵表明,无论是乙醇产率还是发酵效率,前者均明显低于后者,表明微通氧对高浓度酒精发酵至关重要,是高浓度酒精发酵必不可少的因素之一。不同温度下,果糖或葡萄糖发酵结果表明,温度对乙醇产率的影响并不显著(结果未给出),但结合图5可知,较低温度明显有利于发酵后期酵母数的维持。对酒精发酵工业而言,酵母泥可作为饲料出售,具有一定的经济价值,故高体积分数乙醇胁迫下,发酵后期最适发酵温度为28℃。
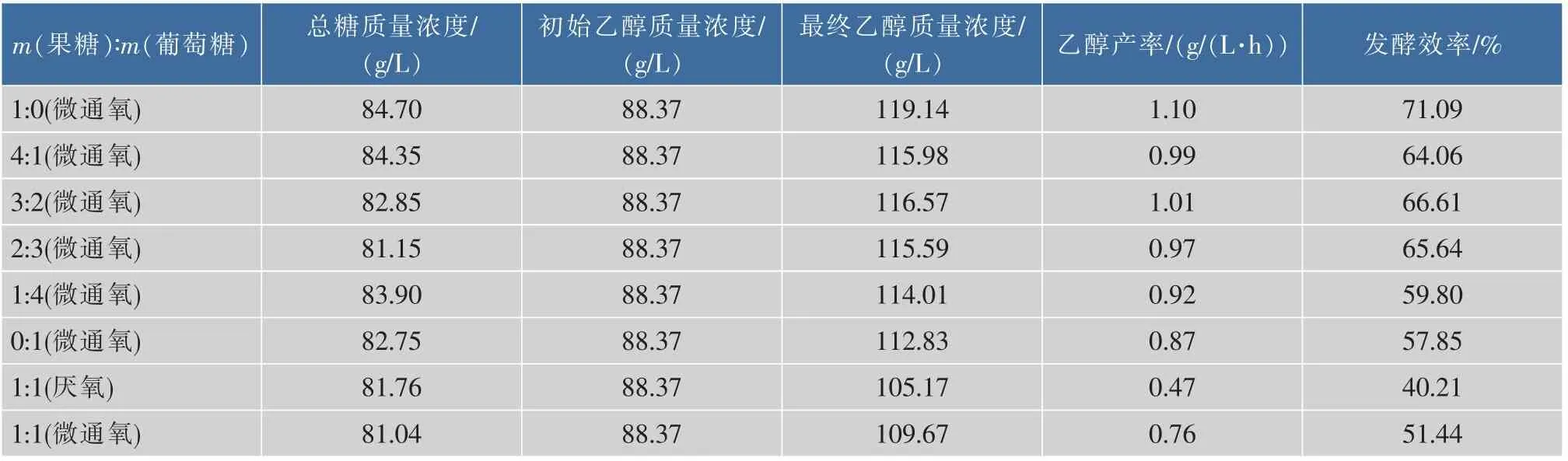
表4 不同条件下酒精酵母GJ2008甘蔗汁酒精发酵参数Table 4 Performances of S.cerevisiae GJ2008 in YPDF medium under different culture conditions
2.5 高质量浓度果糖或葡萄糖单糖酒精发酵
2.1 中指出,发酵过程中酵母所产生的内源乙醇更可能是导致后期果糖/葡萄糖利用差异性拉大的原因,为了证实上述设想,故配制高质量浓度果糖或葡萄糖进行单糖酒精发酵 (50%接种量去除底物抑制作用),对比外源乙醇与内源乙醇对果糖/葡萄糖利用差异性的影响。
运用软件Origin 8.0拟合出高质量浓度果糖和葡萄糖发酵时间点分别为15.1、13.5 h,此时乙醇体积分数分别为10.68%和9.97%(由CO2失重拟合得出),与2.1中外源乙醇体积分数(11.20%)接近,果糖和葡萄糖质量浓度分别为87.8和86.6 g/L(与外源乙醇组的初糖质量浓度相等)。内源乙醇与外源乙醇发酵对比(图6),表明比糖代谢速率更易受到内源乙醇的影响。另一方面,比果糖代谢速率与比葡萄糖代谢速率受内源乙醇的影响相比,并无差异,否定了2.1中的猜想即“发酵过程中酵母所产生的内源乙醇更可能是导致后期果糖/葡萄糖利用差异性拉大的原因”,而发酵过程中酵母的活性强弱似乎与这一差异性有关,即活性稍弱的酵母其果糖利用性能要逊于葡萄糖。

图6 内源乙醇与外源乙醇下酵母GJ2008比果糖与葡萄糖消耗速率曲线Fig.6 Profiles of specific sugar consumption rates during the ethanol fermentation from YPF or YPD media by S.cerevisiaeGJ2008 underendogenousand exogenous ethanol
3 结语
在高体积分数乙醇下,糖比例、微通氧和温度等外部因素对果糖与葡萄糖酒精发酵的影响表明,葡萄糖含量占初总糖40%及以上时,果糖代谢会严重地受到葡萄糖的代谢阻遏;微通氧可有效地缩小发酵后期果糖/葡萄糖利用差异性,提高乙醇产率61.70%;较低温度明显有利于发酵后期酵母数的维持;相比外源乙醇,糖的代谢更易受到内源乙醇的影响;酒精酵母GJ2008对葡萄糖有一定偏好性,然而此种偏好性不会受到外部因素的影响。
因此,对高浓度甘蔗汁酒精发酵而言,发酵后期需保证微通氧和较低温环境,并应采取相应措施如定向进化策略或膜运输蛋白基因HXT的改变以加快发酵前期葡萄糖的利用,减少发酵后期葡萄糖的含量,从而缓解或消除发酵后期葡萄糖对果糖的代谢调控作用,进而缩短最终发酵时间和提高整体发酵性能。
[1]NeleJ.Berthels,RicardoR.Cordero otero,FlorianF.Bauer,et al.Correlation between glucose/fructose discrepancy and hexokinase kinetic properties in different Saccharomyces cerevisiae wine yeast strains[J].Appl Microbiol Biotechnol,2008,77(5):1083-1091.
[2]郭青松.不同糖浓度甘蔗汁酒精发酵过程的试验研究[D].柳州:广西工学院,2012.
[3]李丹.酒精高糖发酵及酵母固定化研究[D].广州:华南理工大学,2011.
[4]Tommaso Liccioli.Improving fructose utilization in wine yeast using adaptive evolution[D].Adelaide:University of Adelaide,2010.
[5]Berthels N J,Cordero Otero R R,Bauer F F.Discrepancy in glucose and fructose utilisation during ferm-entation by Saccharomyces cerevisiae wine yeast strains[J].FEMS Yeast Research,2004,4(7):683-689.
[6]Hyeon-Beom Seo,Ji-Hyeon Yeon,MyungHoon Jeong,et al.Aeration Alleviates Ethanol Inhibition andGlycerol Production During Fed-batch Ethanol Fermentation[J].Biotechnol Bioproc E,2009,14(5):599-605.
[7]Damore T,Panchal CJ,Russell I,et al.A study of ethanol tolerance in yeast[J].Crit Rev Biotechnol,1990,9:287-304.
[8]Legodi,Lesetja Moraba.Improving wine yeast for fructose and nitrogen utilization[D].Stellenbosch:Stellenbosch University,2008.
Influence of External Factors on Fructose and Glucose Fermentations by Saccharomyces cerevisiae GJ2008
ZUO Song, WU Shihua, ZHANG Jian, ZHAO Dongling*, LIANG Fajian, HUANG Cuiji
(School of Biological and Chemical Engineering,Guangxi University of Science and Technology,Liuzhou 545006,China)
The external factors affecting the differences between fructose and glucose consumptions and fermentations under high concentrations of ethanol were investigated by the effects of hexose ratio,micro-aeration and temperature to provide basis for the alcoholic fermentation of high gravity sugarcane juice.Sugarcane juice was simulated using YPDF medium and fermented under ethanol concentration of 11.2% (v/v)and with an initial yeast number of 1.40×108cells/mL.The concentrations of fructose and glucose in the process of fermentation were determined by HPLC. Metabolic curves of fructose and glucose fermentation were analyzed and fitted by the area under the curve (AUC)method.The fructose metabolism was seriously impeded by the glucose metabolismunder high concentrations of ethanol if the initial glucose was more than 40%of total sugar. Micro-aeration could effectively reduce the differences between fructose and glucose consumptions during the late stages of the fermentation,and the ethanol productivity was raised by 61.70%.Low temperature was apparently favorable to maintain the final biomass,while sugar metabolism was susceptible to the endogenous ethanol rather than the exogenous ethanol.In addition,there was a preference to glucose for S.cerevisiae GJ2008,however,the preference was not affected by the environmental factors.For the alcoholic fermentation of high gravity sugarcane juice,it is recommended to maintain a micro-aeration and a low temperature condition during the late stages of the fermentation,in which stages the glucose concentration should be well reduced to remove its metabolic repression to fructose.
hexose ratio,fructose,glucose,micro-aeration,ethanol fermentation
Q 815
A
1673—1689(2015)07—0764—08
2014-06-11
广西科技攻关项目(桂科攻0782003-2);广西科技大学科学基金(校科自1307105)。
*通信作者:赵东玲(1965-),男,湖南衡阳人,工程师,主要从事微生物发酵研究。E-mail:dlzhao168@126.com

