参芪扶正注射液对溃疡性结肠炎患者大肠黏膜CX3CR1的影响*
赵昌东,张小节△,张 磊,罗红波,陈 娴,张 辉,张一峰
(蚌埠医学院附属连云港市第二人民医院:1.消化内科 2.病理科,江苏连云港 222023)
论著·临床研究
参芪扶正注射液对溃疡性结肠炎患者大肠黏膜CX3CR1的影响*
赵昌东1,张小节1△,张 磊2,罗红波1,陈 娴1,张 辉1,张一峰1
(蚌埠医学院附属连云港市第二人民医院:1.消化内科 2.病理科,江苏连云港 222023)
目的观察参芪扶正注射液联合柳氮磺吡啶(SASP)治疗溃疡性结肠炎(UC)的临床治疗效果,并探讨参芪扶正注射液对UC患者大肠黏膜CX3CR1的影响。方法选择2012年1月至2014 年6月在该院就诊的轻中度活动期UC患者50例,将其分为观察组、对照组,另设健康组15例,观察组予以参芪扶正注射液联合SASP治疗,对照组予以SASP治疗,健康组为空白对照。观察所有UC患者治疗前和治疗2周后的改良Mayo评分结果,并观察健康组及观察组、对照组患者治疗前和治疗后2周同一病变部位大肠黏膜CX3CR1的表达情况。结果UC患者治疗前大肠黏膜CX3CR1总阳性率为88.37%,健康组大肠黏膜CX3CR1总阳性率为20.00%,两者比较差异有统计学意义(Z=-2.689,P<0.01);治疗后2周,观察组大肠黏膜CX3CR1的表达和改良Mayo评分结果均明显低于对照组(P<0.05);观察组临床综合疗效明显优于对照组(Z=-2.085,P<0.05)。结论参芪扶正注射液联合SASP治疗UC疗效明显优于单纯口服SASP,参芪扶正注射液可能通过抑制大肠黏膜CX3CR1的表达而参与了UC的治疗。
结肠炎,溃疡性;肠黏膜;参芪扶正注射液;CX3CR1
溃疡性结肠炎(ulcerative colitis,UC)是消化系统常见病,其发病率呈逐年上升趋势,其病因和发病机制尚未完全阐明,缺乏特效治疗方法。参芪扶正注射液由党参和黄芪组成,党参具有抗溃疡、调节肠道菌群、增强机体免疫应答的作用[1-3],黄芪具有保护肠黏膜相关免疫细胞、维持肠黏膜微循环正常功能、提高肠黏膜抗氧化能力、调节细胞因子和炎症介质的分泌和表达的作用[4-5]。近年来,应用“参芪扶正注射液联合柳氮磺吡啶(SASP)”治疗UC取得了良好的效果,但其治疗UC可能的药物作用机制尚不明确。
近年来,新发现的不规则趋化因子(fractalkine,Fkn,CX3CL1)受体CX3CR1被越来越多的学者重视,现已证实T细胞、NK细胞、单核-巨噬细胞表面存在CX3CR1,CX3CR1具有介导白细胞趋化及黏附的功能[6-7]。有研究表明,CX3CR1可通过与肠腔中的细菌直接接触,捕获细菌抗原,引起一系列的肠道黏膜免疫反应从而参与了UC的发病[8-10]。
本研究拟应用参芪扶正注射液联合SASP治疗轻中度UC,观察其临床疗效,并应用免疫组织化学法观察参芪扶正注射液对UC患者大肠黏膜CX3CR1表达的影响,探讨其治疗UC的可能药物作用机制,从而为溃疡性结肠炎治疗提供新的思路和手段。
1 资料与方法
1.1 一般资料 选择2012年1月至2014 年6月在本院消化内科就诊的门诊及住院轻中度UC(活动期)患者50例,其中男23例,女28例,年龄22~63岁,平均(35.180±9.256)岁,将其分为观察组25例、对照组25例。另设健康组15例。3组在年龄、性别、职业、婚姻状况、教育程度等构成比上差异无统计学意义(P>0.05),具有可比性,观察组与对照组临床严重程度比较差异无统计学意义(P>0.05),具有可比性。所有研究对象均进行临床流行病学调查登记,并经医院伦理委员会批准,根据个人意愿签署知情同意书。
1.2 诊断与入组标准
1.2.1 UC的诊断及严重程度的分级标准 符合2007年济南炎症性肠病诊断治疗规范共识意见的标准[11],确诊为活动期轻、中度UC患者。
1.2.2 临床病例排除标准 (1)所有病例均排除感染性结肠炎、克罗恩病、缺血性结肠炎、放射性结肠炎、大肠癌等疾病;(2)重度患者;(3)年龄在18岁以下或70岁以上,妊娠或哺乳期妇女,过敏体质者;(4)合并精神病,心脑血管、肝、肾和造血系统级等疾病;(5)治疗依从性差者;(6)未按研究要求随诊者;(7)治疗过程中发生严重不良事件者。
1.3 主要试剂 参芪扶正注射液(丽珠集团利民制药厂)、兔抗人CX3CR1多克隆抗体(北京欣兴唐生物科技有限公司),其余试剂由本院病理科提供。
1.4 研究方法
1.4.1 给药方法 观察组应用“参芪扶正注射液250 mL静脉滴注1次/天+SASP 1.0 g口服4次/天”治疗,对照组应用“SASP 1.0 g口服4次/天”治疗,观察组和对照组均2周1个疗程。
1.4.2 观察指标 (1)临床观察指标:观察所有患者治疗前和治疗后2周的排便次数、大便带血情况、内镜下黏膜表现、改良Mayo评分[12]。(2)实验室观察指标:观察对照组及所有UC患者治疗前和治疗后2周同一病变部位大肠黏膜CX3CR1的表达情况。
采用免疫组织化学SP染色法检测大肠黏膜CX3CR1的表达,具体步骤如下:石蜡包埋,切片脱蜡至水,PBS洗3次;0.01 mol/L枸橼酸盐缓冲液(pH 6.0)微波抗原修复,PBS洗3次;3%H2O2室温孵育10 min,消除内源性过氧化物酶的活性;加入封闭用的正常羊血清工作液,室温孵育10~15 min,倾去,风干,勿洗;滴加1∶200稀释的Ⅰ抗(兔抗人 CX3CR1多克隆抗体),37 ℃孵育2 h,置入4 ℃冰箱过夜;PBS洗3次;滴加生物素标记的Ⅱ抗(羊抗兔)37 ℃孵育60 min;PBS洗3次;滴加辣根酶标记链霉卵白素工作液37 ℃孵育10~15 mim;DAB室温显色,蒸馏水清洗,苏木素复染,切片脱水,二甲苯透明,封片及结果判定。
免疫组织化学结果判定:CX3CR1阳性反应为细胞膜呈现不同程度基本均匀的棕黄色颗粒,反之为阴性。根据光镜下染色,阳性细胞分布分为:阳性细胞数小于5%为-;阳性细胞数小于25%为+;阳性细胞数小于75%为++;阳性细胞数大于或等于75%为+++。
1.4.3 疗效评估 采用改良Mayo评分,该评分系统主要包括4个项目,分别为:排便次数、便血、内镜发现、医师总体评价,每个项目评分为0~3分。临床缓解定义为评分小于或等于2分且无单个分项评分大于1 分;临床有效定义为评分相对于基线值的降幅大于或等于30%及大于或等于3分,而且便血的分项评分降幅大于或等于1分或该分项评分为0或1分。无效定义为治疗后评分相对于基线值的降幅小于30%或小于3分,或便血评分无改善。
1.4.4 质量控制 所有病例收集人员均统一学习和掌握改良Mayo评分系统的评分方法。采用定式问卷、统一指导用语、统一填表方式来了解患者的排便次数、便血情况;内镜下黏膜表现由经验丰富的内镜医师评估;医师总体评价由3名高年资主治医师以上职称的医师共同评价;免疫组织化学所有切片遵循双盲法由2名主治医师以上的病理科医师独立观察,细胞计数时均不显示标本患者的临床病理资料。
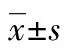
2 结 果
观察组有2例因治疗依从性差退出研究,2例因拒绝2周后复查肠镜退出研究,实际完成21例;对照组有1例因服用柳氮磺吡啶后出现肝功能异常退出研究,2例因拒绝2周后复查肠镜退出研究,实际完成22例。最终共有43例UC患者纳入研究。
2.1 观察组和对照组治疗前与健康组大肠黏膜CX3CR1表达情况的比较 免疫组织化学结果显示:健康组共有3例大肠黏膜阳性表达CX3CR1,阳性率为20.00%(3/15),观察组和对照组共有38例阳性表达CX3CR1,阳性率为88.37%(38/43),见图1。两者比较差异有统计学意义(P<0.01),见表1。

表1 观察组和对照组与健康对照组大肠黏膜CX3CR1表达情况的比较(n)

A:正常大肠组织;B:UC大肠组织CX3CR1不同表达(+);C:UC大肠组织CX3CR1不同表达(++);D:UC大肠组织CX3CR1不同表达(+++)。
图1 正常大肠组织及UC大肠组织中CX3CR1表达水平(SP×400)
表2 观察组与对照组治疗前后大肠黏膜CX3CR1的表达情况
2.2 观察组与对照组治疗前后大肠黏膜CX3CR1的表达情况 免疫组织化学结果显示,治疗前: 21例观察组大肠黏膜组织切片中,-为2例,+为2例,++为7例,+++为10例;22例对照组大肠黏膜组织切片中,-为3例,+为2例,++为8例,+++为9例。治疗后:21例观察组大肠黏膜组织切片中,-为2例,+为10例,++为2例,+++为1例;22例对照组大肠黏膜组织切片中,-为4例,+为9例,++为6例,+++为3例。治疗前两组结果比较差异无统计学意义(Z=-0.469,P>0.05)。观察组治疗前后自身结果比较差异有统计学意义(Z=-3.990,P<0.01);对照组治疗前后自身结果比较差异有统计学意义(Z=-2.160,P<0.05);治疗后两组结果比较差异有统计学意义(Z=-2.291,P<0.05),见表2。
2.3 观察组与对照组患者临床疗效比较 治疗2周后:观察组21例患者中,14例患者获得临床缓解,4例患者临床有效,3例无效,临床缓解率为66.67%,临床总有效率为85.71%,改良Mayo评分由治疗前平均(7.86±1.91)分降为(2.86±2.10)分;对照组22例患者中,7例患者临床缓解,9例患者获得临床有效,6例无效,临床缓解率为31.82%,临床总有效率72.73%,改良Mayo评分由治疗前平均(7.91±1.80)分降为(4.27±2.39)分。改良Mayo评分经t检验,两组患者治疗前评分结果差异无统计学意义(P>0.05),观察组治疗前后评分结果差异有统计学意义(P<0.01),对照组治疗前后评分结果差异有统计学意义(P<0.01),两组患者治疗后评分结果差异有统计学意义(P<0.05),见表3。两组完全缓解率比较经χ2检验,观察组明显优于对照组,差异有统计学意义(χ2=5.222,P<0.05);两组综合疗效经Wilcoxon秩和检验观察组明显优于对照组,差异有统计学意义(P<0.05),见表4。

表3 观察组与对照组治疗前后改良Mayo评分比较
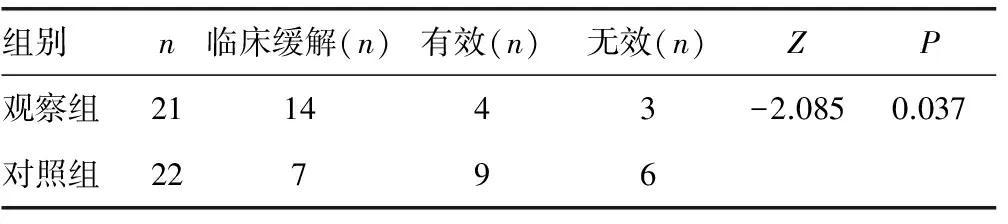
表4 观察组与对照组综合临床疗效比较
3 讨 论
UC是一种原因尚不十分明确的结直肠慢性反复发作的非特异性炎症性疾病,其病因和发病机制尚未完全阐明,缺乏特效治疗方法,轻中度UC传统治疗多以氨基水杨酸制剂治疗为主,部分治疗效果不佳者需加用糖皮质激素、免疫抑制剂等药物治疗,上述药物不良反应较多,停药后容易复发,部分药物治疗效果差者甚至需要全结肠切除治疗,患者非常痛苦,而病程漫长者癌变危险性也增加,因此探索UC新的治疗方案具有重要意义。
参芪扶正注射液由党参和黄芪组成,临床上多用于辅助肿瘤治疗及冠心病、心绞痛、肺心病、心力衰竭等心脏疾病的治疗,在溃疡性结肠炎治疗方面鲜见报道。目前已有较多文献已证实党参和黄芪具有调节肠道菌群、肠道黏膜免疫等作用[1-5]。本研究结果表明,治疗后观察组改良Mayo评分结果明显低于对照组,观察组综合疗效及临床缓解率明显优于对照组,可见“参芪扶正注射液联合SASP”治疗UC近期疗效显著,但参芪扶正注射液治疗UC可能的药物作用机制尚不明确。
目前研究表明,肠黏膜免疫屏障在炎症性肠病发生、发展、转归过程中始终发挥重要作用[13]。2005年Niess等[8]研究发现小肠黏膜固有层树突状细胞(DC)能通过依赖于CX3CR1调节的机制,形成跨上皮细胞的树突,与肠腔中的细菌直接接触,捕获细菌抗原,引起一系列的肠道黏膜免疫反应。2011年,Medina-Contreras等[9]研究发现,CX3CR1在调节葡聚糖硫酸钠(DSS)诱导的小鼠炎症性肠病肠道巨噬细胞动态平衡、细菌易位、致炎效应子Th17应答等方面具有重要作用。2014年,Longman等[14]亦证实,CX3CR1在调节肠道单核吞噬细胞捕获细菌抗原方面具有重要作用。本研究发现:UC患者治疗前与健康组大肠黏膜CX3CR1表达差异有统计学意义(P<0.01),表明CX3CR1高表达于UC患者;治疗后,观察组与对照组大肠黏膜CX3CR1表达差异有统计学意义(P<0.05),表明参芪扶正注射液可能参与了CX3CR1的调控。因此,参芪扶正注射液治疗UC的可能药物机制为通过调控CX3CR1的表达来改善UC患者的肠黏膜免疫屏障。本研究由于时间及条件有限,样本量偏小,今后应在本研究的基础上进一步扩大样本量。另外,由于参芪扶正注射液为静脉类用药,长期应用患者依从性较差,其远期疗效尚不明确,未来是否可通过开发参芪扶正口服制剂来治疗UC有待研究。
[1]成金乐,邓雯,黄萍,等.党参破壁粉粒的抗溃疡作用与急性毒性实验研究[J].西北药学杂志,2011,26(2):120-122.
[2]宋克玉,江振友,严群超,等.党参及茯苓对小鼠肠道菌群调节作用的实验研究[J].中国临床药理学杂志,2011,27(2):142-145.
[3]杨光,李发胜,刘辉,等.党参多糖对小鼠免疫功能的影响[J].中药药理与临床,2005,21(4):39.
[4]赵婷静.黄芪多糖对动物免疫系统影响机理的研究进展[J].青海畜牧兽医杂志,2011,41(1):32-33.
[5]刘远梅,胡月光,孙有成.黄芪对幼兔肠缺血-再灌注肠黏膜屏障的保护作用[J].实用儿科临床杂志,2006,21(23):1617-1618.
[6]ImaiT,HieshimaK,HaskellC,etal.Identificationandmolecularcharacterizationoffractalkinereceptor CX3CR1,which mediates both leukocyte migration and adhesion[J].Cell,1997,91(4):521-530.
[7]Fong AM,Robinson LA,Steeber DA,et al.Fractalkine and CX3CR1 mediate a novel mechanism of leukocyte capture,firm adhesion,and activation under physiologic flow[J].J Exp Med,1998,188(8):1413-1419.
[8]Niess JH,Brand S,Gu X,et al.CX3CR1-mediated dendritic cell access to the intestinal lumen and bacterial clearance[J].Science,2005,307(577):254-258.
[9]Medina-Contreras O,Geem D,Laur O,et al.CX3CR1 regulates intestinal macrophage homeostasis,bacterial translocation,and colitogenic Th17 responses in mice[J].J Clin Invest,2011,121(12):4787-4795.
[10]Thomas S,Baumgart DC.Targeting leukocyte migration and adhesion in Crohn′s disease and ulcerative colitis[J].Inflammopharmacology,2012,20(1):1-18.
[11]中华医学会消化病学分会炎症性肠病协作组.对我国炎症性肠病诊断治疗规范的共识意见[J].中华消化杂志,2007,8(27):545-550.
[12]D′haens G,Sandborn WJ,Feagan BG,et al.A review of activity indices and efficacy end points for clinical trials of medical therapy in adults with ulcerative colitis[J].Gastroenterology,2007,132(2):763-786.
[13]葛均波,徐永健.内科学[M].8版.北京:人民卫生出版社,2013:385.
[14]Longman RS,Diehl GE,Victorio DA,et al.CX3CR1+mononuclear phagocytes support colitis-associated innate lymphoid cell production of IL-22[J].J Exp Med,2014,211(8):1571-1583.
Effect of shenqifuzheng injection on CX3CR1 in colonic mucosa of patients with ulcerative colitis*
ZhaoChangdong1,ZhangXiaojie1△,ZhangLei2,LuoHongbo1,ChenXian1,ZhangHui1,ZhangYifeng1
(1.DepartmentofGastroenterology;2.DepartmentofPathology,theSecondPeople′sHospitalofLianyungangCity,AffiliatedHospitalofBengbuMedicalCollege,Lianyungang,Jiangsu222023,China)
ObjectiveTo observe the clinical efficacy of shenqifuzheng injection combined with sulfasalazine (SASP) in the treatment of ulcerative colitis (UC),and to evaluate the effect of CX3CR1 on colonic mucosa of UC in treatment with shenqifuzheng injection.MethodsFifty-one patients with active mild to moderate UC were collected during the period from January 2012 to June 2014 in the second people′s hospital of Lianyungang,which randomly divided into experimental group and control group,and setting up health group of 15 cases.Experimental group were treated with shenqifuzheng injection combined with SASP,control group were only with SASP,health group were no-treatment control.The modified Mayo scoring results and the expression of CX3CR1 on colonic mucosa of the same lesion site were observed before and two weeks after treatment separately.ResultsThe total positive rate of CX3CR1 on colonic mucosa in patients with ulcerative colitis was 88.37% before treatment,The total positive rate of CX3CR1 on colonic mucosa in health group was 20.00%,There was significant difference between two groups (Z=-2.689,P<0.01).Two weeks after treatment,the expression of CX3CR1 on colonic mucosa and the modified Mayo scoring results in the experimental group were significantly lower than those in the control group (P<0.05).The clinical comprehensive efficacy of the experimental group was significantly better than the control group (Z=-2.085,P<0.05).ConclusionCombination of shenqifuzheng injection and SASP is more effective than using SASP alone in the treatment of UC.Shenqifuzheng injection may play important role in the treatment of UC by inhibiting the expression of CX3CR1 on colonic mucosa.
colitis,ulcerative;intestinal mucosa;shenqifuzheng injection;CX3CR1
10.3969/j.issn.1671-8348.2015.29.022
蚌埠医学院科技发展基金项目(Byky1288NF)。
:赵昌东(1978-),硕士,主治医师,主要从事消化道疾病的诊治。△
,Tel:13812337155;E-mail:lygzxjsyt@163.com。
R259
A
1671-8348(2015)29-4095-03
2015-04-21
2015-05-16)

