毛白杨大、小孢子母细胞减数分裂进程的相关性
张 妍,崔彬彬,魏俊杰,朱维红,张 颖,2
(1 保定学院 生化系,河北 保定 071000;2 北京林业大学 生物科学与技术学院,北京 100083)
毛白杨大、小孢子母细胞减数分裂进程的相关性
张 妍1,崔彬彬1,魏俊杰1,朱维红1,张 颖1,2
(1 保定学院 生化系,河北 保定 071000;2 北京林业大学 生物科学与技术学院,北京 100083)
【目的】 对毛白杨大、小孢子母细胞减数分裂进程的相关性进行研究,为毛白杨多倍体诱导提供细胞学理论基础与技术支持。【方法】 2014-01采集毛白杨雌、雄花枝于温室水培,自水培46 h开始每隔2~3 h取雌、雄花芽样品,采用石蜡切片和醋酸洋红压片技术对毛白杨大、小孢子母细胞减数分裂进程及其对应关系进行观察研究。【结果】 毛白杨小孢子母细胞在水培52 h开始减数分裂,发育到双核花粉粒共历时约10 d;大孢子母细胞在水培118 h开始减数分裂,发育至二核胚囊期共历时约13 d。毛白杨大、小孢子母细胞减数分裂的进程以及与雌、雄花芽外部形态的变化之间均存在一定的相关性,在水培118 h毛白杨大孢子母细胞开始减数分裂进入细线期时,其小孢子母细胞减数分裂至四分体时期,此时雌花序微微露出芽鳞,雄花序1/4以上伸出芽鳞,花药呈块状微红色;在水培144 h大孢子母细胞减数分裂发育到粗线期时,其小孢子母细胞大多已发育至单核期,此时雌花序1/5伸出芽鳞,雄花序1/3以上伸出芽鳞,花药呈块状浅红色;在水培237 h大孢子母细胞减数分裂发育到中期Ⅰ时,其小孢子母细胞已发育至双核期,此时雌花序1/3伸出芽鳞,雄花序1/2以上伸出芽鳞,花药呈块状红色。【结论】 根据大、小孢子母细胞减数分裂进程的时序相关性,通过观察相同培养条件下小孢子母细胞减数分裂的时期,可即时判别大孢子母细胞的减数分裂进程;还可从花芽长度、花药颜色等来估计大、小孢子母细胞减数分裂所处的时期。
毛白杨;大孢子;小孢子;减数分裂
毛白杨(PopulustomentosaCarr.)是我国特有的白杨派树种,具有适应性强、早期速生以及无性繁殖容易等特点,因而可以迅速成林,并在短期内提供木材。而三倍体毛白杨更是具有生长迅速、叶大、抗盐性强等优势。近年来,我国广泛栽培的‘I-214’、‘中林46’、‘沙兰杨’、‘武黑1号’、‘辽河杨’、‘廊坊三号’、‘银中杨’等著名杨树品种相继被证明是三倍体[1-3]。三倍体毛白杨的成功培育,创造了可观的经济、社会和生态效益。因此,人工诱导杨树多倍体育种显得尤为重要。但是,在利用诱导花粉染色体加倍选育白杨三倍体的研究中,由于2n花粉存在竞争力差等问题,造成三倍体得率较低[4]。若诱导雌配子加倍并授以正常花粉即可100%获得三倍体[5]。然而,与诱导小孢子加倍相比,雌配子发育时期不易判别,难以准确把握加倍处理的最佳时期。目前,针对大孢子母细胞的加倍处理主要是通过对大量材料进行处理及筛选,不仅工作量大,三倍体得率也很低,且重复性差,因而限制了2n雌配子诱导及其育种应用[6]。若采用雌、雄配子体发育时期对照的方法可解决雌配子染色体加倍时期不易判别的问题[7-10]。目前针对白杨派树种银腺杨、响叶杨等大、小孢子母细胞减数分裂进程相关性的研究较多,也较为系统[11-12],而毛白杨在此方面的研究尚未见报道。为此,本试验就毛白杨大、小孢子母细胞减数分裂进程及其对应关系进行了研究,以期为毛白杨多倍体诱导提供细胞学理论基础与技术支持。
1 材料与方法
1.1 材 料
2014-01于山东冠县苗圃采集花芽饱满、无病虫害、健壮的毛白杨雌、雄花枝,采集时注意雌、雄株的生活环境及枝条采集部位的一致性,用塑料薄膜包裹花枝运至河北大学温室,避风低温保存备用。
1.2 方 法
将毛白杨雌、雄花枝在温室内进行切枝水培,温度保持在10~25 ℃,并注意培养条件相同;水培46 h后开始进行花芽固定,每隔2~3 h分别采集2个雌、雄花芽并去除底部鳞片,雄花芽用卡诺固定液、雌花芽用FAA固定液进行固定,共历时340 h;于4 ℃条件下低温保存固定好的雌雄花芽。小孢子母细胞减数分裂及雄配子发育的观察采用醋酸洋红压片法,大孢子母细胞减数分裂及雌配子发育的观察采用石蜡切片制片,切片厚度8 μm,苏木精染色。用Olympus BX51型显微镜观察并照相。由于毛白杨大、小孢子母细胞减数分裂过程不同步,因而以大多数分裂相作为该发育阶段的时期。
2 结果与分析
2.1 毛白杨小孢子母细胞减数分裂进程
在温室水培条件下,毛白杨小孢子母细胞由小孢子母细胞发育到双核花粉粒共历时约10 d。具体观察结果如下:
(1)细线期。水培52 h,花序微露,花药淡绿色,花芽长1.3~1.4 cm(图1-A,B);细胞核体积较大,染色体排列杂乱,呈细丝状。此时小孢子母细胞减数分裂进入细线期(图2-A)。
(2)细线末期。水培59 h,毛白杨雄花芽形态基本无变化,花芽长1.4~1.45 cm,小孢子母细胞减数分裂进入细线末期。染色体集中于核仁的一侧,呈花束状(图2-B)。
(3)粗线期。水培67 h,花序约1/6伸出芽鳞,花药顶端微红,花芽长1.45~1.5 cm(图1-C,D)。染色体较之前缩短变粗但仍然较长、形态略显明显但相互重叠缠绕,仍难以区分,同源染色体在此时期进行联会(图2-C)。
(4)双线期。水培81 h,毛白杨小孢子母细胞减数分裂进入双线期,花序1/5伸出芽鳞,花药顶端出现点状红,花芽长约1.5 cm(图1-E,F)。染色体明显缩短变粗,联会的同源染色体之间相互排斥,有交叉现象出现(图2-D,E)。此时小孢子母细胞减数分裂不同步现象变得明显。
(5)终变期。水培86 h,花芽无明显变化。染色体螺旋化程度更深,其形态进一步缩短变粗,核仁变小甚至消失(图2-F)。减数分裂进入终变期。

图1 毛白杨雄花芽及其花药发育进程A,B.花序微露的雄花芽及其花药;C,D.1/6花序露出芽鳞的雄花芽及其花药;E,F.1/5花序露出芽鳞的雄花芽及其花药;G,H.1/4花序露出芽鳞的雄花芽及其花药;I,J.1/3花序露出芽鳞的雄花芽及其花药;K,L.1/2花序露出芽鳞的雄花芽及其花药
(6)中期Ⅰ、后期Ⅰ、末期Ⅰ。水培93 h,略大于1/5的花序伸出芽鳞,花药顶端点状红向下延伸,花芽长度约1.6 cm。此时各分裂相富集,大部分为中期Ⅰ、后期Ⅰ和末期Ⅰ。减数分裂进入中期Ⅰ时,纺锤体形成,成对的染色体整齐排列在赤道板上,核膜、核仁消失(图2-G);减数分裂进入后期Ⅰ时,在纺锤丝的牵引下同源染色体分离并向两极移动(图2-H);进入末期Ⅰ,移向两极的染色体聚集在一起,缠绕成团状呈二分体状态,并且出现多核仁现象(图2-I,J)。
(7)前期Ⅱ、中期Ⅱ、后期Ⅱ、末期Ⅱ。水培105 h,减数分裂进入前期Ⅱ(图2-K);之后出现纺锤体,两组染色体缩短变粗分别整齐排列在赤道板上,即为中期Ⅱ(图2-L);紧接着进入后期Ⅱ,着丝点分裂,姐妹染色单体分离,分别向两极移动(图2-M);染色体到达两极后染色体变为染色质,核仁物质聚集,进入末期Ⅱ(图2-N,O,P)。这一时期的花芽变化不大,花序约1/4伸出芽鳞(图1-G,H)。
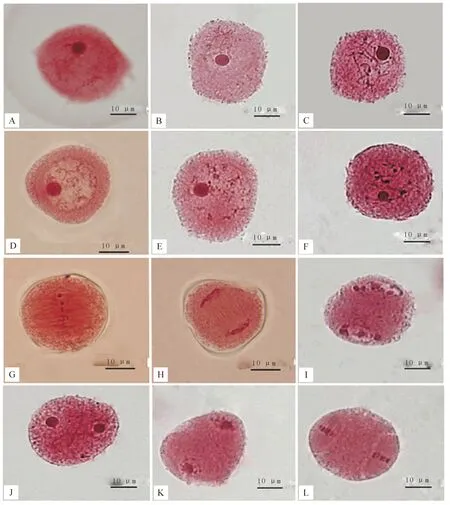
图2 毛白杨小孢子母细胞减数分裂及雄配子发育进程 A.细线期;B.细线末期;C.粗线期;D,E.双线期;F.终变期;G.中期Ⅰ;H.后期Ⅰ;I,J.末期Ⅰ;K.前期Ⅱ;L.中期Ⅱ;M.后期Ⅱ;N-P.末期Ⅱ;Q,R.四分体;S.单核中期;T.单核靠边期;U.双核期
Fig.2 Microspore mother cell meiosis and male gamete development ofPopulustomentosaCarr.A.Leptotene;B.Late leptotene;C.Pachytene;D,E.Diplotene;F.Diakinesis;G.MetaphaseⅠ;H.AnaphaseⅠ;I,J.TelophaseⅠ;K.ProphaseⅡ;L.Metaphase Ⅱ;M.Anaphase Ⅱ;N-P.TelophaseⅡ;Q,R.Tetrad;S.Mononuclear mid;T.Mononuclear aside period;U.Binucleate
(8)四分体时期。水培至118 h时,毛白杨小孢子母细胞减数分裂基本完成,形成四分体(图2-Q,R)。此时花序伸出芽鳞略大于1/4,花药块状微红,花芽长约1.7 cm。
(9)单核早期。水培136 h,胼胝质溶解,由四分体形成4个小孢子,体积较小,细胞质浓厚,核位于中央,为单核早期。花序伸出芽鳞约1/3,花药块状微红,花芽长约1.8 cm(图1-I,J)。
(10)单核中期。水培144 h,花序伸出芽鳞略大于1/3,花药块状浅红,花芽长约1.9 cm。小孢子体积变大,细胞质变稀薄,内形成许多小液泡,形成花粉壁及萌发孔(图2-S)。
(11)单核后期。水培201 h,许多小液泡聚集形成一个中央大液泡,因此核移向细胞的一侧,又称单核靠边期(图2-T)。花序伸出芽鳞1/2,花药块状红,花芽明显伸长,约2.1 cm(图1-K,L)。
(12)双核期。水培237 h,1/2以上花序伸出芽鳞,花药块状红,花芽长约2.3 cm。有丝分裂形成一大一小2个核,即营养核和生殖核,为双核期(图2-U)。
2.2 毛白杨大孢子母细胞减数分裂进程
毛白杨大孢子母细胞水培118 h后才开始进入减数分裂,发育至二核胚囊共历时约13 d。观察结果如下:
(1)细线期。水培118 h,花序微露,染色体明显但排列无序,呈细丝状。此时毛白杨大孢子母细胞减数分裂进入细线期(图3-A)。
(2)细线末期。水培136 h,约1/6花序伸出芽鳞,染色体出现极化,集中于核仁一侧,呈花束状(图3-B),分裂进入细线末期。
(3)粗线期。水培144 h,花序约1/5伸出芽鳞,染色体缩短变粗,但仍较长,同源染色体联会,形态明显(图3-C)。
(4)双线期。水培201 h,花序伸出芽鳞1/4,染色体进一步缩短变粗,同源染色体相互排斥而分离(图3-D)。
(5)中期Ⅰ。水培237 h,花序伸出芽鳞1/3,形成纺锤体,同源染色体对整齐排列在赤道板上,核膜、核仁消失(图3-E)。水培至201 h时,观察到部分大孢子母细胞已经进入中期Ⅰ。
(6)二分体。水培261 h,略多于1/3的花序伸出芽鳞,第一次减数分裂完成,形成纵向排列的二分体(图3-F)。
(7)四分体。水培279 h,花序伸出芽鳞1/2,减数分裂结束,形成直列式四分体(图3-G),即为4个大孢子。
(8)单核胚囊。水培300 h,花序伸出芽鳞2/3,靠近珠孔端的3个大孢子退化,合点端大孢子发育为功能大孢子,即形成单核胚囊(图3-H)。
(9)二核胚囊。水培314 h,多于2/3的花序伸出芽鳞,功能大孢子进行一次有丝分裂,进入二核胚囊期(图3-I)。

图3 毛白杨大孢子母细胞减数分裂进程A.大孢子母细胞;B.细线末期;C.粗线期;D.双线期;E.中期Ⅰ;F.二分体;G.四分体;H.单核期;I.双核期
2.3 毛白杨大、小孢子母细胞减数分裂进程的对应关系
通过观察发现,在水培条件相同的情况下,毛白杨大、小孢子母细胞减数分裂进程存在一定的时序相关性(表1),而且大孢子母细胞减数分裂进程明显滞后。花枝水培52 h,毛白杨小孢子母细胞开始进入减数分裂,花序微露;此时大孢子母细胞还未进入减数分裂。水培至118 h,毛白杨大孢子母细胞减数分裂进入细线期,雌花序微露;此时多于1/4雄花序伸出芽鳞,花药微红,小孢子母细胞进入四分体时期。水培136 h,雌花序1/6伸出芽鳞,大孢子母细胞进入细线末期;而雄花芽1/3花序伸出芽鳞,花药块状微红,雄配子发育至花粉粒单核早期。水培144 h,1/5雌花序伸出芽鳞,减数分裂进入粗线期;此时多于1/3雄花序伸出芽鳞,花药块状浅红,雄配子发育至花粉单核中期。水培201 h,雌花序1/4伸出芽鳞,大孢子母细胞减数分裂大多处于粗线期、双线期和中期Ⅰ;雄花序1/2伸出芽鳞,花药块状红色,雄配子发育到花粉单核靠边期。水培237 h,雌花序1/3伸出芽鳞,大孢子母细胞减数分裂多处于中期Ⅰ;雄配子发育到花粉双核期,多于1/2花序伸出芽鳞,花药呈块状红色。
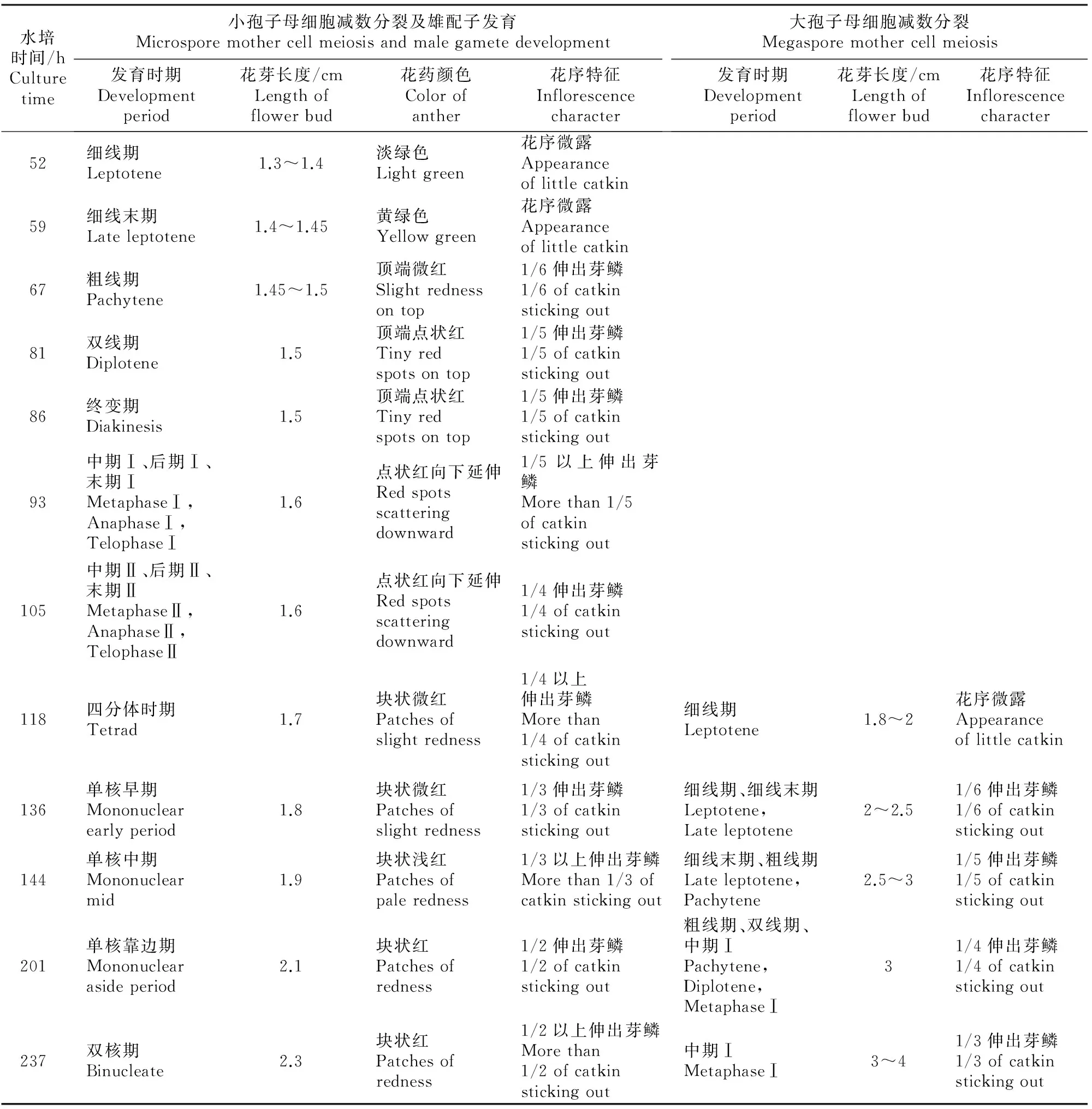
表1 毛白杨大、小孢子母细胞减数分裂进程的对应关系Table 1 Corresponding relationships of the meiosis stages of MMC and PMC of Populus tomentosa Carr.
3 讨论与结论
杨树大、小孢子母细胞减数分裂进程存在一定的相关性,这在响叶杨、银腺杨、毛新杨的研究中已经得到证实[5,11-12],毛白杨大、小孢子母细胞减数分裂进程同样存在一定的相关性。本研究结果表明,大孢子母细胞减数分裂进程明显滞后于小孢子母细胞减数分裂。小孢子母细胞在水培52 h开始减数分裂进入细线期,而大孢子母细胞在水培118 h才开始减数分裂进入细线期,此时小孢子母细胞已经发育至四分体时期;而大孢子母细胞进入中期Ⅰ时,雄配子已发育到了双核期。因此,可以根据毛白杨大、小孢子发育的时序相关性,通过对相同培养条件下小孢子发育进程的观察,对毛白杨大孢子母细胞减数分裂进程进行即时判别。
毛白杨大孢子母细胞减数分裂进程与其花芽的外部形态存在一定的相关性。当毛白杨雌花序微露,花序长1.8~2.5 cm时,大孢子母细胞减数分裂处于细线期和细线末期;而当花序1/3伸出鳞片,长3~4 cm时,大多进入中期Ⅰ。因此,可通过毛白杨雌花芽的外部形态对其减数分裂时期进行判断。
毛白杨大、小孢子母细胞开始减数分裂进入细线期的间隔时间约66 h,在随后的各发育阶段大孢子母细胞用时均长于小孢子母细胞,毛白杨小孢子母细胞发育到双核花粉粒共历时约10 d;大孢子母细胞发育至二核胚囊期历时约13 d。这与包括毛新杨、银腺杨等在内的几个白杨派树种相似,但也存在一定的差异,例如毛新杨大、小孢子母细胞减数分裂进入细线期的间隔时间约61 h,而银腺杨大、小孢子母细胞减数分裂进入细线期的间隔则约需113 h[11];当雄配子发育至双核期时,毛白杨大孢子母细胞减数分裂进入中期Ⅰ,而银腺杨则进入细线末期、粗线期、终变期等时期[11]。不同白杨的大、小孢子母细胞减数分裂进程存在差异,是由于植物种间遗传特性的不同造成的,同时也不排除取样时间、天气状况以及温室条件等因素造成的差异。
大孢子母细胞减数分裂进程的即时判别是利用大孢子染色体加倍选育三倍体技术的关键。相关树种研究表明,可利用雌、雄花芽发育进程的相关性,以雄配子发育进程为参照,来确定大孢子染色体加倍的有效处理时期[11-12]。在实际应用中,由于采样母株的生长地区及生活环境不同、花枝采集时间及花芽发育时期不同、温室培养条件不同等多方面因素的影响,大、小孢子母细胞减数分裂进程可能存在一定的差异。本研究结果表明,毛白杨大、小孢子母细胞减数分裂进程存在相关性,花芽外部形态与其减数分裂进程也存在相关性,可以通过临时压片观察小孢子母细胞减数分裂,来即时判别大孢子母细胞减数分裂时期,同时结合花芽外部形态与其减数分裂进程的相关性进行综合判断,以降低外界因素的影响,可相对准确地确定大孢子染色体加倍的有效时期。此结果不仅在利用大孢子染色体加倍选育三倍体技术中具有实际应用价值,也为毛白杨三倍体等多倍体育种提供了细胞学理论基础。
随着2n雌配子诱导机制的不断提高、授粉后染色体加倍诱导三倍体机理的揭示以及四倍体毛白杨诱导研究的不断深入,将会培育出更加优良的毛白杨树种。
[1] 张守攻,陈成彬,韩素英,等.中国部分杨属植物的染色体数目 [J].植物分类学报,2005,43(6):539-544.
Zhang S G,Chen C B,Han S Y,et al.Chromosome numbers of somePopulustaxa from China [J].Journal of Systematics and Evolution,2005,43(6):539-544.(in Chinese)
[2] 陈成彬,齐力旺,张守攻,等.三倍体杨树核型分析 [J].武汉植物学研究,2004,22(6):565-567.
Chen C B,Qi L W,Zhang S G,et al.The karyptype analysis of triploid poplar [J].Journal of Wuhan Botanical Research,2004,22(6):565-567.(in Chinese)
[3] Zhang S G,Qi L W,Han S Y,et al.A report of triploidPopulusof the section Aigeiros [J].Silvae Genetica,2004,53(2):69-75.
[4] 康向阳,朱之悌.白杨2n花粉生命力测定方法及萌发特征的研究 [J].云南植物研究,1997,19(4):402-406.
Kang X Y,Zhu Z T.A study on the 2n pollen vitality and germinant characteristics of white populars [J].Acta Botanica Yunnanica,1997,19(4):402-406.(in Chinese)
[5] 康向阳.林木多倍体育种研究进展 [J].北京林业大学学报,2003,25(4):70-74.
Kang X Y.Advances in researches on polyploid breeding of forest trees [J].Journal of Beijing Forestry University,2003,25(4):70-74.(in Chinese)
[6] 康向阳,王 君.杨树多倍体诱导技术研究 [M].北京:科学出版社,2010:7-8.
Kang X Y,Wang J.The study on polyploidy induction technology ofPoplar[M].Beijing:Science Press,2010:7-8.(in Chinese)
[7] 鲁 敏,王 君,王旭军,等.响叶杨小孢子母细胞减数分裂及染色体行为的研究 [J].植物科学学报,2011,29(2):171-177.
Lu M,Wang J,Wang X J,et al.Meiosis and chromosome behavior of microsporocytes inPopulusadenopodaMaxim [J].Plant Science Journal,2011,29(2):171-177.(in Chinese)[8] 王 君,康向阳,李代丽,等.通辽杨花粉母细胞减数分裂及其染色体行为研究 [J].西北植物学报,2006,26(11):2231-2238.
Wang J,Kang X Y,Li D L,et al.Meiosis and chromosome behavior of pollen mother cell inPopulussimoniiCarr.×P.nigraL.‘Tongliao’ [J].Acta Botanica Boreali-Occidentalia Sinica,2006,26(11):2231-2238.(in Chinese)
[9] 许重阳,王 君,叶 粟,等.白杨杂种三倍体小孢子母细胞减数分裂及花粉形态观察 [J].西北植物学报,2011,31(12):2454-2458.
Xu C Y,Wang J,Ye S,et al.Meiosis of microsporocyte and variation of pollen in an allotriploid white poplar [J].Acta Botanica Boreali-Occidentalia Sinica,2011,31(12):2454-2458.(in Chinese)
[10] 李 静.山杨三倍体诱导技术研究 [D].哈尔滨:东北林业大学,2014.
Li J.The study on triploid inducing technology ofPopulusdavidianaDode. [D].Harbin:Northeast Forestry University,2014.(in Chinese)
[11] 李艳华,马 洁,康向阳.白杨大孢子母细胞减数分裂进程及其及时判别 [J].北京林业大学学报,2005,27(2):70-74.
Li Y H,Ma J,Kang X Y.Stages of MMC meiosis and its timely discrimination of white poplars [J].Journal of Beijing Forestry University,2005,27(2):70-74.(in Chinese)
[12] 侯延侠,康向阳.响叶杨大、小孢子母细胞减数分裂进程及其对应关系 [J].西北植物学报,2006,21(1):46-49.
Hou Y X,Kang X Y.Meiosis stages and their corresponding relation ofPopulusadenopodamegasporocytes and microsporocytes [J].Acta Botanica Boreali-Occidentalia Sinica,2006,21(1):46-49.(in Chinese)
Correlations between megasporocytes and microsporocytes meiosis stages ofPopulustomentosaCarr.
ZHANG Yan1,CUI Bin-bin1,WEI Jun-jie1,ZHU Wei-hong1,ZHANG Ying1,2
(1DepartmentofBiologyandChemistry,BaodingUniversity,Baoding,Hebei071000,China;2CollegeofBiologicalSciencesandTechnology,BeijingForestryUniversity,Beijing100083,China)
【Objective】 This study investigated the correlations in meiotic process ofPopulustomentosaCarr.megasporocytes and microsporocytes to provide cytological basis and technical support for polyploid hybrid breeding.【Method】 Flowering branches ofP.tomentosaCarr.planted in water in greenhouse were collected and flower buds were picked every two to three hours after being cultured in water for 46 hours.The mother cell meiosis stages and their corresponding relations between megasporocytes and microsporocytes ofP.tomentosaCarr.were studied using paraffin section method and acetic carmine squash technique.【Result】 After being cultured in water for 52 hours,microspore mother cells ofP.tomentosaCarr.started meiosis and it took 10 days for them to develop into binucleate pollen grains.Megaspore mother cells began meiosis after 118 hours and binucleate embryo sacs formed after 13 days.The meiosis stages and flower bud morphologies of megaspores and microspores closely related.After 118 hours in water,the meiosis of megaspore mother cells entered leptotene,while that of microspore mother cells developed into tetrads.Little female catkin and more than 1/4 of male catkin appeared and anthers appeared patches of slight redness.The meiosis of most megaspore mother cells developed into pachytene after 144 hours,and microspores developed into mononuclear.At the same time,1/5 of female catkin and more than 1/3 of male catkin extended and patches of pale redness appeared on anthers.When the meiosis of megasporocytes entered metaphase Ⅰ after 237 hours in water,the microsporocytes developed into binucleate.Meantime,1/3 of female catkin and more than 1/2 of male catkin extended and anthers had red patches.【Conclusion】 According to the relationship of female and male gametes,the meiosis stages of megasporocytes could be discriminated timely through observing the meiosis of microsporocytes under the same culture circumstances.In addition,the meiosis stages ofP.tomentosaCarr.megasporocytes and microsporocytes could be estimated based on flower bud morphology such as the length of the flower buds and the color of anther.
PopulustomentosaCarr.;megasporocyte;microsporocyte;meiosis
时间:2015-10-13 08:46
10.13207/j.cnki.jnwafu.2015.11.010
2015-05-22
河北省自然科学基金资助项目(C2013104053);国家自然科学基金资助项目(31300562);保定学院科研基金资助项目(2010Z02);保定学院科研团队项目(KYTD2013001)
张 妍(1966-),女,河北保定人,讲师,硕士,主要从事植物生理生化与生物技术研究。E-mail:1320450298@qq.com
崔彬彬(1975-),女,河北保定人,副教授,博士,主要从事林木遗传育种与生物技术研究。E-mail:cbb0508@163.com
S792.117
A
1671-9387(2015)11-0063-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151013.0846.020.html

