肝功能衰竭患者营养干预的方法及效果
沈秋月,岑爱萍,李国宏,张颖,冯婕,陈德慧,周卫芹,姚海云,朱丽君
(1.解放军第81医院 全军肝病中心,江苏 南京210002;2.解放军第81医院 护理部;3.东南大学附属中大医院 护理部,江苏 南京210009)
各种病因的慢性肝病患者都存在不同程度的营养不良状态,进展至肝功能衰竭阶段时表现更为明显[1-2]。肝功能衰竭的病变特点是在慢性肝病(慢性肝炎或肝硬化)的病变背景上,出现大块性(全小叶性)或亚大块性新鲜的肝实质坏死[3]。营养不良有可能加重免疫功能低下,能量储备耗竭,不利于肝功能恢复,还会导致肝性脑病、消化道出血、腹水、感染等一些列症状相继发生[4-5]。对于肝功能衰竭患者进行合理、有效的营养支持治疗不仅能改善患者的营养状态,提高生活质量,还能促进肝功能恢复,改善预后。营养支持治疗从20世纪60年代开始起步,已经从单纯的静脉高营养逐步发展到全营养支持。2014年1-8月,本课题组对在解放军第81医院全军肝病中心住院且经主观全面评价法(subjective global assessment,SGA)评估为营养不良的44例肝功能衰竭患者进行营养干预,效果良好,现报道如下。
1 对象与方法
1.1 研究对象 2014年1-8月,解放军第81医院全军肝病中心收治的经SGA评估为营养不良的肝功能衰竭患者44例,其中男34例、女10例,年龄24~71岁,平均(46.8±10.9)岁,平均身体质量指数(body mass index,BMI)(20.4±3.3)。纳入标准:临床诊断为肝功能衰竭,即生化总胆红素(total bilirubin,Tbil)>171μmol/L,凝血酶原活动度(prothrombin time activity,PTa)<40%;营养评估SGA评分≥2分。排除标准:患者失访、患者主动退出研究等。按入院先后将44例患者分为对照组和观察组各22例,两组患者的性别、年龄等一般资料经比较,差异无统计学意义(P>0.05),具有可比性。所有患者对本研究均知情同意,并报院伦理委员会批准。
1.2 方法
1.2.1 对照组 对照组进行常规健康教育,以《肝衰竭诊疗指南》作为参考,肝功能衰竭患者营养支持应以高碳水化合物、低脂、适量蛋白质饮食为主,具体内容如下:根据患者白蛋白(albumin,ALB)、血氨等指标及综合情况调整蛋白质摄入量,血氨较高者限制蛋白质摄入[1.2~1.5g/(kg·d)][6],禁用牛奶、大豆制品,其次是禽类等富含蛋白质的食物;摄入富含支链氨基酸、产氨少的蛋白质,如毛豆、冬笋、西兰花等;伴腹水者根据电解质检查,给予相应的饮食;进食量不足者,每日静脉补给足够的液体和维生素,保证1500kcal/d(1kcal=4.18kJ)以上的总热量。
1.2.2 观察组 观察组患者的饮食除执行以上饮食指导标准外,直接由医院根据患者情况提供食谱,由患者家属准备,护士指导并评估患者的进食情况,进行营养支持干预,以标准公式计算患者每天的能量摄入量,约1500~2000kcal。(1)帮助患者制定食谱,纠正高营养饮食的错误观念,根据患者的饮食习惯选择饮食成份。饮食方式少食多餐,3~5餐/d[7],5餐的进 食 量 比 例 为 20%、10%、30%、30%、10%[5]。加餐选择果蔬汁、酸奶、藕粉、软面包等。(2)糖类供能占60%~65%,脂肪占20%左右,多选用植物油。(3)补充充足的维生素,可将新鲜蔬果榨成果汁,适当补充无机盐和膳食纤维,对盐的摄入应该谨慎,适当摄入藻类食物。(4)重视肠道微生态的调整,必要时补充微生态制剂。(5)静脉输液肠外营养,糖4kcal/g,蛋白4kcal/g,脂肪9kcal/g。(6)膳食营养摄入的计算,记录患者每日每次进食的所有食品名称、重量,由专职营养师帮助完成。
1.2.3 评价指标 观测并比较干预前与干预4周后两组患者的营养生化指标、人体测量营养相关指标、SGA评分及并发症发生情况。(1)生化指标:取患者清晨空腹肘静脉血2ml左右置于促凝管中,测定前白蛋白(pre-albumin,PA)、ALB、三酰甘油(triglyceride,TG)、胆固醇(cholesterol,TC),血标本置37℃水浴30min,采用日立全自动生化分析仪检测,严格按照操作说明进行。(2)人体测量营养相关指标:嘱患者晨起、排空大小便后,直接测量患者体质量和身高,计算BMI;三头肌皮褶厚度(tricepse skine fold,TSF)和 上 臂 围 (mid-arme circumference,MAC)值由专门护士采用中国体育科学研究所研制的皮褶计和软尺,按照《实用营养师手册》推荐的方法测定,即取卧位,患者左侧手臂自然放于身侧,在肱三头肌肌腹部位(左上臂肩峰至桡骨头连线之中心),左手拇指和食指轻轻提起皮肤皱襞,右手用皮脂厚度计进行测量,共测量2次,取平均值。(3)SGA主要内容包括近期体质量变化、膳食变化、胃肠道症状、活动能力及有无应激反应,并测量TSF,观察肌肉消耗程度及有无踝水肿及腹水。综合这些调查资料与人体测量结果进行判断,分为:1=营养良好,2=轻~中度营养不良,3=重度营养不良。(4)并发症;主要观察患者是否出现肝性脑病、肝肾综合征、消化道出血、严重感染等。
1.2.4 质量控制 课题组成员与研究对象建立良好的关系,以取得研究对象的信任与合作;膳食营养素的计算和分析采用膳食营养专家软件系统,所有参与营养评估的护士都接受过相关知识的培训,在调查患者近期营养状况时,所有内容均由患者本人叙述。所有研究对象由专门护士指导,以减少人为因素带来的偏倚;采用统一问卷填写要求进行指导,如对问卷条目提出疑问,采用统一的语言解释;资料输入系统前,再次核对有无遗漏项目并检查有无无效问卷。
1.3 统计学处理 采用SPSS 17.0统计软件,计量资料以±s表示,采用t检验,计数资料采用χ2检验,以P<0.05或P<0.01表示差异有统计学意义。
2 结果
2.1 两组患者干预前后营养生化指标的比较 干预前,两组患者的营养生化指标经比较,差异均无统计学意义(均P>0.05);干预后,除ALB外,观察组患者的营养生化指标均优于对照组(均P<0.05);干预后,观察组患者的营养生化指标(除TC外)均优于干预前(均P<0.05),对照组患者的营养生化指标与干预前比较,差异均无统计学意义(均P>0.05),见表1。
表1 两组患者干预前后营养生化指标的比较(±s)
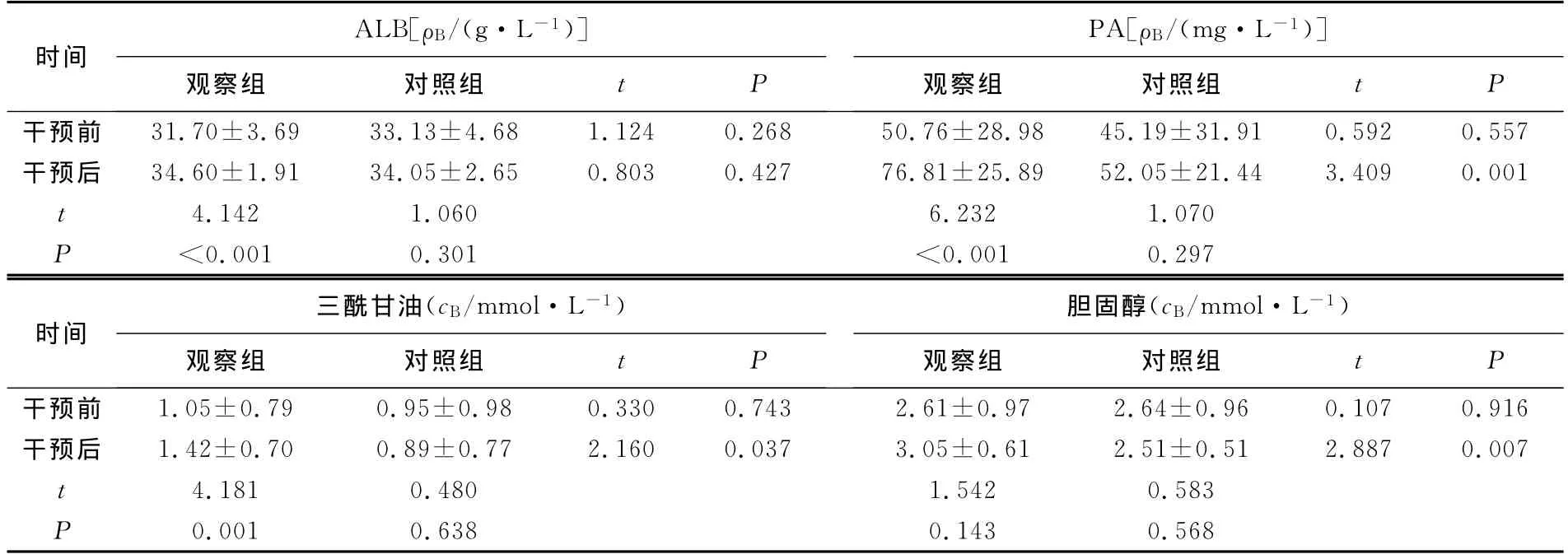
表1 两组患者干预前后营养生化指标的比较(±s)
images/BZ_218_295_977_2182_1110.png干预前 31.70±3.69 33.13±4.68 1.124 0.268 50.76±28.98 45.19±31.91 0.592 0.557干预后 34.60±1.91 34.05±2.65 0.803 0.427 76.81±25.89 52.05±21.44 3.409 0.001 t 4.142 1.060 6.232 1.070 P<0.001 0.301 <images/BZ_218_295_1309_2182_1446.png0.001 0.297干预前 1.05±0.79 0.95±0.98 0.330 0.743 2.61±0.97 2.64±0.96 0.107 0.916干预后 1.42±0.70 0.89±0.77 2.160 0.037 3.05±0.61 2.51±0.51 2.887 0.007 t 4.181 0.480 1.542 0.583 P 0.001 0.638 0.143 0.568
2.2 两组患者干预前后人体测量指标的比较 干预前,两组患者的人体测量指标经比较,差异均无统计学意义(均P>0.05);干预后,观察组患者的BMI优于对照组(P<0.05);干预后,观察组患者的BMI及MAC均优于干预前(均P<0.05),对照组患者的人体测量指标与干预前比较,差异均无统计学意义(均P>0.05),见表2。
表2 两组患者干预前后人体测量指标的比较(±s)
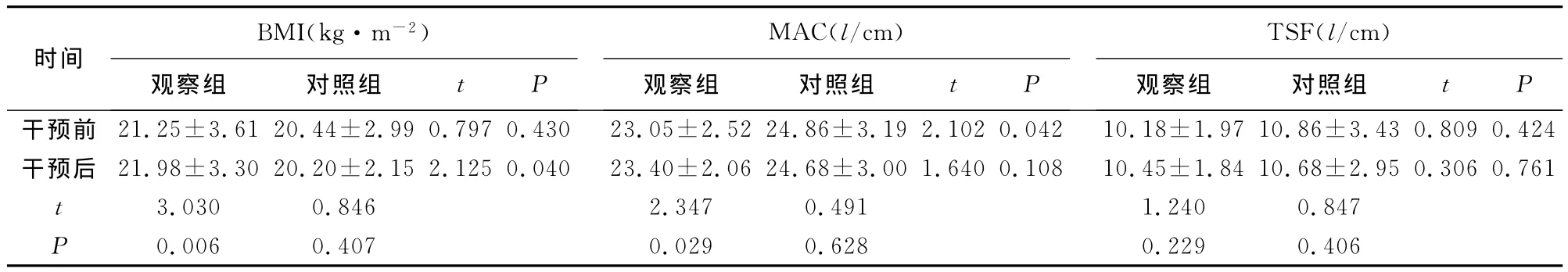
表2 两组患者干预前后人体测量指标的比较(±s)
images/BZ_218_245_2092_2233_2224.png干预前 21.25±3.61 20.44±2.99 0.797 0.430 23.05±2.52 24.86±3.19 2.102 0.042 10.18±1.97 10.86±3.43 0.809 0.424干预后 21.98±3.30 20.20±2.15 2.125 0.040 23.40±2.06 24.68±3.00 1.640 0.108 10.45±1.84 10.68±2.95 0.306 0.761 t 3.030 0.846 2.347 0.491 1.240 0.847 P 0.006 0.407 0.029 0.628 0.229 0.406
2.3 两组患者干预前后SGA评分及并发症发生情况的比较 干预前,两组患者的SGA评分经比较,差异无统计学意义(P>0.05);干预后,两组患者的SGA评分均优于干预前(均P<0.05),观察组患者的SGA评分优于对照组(P<0.05)。干预后,观察组患者并发症的发生率低于对照组,差异有统计学意义(P<0.05)。见表3。
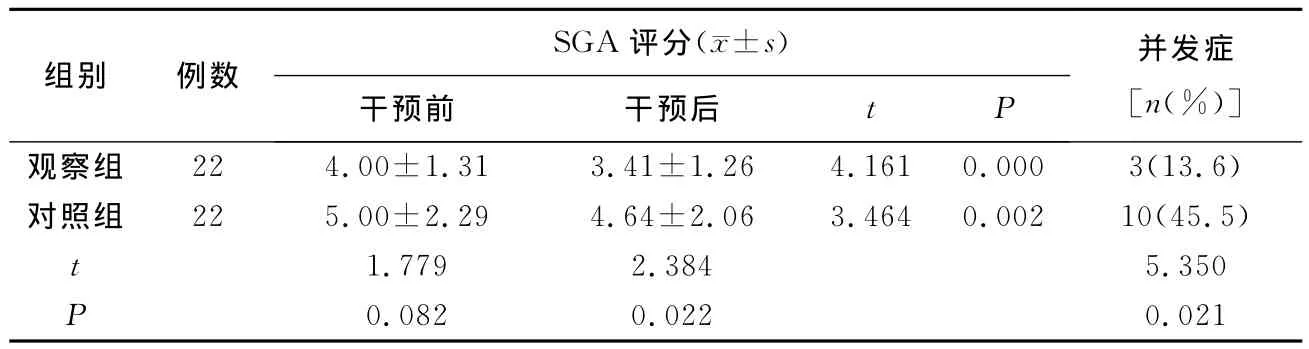
表3 两组患者干预前后SGA评分及并发症发生情况的比较
3 讨论
3.1 肝功能衰竭患者营养不良的发生机制 肝脏是消化系统的一部分,也是营养物质代谢的重要场所和枢纽,参与了所有营养物质代谢。肝功能受到损害必然会影响患者的营养状态,而营养不良又能影响肝细胞的再生和其他器官组织功能[8]。肝功能衰竭患者营养不良的原因有:(1)食物摄入减少,具体原因包括患者腹水压迫、食欲下降等导致胃扩张能力不足、为避免肝性脑病而低蛋白饮食等引起的医源性蛋白与热量损失等;(2)高代谢状态,有研究[9]表明,肝功能衰竭患者静息状态下能量消耗超过预期的20%,原因与细胞因子异常驱动的代谢增高有关;(3)营养物质吸收减少,由于胃肠道血液淤滞、肠道蠕动能力减退、肠肝循环受损等原因,肠道的吸收功能明显减退,营养素吸收也就受到影响;(4)营养物质丢失增多,消化道出血、腹水、感染可导致大量蛋白丢失;(5)合成不足,肝脏合成蛋白能力下降,导致低白蛋白血症,并影响某些激素和微量元素的生成,从多方面影响机体内环境[10]。
3.2 肝功能衰竭患者的营养状况 营养和代谢损害是终末期肝病患者的一个主要并发症[7]。多数情况下,营养不良虽然不是肝脏功能衰竭的原发病因,但其可以为加重肝功能衰竭的创造条件[11]。目前,临床治疗措施主要是综合支持治疗及防治并发症、稳定病情,在整体治疗的同时积极改善食品的品质及提供合理的膳食,以增加营养素补充,使患者度过危重阶段。除此之外,患者的营养状况也被越来越受到重视[12]。应指导患者重视自身的营养状况,同时加强临床护士对患者进行个性化的健康教育,指导患者调整饮食结构和习惯,少量多餐,进食中等热量、适当蛋白、高维生素的易消化饮食,血氨正常、无肝性脑病征兆患者,蛋白质的来源应以优质蛋白为主,如鱼肉和豆类蛋白等,理论上应考虑此类患者蛋白质分解增多的问题,给予补充较多的食物蛋白[13]。血氨较高者限制蛋白质的摄入[1.2~1.5g/(kg·d-1)],禁食高蛋白质的食物。摄入富含支链氨基酸、产氨少的蛋白质。如果出现严重的消化道不适症状而影响食物的摄人时,应适当给予肠内、肠外营养补充,只要患者病情允许,应首选肠内营养。因为肠内营养更符合生理状况,能维持肠道结构和功能的完整,费用低,使用和监护简便,并发症较少[14]。
3.3 营养干预对肝功能衰竭患者营养不良的影响 营养干预在肝功能衰竭的治疗中占有重要地位,其不仅能够减少营养不良的发生,而且还能促进肝细胞的修复再生。刘国旺等[15]报道,慢性肝功能衰竭患者在入院或诊断时能量摄入已明显下降,已存在能量供给不足。有研究[16]认为,应该在给予肝病患者临床综合治疗的同时辅助合理营养干预,营养干预应该成为肝病综合治疗中不可或缺的部分。本研究为改善患者的肝功能、营养状态和预后,对患者进行营养风险的评估,采用SGA的方法,对存在营养不良的患者实施营养支持,采用多种方法提高优质蛋白的比例,供给富含支链氨基酸的食物,严格控制非优质蛋白质的食物,达到量少质优的效果;同时采用低脂饮食,严格控制总脂肪摄入量和饱和酸的比例。结果显示,观察组的营养指标均好于对照组,并发症少于对照组。在人体测量指标方面,体质量是最容易受到影响而改变,因此在干预4周以后,BMI表现出了改善。TSF反映机体肌肉、蛋白储备情况,代谢过程较长,干预前后的差异无统计学意义(P>0.05)。因此对肝功能衰竭患者进行营养干预有其必要性,同时营养干预可对临床预后产生影响,改善患者营养状态,减少并发症的发生,改善患者预后。
4 小结
综上所述,营养风险评估结果对患者采取营养干预是十分必要的,其不仅能够有效改善患者的肝功能和营养学指标,而且有利于减少并发症的发生。总之,全营养支持是目前临床营养治疗的主流。对于肝功能衰竭患者,应针对不同病因和不同病程制定个体化的营养治疗方案,既能保证最佳的营养支持疗效,又能减轻肝脏负担,改善肝功能衰竭患者的预后。早期对肝功能衰竭患者进行营养干预,不但有利于延长患者生命,提高其生活质量,减少并发症的发生,还有利于促进患者肝脏移植手术的顺利进行[17]。
[1]朱鸣,徐列明.肝硬化患者常用的营养风险评价方法与比较[J].临床肝胆病杂志,2013,29(5):327-328.
[2]段钟平.肝病营养问题再关注[J].实用肝脏病杂志,2014,17(5):449-450.
[3]中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊疗指南(2012年版)[J].中华肝脏病杂志,2013,21(3):177-183.
[4]Liu P,Zhang Z F,Cai J J,et al.NRS2002assesses nutritional status of leukemia patients undergoing hematopoietic stem cell transplantation[J].Chin J Cancer Res,2012,24(4):299-303.
[5]郭会敏,周莉,马文晨,等.北京地区住院肝病患者营养风险的状况[J].中华肝脏病杂志,2013,21(10):734-738.
[6]Cordoba J,Lopez-Hellin J,Planas M,et al.Normal protein diet for episodic hepatic encephalopathy results of a randomized study[J].J Hepatol,2004,41(1):38-43.
[7]Kondrop J,Muller M J.Energy and protein requirements of patients with chronic liver disease[J].J Hepatol,1997,27(1):239-247.
[8]Odena,G,Miquel M,Serafin,A,et al.Rifaximin,but not growth factor 1,reduces brain edema in cirrhotic rats[J].World J Gastroenterol,2012,18(17):2084-2091.
[9]Tsiaousi E T,Hatzitolios A I,Trygonis S K,et al.Malnutrition in end stage liver disease:Recommendations and nutritional support [J].J Gastroenterol Hepatol,2008,23(4):527-533.
[10]陈玉琪,汤勃,王宇明.终末期肝病患者营养风险调查与危险因素分析[J].肝脏,2014,19(4):235-237.
[11]汪茂荣.《国际肝性脑病和氮质代谢共识》解读:肝硬化患者肝性脑病的营养管理[J].实用肝脏病杂志,2013,16(4):303-305.
[12]李杰.合理膳食对慢加急性肝衰竭并发症的发生临床研究[J].中国实用医药,2013,8(23):214-215.
[13]梁亚平.终末期肝病的营养支持及护理干预[J].中国实用医药,2014,9(21):227-228.
[14]时淑云,韩军军,闫茗,等.慢性肝病患者的营养风险评估[J].中华肝脏病杂志,2014,22(7):435-439.
[15]刘国旺,唐克诚,李谦,等.慢性肝衰竭治疗中的营养评价[J].临床肝胆病杂志,2012,28(4):305-307.
[16]孔筠,彭珊,韩璐,等.急性肝衰竭患儿肠内营养干预研究[J].武警医学,2013,24(9):761-763.
[17]李雪梅,孟庆华.肝硬化患者营养不良与营养支持[J].肠外与肠内营养,2006,13(5):312-315.

