鄂西红豆离体培养及植株再生研究
何碧珠,郜祥雄,彭东辉,王荣文
(1 福建农林大学 a 园艺学院,b 艺术与园林学院,福建 福州 350002;2 南靖县奎洋镇农技站,福建 漳州 363605)
鄂西红豆离体培养及植株再生研究
何碧珠1a,郜祥雄1a,彭东辉1b,王荣文2
(1 福建农林大学 a 园艺学院,b 艺术与园林学院,福建 福州 350002;2 南靖县奎洋镇农技站,福建 漳州 363605)
【目的】 对外植体采用特殊处理方法,并对不同培养时期的基本培养基进行调整,以建立高效、快速、繁殖系数高的鄂西红豆再生技术体系。【方法】 以成熟度为80%的鄂西红豆种子为外植体,通过向培养基中添加不同质量浓度和配比的植物生长调节物质,筛选适宜的芽诱导培养基、继代增殖培养基、壮苗培养基和生根培养基,并对诱导生根培养的试管苗进行炼苗移栽,观察其成活率。【结果】 最适芽诱导培养基为MS+6-BA 0.5 mg/L+KT 0.5 mg/L+NAA 0.5 mg/L+维生素B10.1 mg/L+蔗糖30 g/L+琼脂6.5 g/L+活性炭1.5 g/L,诱导率达85%;最适芽继代增殖培养基为WPM+6-BA 1.5 mg/L+KT 0.3 mg/L+TDZ 0.02 mg/L+NAA 0.5 mg/L+蔗糖30 g/L+琼脂6.5 g/L+活性炭1.5 g/L;无根苗壮苗培养基为WPM+NAA 0.5 mg/L+IBA 1.0 mg/L+IAA 1.0 mg/L+蔗糖30 g/L+琼脂6.5 g/L+活性炭1.5 g/L。当无根苗生长到4~5 cm时形成完整植株并转接到生根培养基上诱导生根,最适生根培养基为1/2WPM+IBA 0.5 mg/L+NAA 1.5 mg/L+新型基因诱导生根剂0.05 mg/L+蔗糖30 g/L+琼脂6.5 g/L+活性炭1.5 g/L。【结论】 建立的鄂西红豆再生技术体系可获得75%~85%的正常萌芽,生根率达85%以上,瓶苗移栽成活率达90%。
鄂西红豆;组织培养;高效繁殖;高效再生
鄂西红豆(OrmosiahosieiHemsl & Wils)别名花榈木、黑樟、乌樟丝、番红木,属于蝶形花科(Papilionaceae)红豆树属,是我国特有乡土种,国家二级珍稀濒危植物[1]。红豆树木材是目前中国红木家具的主要木材原料,集珍贵用材、药用材、景观利用、森林文化于一体,具有极高的经济价值和开发利用前景。
国际市场上红豆树木材被视为木中珍品,其材质优良,坚实耐腐,收缩性小,纹理美观,可与桃花心木(Swieteniamahagoni)媲美,因此天然林资源遭到了大量砍伐,加之红豆树种群小,种子传播扩散能力和自然再生能力差,造成现有天然资源大量减少,分布范围日益缩小,成龄树日益稀少,目前主要以风水林保留于村口和寺庙旁[2-4]。另一方面,由于鄂西红豆树结实年龄晚,且有大小年之分,一般在树龄35年左右才开花结实,结果盛期在50年以后,而且通常需间隔3~5年才开花结果。因此,急需发展红豆树人工造林,扩大种群规模。
有关红豆树离体芽诱导并大量繁殖的研究尚未见报道,仅见范辉华等[5]用红豆树根蘖苗促萌形成的枝条为外植体进行组织培养诱导成苗,从外植体取材方式和不同浓度激素组合方面进行研究,但未形成大量完整植株。本研究通过对红豆树外植体灭菌途径和材料处理方法的筛选、基本培养基的适时调整、植物生长调节物质的选择等,拟建立高效、快速、高繁殖系数的鄂西红豆再生技术体系,以获得大量完整的再生植株,培育出大量微体诱导繁殖的优质鄂西红豆树种苗,为鄂西红豆树的产业化生产提供技术支持。
1 材料与方法
1.1 材 料
在福建省古田县平湖沿河岸边选择优良的野生鄂西红豆作为母树,取当年结实、籽粒饱满、无病虫害、成熟度约80%的荚果,用湿沙布包裹荚果后带回实验室,置4 ℃冰箱中保存备用。
1.2 外植体的处理
用洗衣粉漂洗荚果表面后置流水下滴洗0.5~1 h,双蒸水冲洗2~3遍,在超净工作台上用体积分数75%酒精消毒30 s后,再加入1 g/L升汞(HgCl2)处理13~15 min,用无菌水冲3~4遍,并用消毒滤纸吸干材料表面水分,将荚果放在灭菌培养皿上,用镊子取出并选择均匀饱满的种子,使用适当机械力(用枪状镊夹住种子并用手术刀切下)去除坚硬种子外壳生长点部位的1/3,接入芽诱导培养基中,每瓶接2粒种子,接种后先暗培养8 d,萌发后移至温度为(23±2) ℃的培养室中培养,光照强度1 000~1 500 lx,光照时间12 h/d。
1.3 初代芽诱导
1.3.1 基本培养基对鄂西红豆种子离体培养的影响 将处理好的种子分别接种于MS、1/2MS和WPM等基本培养基中[6-10],每升附加蔗糖30 g,琼脂粉6.5 g,pH值5.8,在 (23±2) ℃下暗培养8 d,萌发后再于光照强度1 000 lx、光照时间12 h/d条件下培养,测试不同基本培养基对种子离体培养的影响。每种培养基接10瓶,重复3次,每瓶接入2粒种子,培养40 d时测算诱导率(诱导率=(每组萌发种子粒数/每组接种种子粒数)×100%),从中筛选最适宜种子离体生长的基本培养基。
1.3.2 植物生长调节物质对种子离体培养的影响 种子培养初期以MS为基本培养基,每升附加维生素B10.1 mg,蔗糖30 g,琼脂粉6.5 g,活性炭1.5 g,pH值5.8,然后将不同质量浓度的6-BA、TDZ、NAA和KT进行组合(详见表1)后加入,共计10个处理,每处理10瓶,重复3次,每瓶接入2粒种子,在 (23±2) ℃下培养,测试不同种类和质量浓度的植物生长调节物质对种子培养的影响。培养40 d时测算诱导率。
1.4 继代芽增殖
当种子抽出茎叶并长出胚根时,可观察到下胚轴处分化出不定芽的现象,将已分化芽的下胚轴切下(在下胚轴切口处又会分化出新的不定芽),并切取茎段,将其转入增殖培养基中进行增殖培养,以WPM为基本培养基,每升附加不同组合的植物生长调节剂(表2),另加入蔗糖30 g、琼脂粉 6.5 g、活性炭1.5 g,pH值5.8,于 (23±2) ℃下培养,光照强度1 500 lx,每日光照12 h。试验共7个处理,每处理接种10瓶,重复3次,每瓶接入3个茎段,每组接种90个茎段,培养40 d时统计各处理的诱导芽数并测定芽苗长度,从中筛选最适宜的增殖培养基。
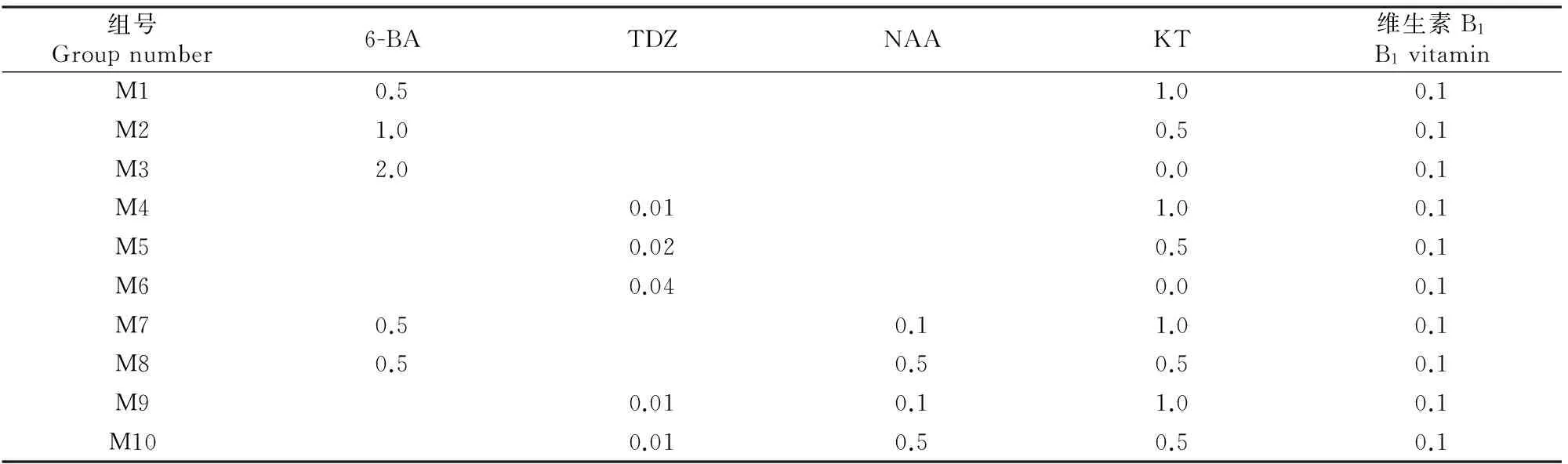
表1 鄂西红豆种子离体培养时基本培养基中的不同植物生长调节剂组合Table 1 Different combinations of plant growth regulators in basic culturing mediumin vitro with Ormosia hosiei Hemsl & Wils seeds mg/L
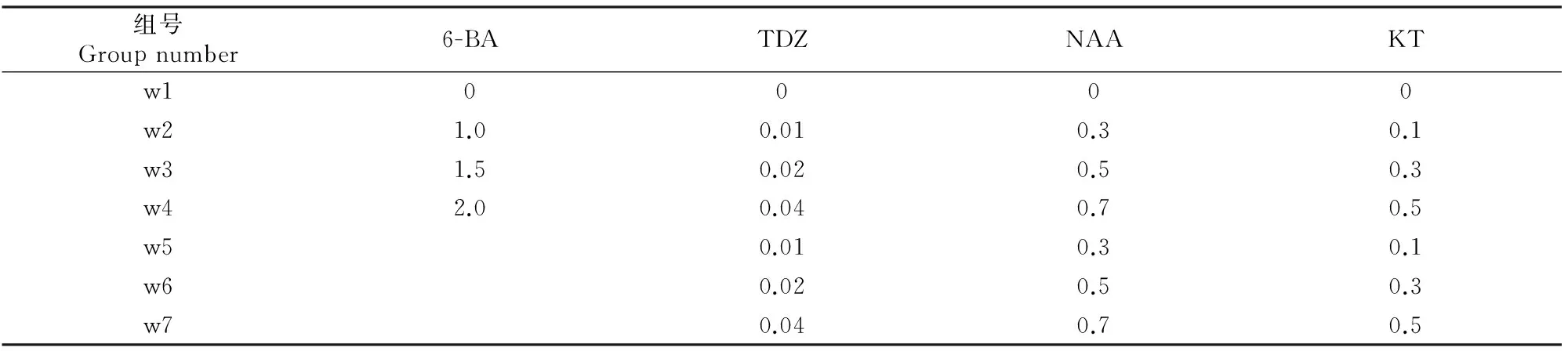
表2 鄂西红豆种子离体培养时的继代芽增殖诱导培养基配方Table 2 Medium formulations for shoot induction in vitro with Ormosia hosiei Hemsl & Wils seeds mg/L
1.5 壮苗培养
当培养芽苗长至2~3 cm且茎上长出若干小叶时,用手术刀从芽丛上切下单株无根小苗并接到壮苗培养基上进行壮苗培养(木本植物经壮苗培养有利于生根诱导以及移栽后成活率和苗木成品率的提高)。以WPM为基本培养基,每升附加不同质量浓度NAA、IBA和IAA组合及蔗糖30 g、琼脂粉6.5 g、活性炭1.5 g,pH值5.8,在 (23±2) ℃下培养,光照强度1 500 lx,每日光照12 h。培养50 d时测定新生茎的茎粗和长度。
1.6 生根培养
当经壮苗培养的苗长到3~4 cm时,将其转接到生根培养基进行生根培养。以1/2 WPM为生根基本培养基,每升加入蔗糖30 g、琼脂粉6.5 g、活性炭1.5 g,并附加不同质量浓度的IBA和NAA,同时每组培养基中每升加入0.01~0.05 mg的新型基因诱导生根剂,pH值调至5.8,温度 (23±2) ℃,光照强度 1 500 lx,每日光照培养12 h。试验共9个处理,每处理接种10瓶,重复3次,每瓶接入2个植株,每组接种60个植株,培养30 d时统计生根率、平均生根数和最长根长,筛选最适宜的生根培养基。生根率=(每组生根组培苗数/每组接种组培苗数)×100%;平均生根数=每组组培苗生的根数/每组接种组培苗数。
2 结果与分析
2.1 鄂西红豆种子离体培养时初代芽诱导培养基的选择
2.1.1 不同基本培养基对种子离体培养的影响 由表3和图1可知,将处理好的种子培养40 d后,WPM培养基中的种胚长出淡绿的叶,茎段较细长,根较短无侧根;随无机盐质量浓度的降低,在1/2MS培养基中,芽长逐渐变短,茎变得细弱,叶色也逐渐开始发黄;MS培养基中,离体种胚茎段变得较长、较粗,叶色也变得深绿,并长出叶子。综上认为,鄂西红豆种胚诱导适宜的基本培养基为MS培养基。

表3 不同基本培养基对鄂西红豆离体种胚培养的影响Table 3 Effect of basic medium on Ormosia hosiei Hemsl & Wils embryo cultured in vitro

图1 鄂西红豆离体种胚在3种基本培养基中的生长情况
2.1.2 不同植物生长调节物质对离体种胚培养的影响 由表4可知,以MS为基本培养基,将鄂西红豆种子接种于含有不同质量浓度6-BA的培养基(M1-M3)中,40 d后的调查结果显示,随着6-BA质量浓度的递增,种子抽出茎叶的长度递降,胚根长度变短甚至不萌发。在6-BA质量浓度为0.5 mg/L 时,胚轴有少数突起的芽;当质量浓度增加至1.0 mg/L时,诱导繁殖芽数量增加;但当6-BA质量浓度增高到2.0 mg/L时,突起变少且不能分化为芽,并逐渐褐化。将鄂西红豆种子接种于含有不同质量浓度TDZ的培养基(M4-M6)中,在TDZ质量浓度较高时,茎叶不抽出,甚至形成愈伤组织;在TDZ质量浓度为0.01 mg/L时,即低质量浓度TDZ有利于诱导繁殖丛生芽。与6-BA相比,低质量浓度的TDZ更利于不定芽的分化,但对茎叶和胚根生长的抑制较为明显,而且随TDZ质量浓度的升高,其对胚根发育的抑制增强;当其质量浓度提高至0.04 mg/L时,种子无生长且褐化。

表4 不同植物生长调节物质对鄂西红豆离体种胚培养的影响Table 4 Effect of different plant growth regulators on Ormosia hosiei Hemsl & Wils embryo cultured in vitro
由表4还可以看出,在低质量浓度的6-BA或TDZ中加入一定质量浓度的NAA,更有利于茎叶的抽出与生长,且NAA质量浓度为0.5 mg/L的效果比0.1 mg/L更好。表4中6-BA 0.5 mg/L+NAA 0.5 mg/L组合(M8)对鄂西红豆离体种胚的培养效果最好,茎叶抽出最高,叶色深绿,胚轴处有3~4个不定芽长出,胚根长。另外,随着KT质量浓度的增加,其对胚轴伸长的促进作用增强。
综上可知,最有利于种子培养的培养基为MS+6-BA 0.5 mg/L+KT 0.5 mg/L+NAA 0.5 mg/L+维生素B10.1 mg/L+蔗糖30 g/L+琼脂6.5 g/L+活性炭1.5 g/L。
2.2 鄂西红豆种子离体培养时继代芽增殖培养基的选择
由表5可知,不同质量浓度的激素配比对鄂西红豆种子离体培养时继代芽的增殖具有不同的效果。将抽出茎叶并长出胚根的种子接种在增殖培养基中进行培养,40 d后观察发现,在不加任何激素的WPM基本培养基(w1)中,接种的材料不能增殖,伸长极慢甚至不伸长,最终老化而死亡。当培养基中附加6-BA 为1.0和1.5 mg/L(w2和w3)时,丛生芽的增殖随6-BA质量浓度的增加而增多,且丛生有效芽苗变多;当6-BA质量浓度为2.0 mg/L(w4)时,丛生芽密集,但不伸长,有效苗少,不利于下一步的增殖和生根培养。当培养基中附加TDZ 0.01~0.04 mg/L(w5-w7)时,芽丛的增殖随TDZ质量浓度的增加而增多,但有效芽苗变少;当TDZ质量浓度为0.04 mg/L(w7)时,芽丛密集但不伸长,有效苗少,有的变成愈伤组织,不利于后续的增殖、壮苗和生根培养。另据观察,芽生长速度随着NAA和KT质量浓度的增加而增快。表5结果表明,培养基以WPM+6-BA 1.5 mg/L+KT 0.3 mg/L+TDZ 0.02 mg/L+NAA 0.5 mg/L+蔗糖30 g/L+琼脂6.5 g/L+活性炭1.5 g/L对芽的增殖与伸长效果最好,平均诱导芽数达3.0个,芽苗平均长3.9 cm,且生长旺盛健壮,利于生根成苗及移栽成活。图2为鄂西红豆种子离体培养40 d后继代芽在增殖培养基中的生长情况。
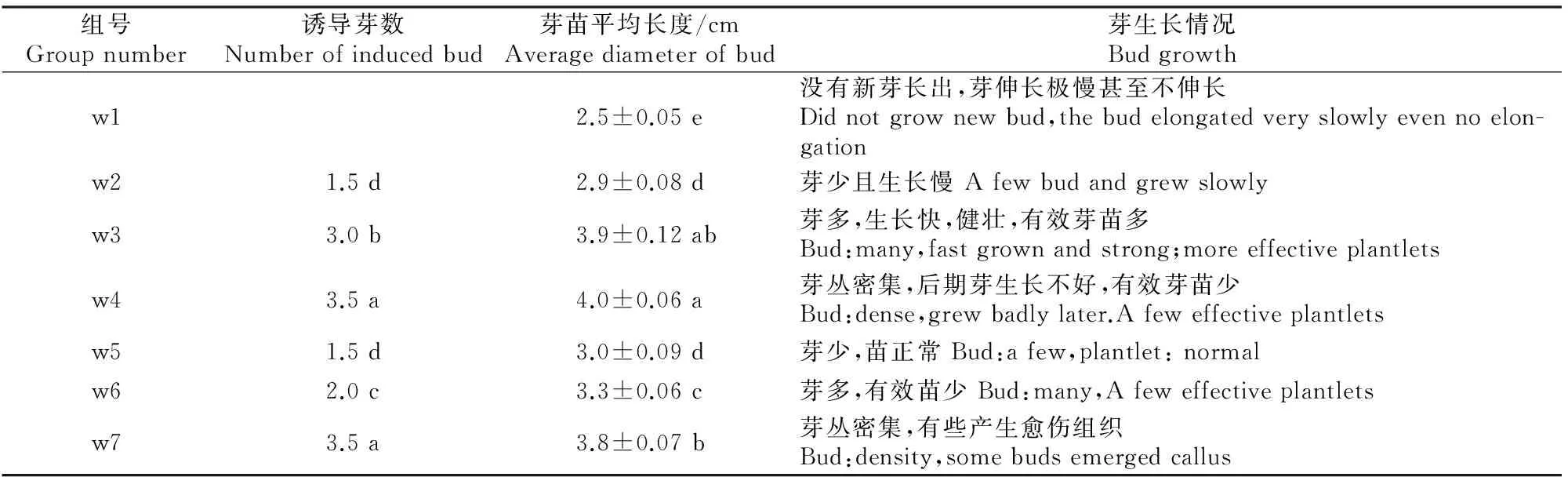
表5 不同配方培养基对鄂西红豆种子离体培养时继代芽增殖的影响Table 5 Effect of different medium on buds induction of Ormosia hosiei Hemsl & Wils seeds cultured in vitro
注:同列数据后标不同小写字母者表示差异显著(P<0.05),下表同。
Note:Different lowercase letters indicate significant difference (P<0.05).The same below.

图2 鄂西红豆种子离体培养时继代芽在增殖培养基中的生长情况(40 d)
2.3 鄂西红豆种子离体培养时壮苗培养基的选择
将继代芽经增殖培养得到的芽丛用手术刀切下带愈伤组织的单株无根小苗并接到壮苗培养基上培养,发现7 d内就可以长出新芽和新叶,且苗生长也更快;由表6可看出,培养50 d后新生茎平均长度为3.35 cm,茎粗3.91 mm。
将继代芽经增殖培养得到的芽丛接入不同质量浓度激素配比的壮苗培养基中培养50 d,结果发现在只加入一种生长激素NAA或IBA的培养基中,鄂西红豆苗生长慢,植株瘦弱,叶片少且颜色偏黄。同时加入NAA和IBA明显有利于植株的生长,且随着IBA质量浓度的增加促生效果更好。当同时加入NAA、IBA和IAA时,其对新生茎的伸长效果更显著,新生茎平均长度超过4.0 cm,在NAA 0.5 mg/L+IBA 1.0 mg/L+IAA 1.0 mg/L的组合中,植株长势最好,新生茎长度为4.29 cm,茎粗5.12 mm,枝叶多,叶色深绿。表6结果表明,WPM+NAA 0.5 mg/L+IBA 1.0 mg/L+IAA 1.0 mg/L+蔗糖30 g/L+琼脂6.5 g/L+活性炭1.5 g/L为适宜的壮苗培养基,瓶苗生长旺盛、健壮,利于生根成苗。图3为鄂西红豆种子离体培养时单株小苗转接入壮苗培养基的生长情况。
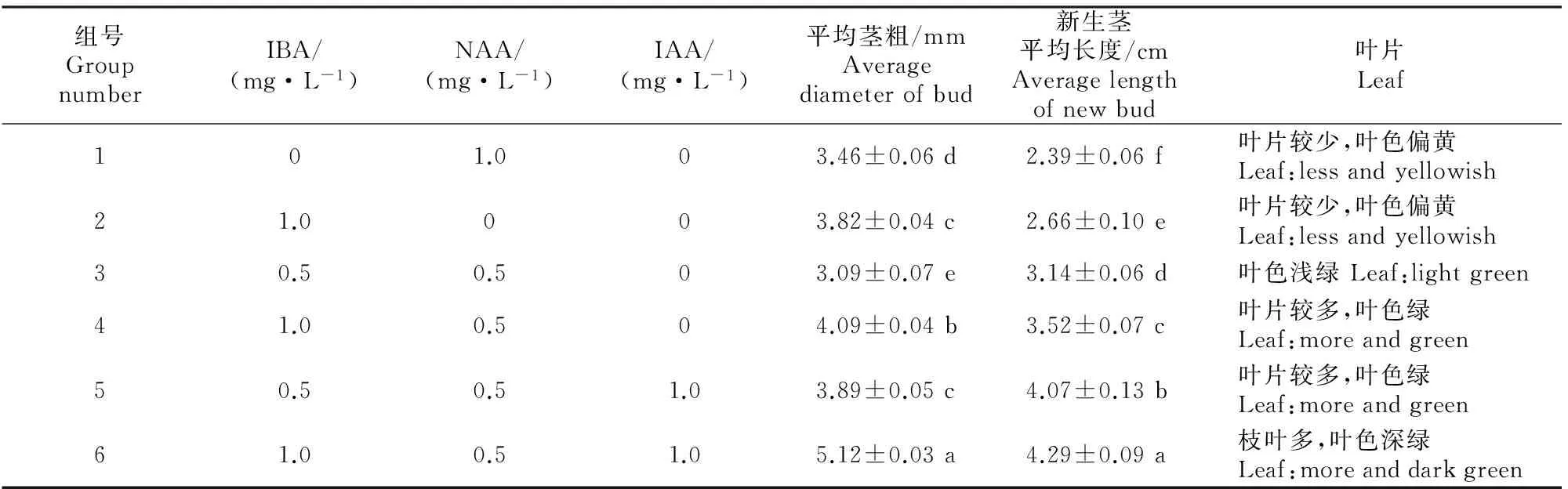
表6 不同配方培养基对鄂西红豆种子离体培养时壮苗培养的影响(50 d)Table 6 Effect of different medium on strong plantlet of Ormosia hosiei Hemsl & Wils seeds cultured in vitro after 50 d

图3 鄂西红豆种子离体培养时单株小苗转接入壮苗培养基的生长情况
2.4 鄂西红豆种子离体培养时生根培养基的选择
由表7可以看出,在1/2WPM培养基中加入不同的植物生长激素,培养30 d后,就生根率、生根数、最长根长而言,IBA比NAA更有利于鄂西红豆生根,且嫩枝基部不形成愈伤组织。生根率随着IBA质量浓度(从0.5 mg/L到1.5 mg/L)的增加而增大,而嫩枝除了生根外,高度几乎没有增加。加入低质量浓度的NAA(0.5 mg/L)对生根无效,且会长出愈伤组织,随着NAA质量浓度的增加,生根率提高,嫩枝生长势比加入IBA的组别高。

表7 不同配方培养基对鄂西红豆种子离体培养过程中嫩枝生根的影响Table 7 Effect of different medium on rooting of Ormosia hosiei Hemsl & Wils seeds cultured in vitro
由表7还可以看出,新型基因诱导生根剂的质量浓度对鄂西红豆生根有显著影响,随着新型基因诱导生根剂质量浓度的增加,生根率、生根数均增加。此外,同时加入IBA和NAA,生根率也有显著提高,且嫩枝明显长高,其中1/2WPM+IBA 0.5 mg/L+NAA 1.5 mg/L+新型基因诱导生根剂 0.05 mg/L效果最好,培养30 d后观察到平均生根率为86.0%,每个嫩枝平均长4.16条根,最长根长为6.15 cm。虽然1/2WPM+IBA 1.0 mg/L+NAA 1.0 mg/L的培养基也表现出较高的生根率,但根质量不好,有些会发黑,不能移植。图4反映了不同植物生长激素对鄂西红豆组培苗生根的影响。

图4 不同植物生长激素对鄂西红豆组培苗生根的影响
Fig.4 Effect of different plant growth regulators on rooting of tissue cultured plantlets ofOrmosiahosieiHemsl & Wils
2.5 鄂西红豆组培苗的炼苗移栽
诱导生根培养出的试管苗生长至5~6 cm高时,一般可长出3~5条根,3~6片叶,叶长2~3 cm。将试管苗先移至自然光下炼苗4~5 d,再打开瓶盖炼苗1~2 d;然后取出植株,洗去附着在根系上的培养基,将小苗移栽到配好的基质中,基质成分为泥炭土、黄土、细砂、珍珠岩,体积比为50∶30∶10∶5。移栽容器为8 cm口径的塑料小盆,每盆种植1株,共种植100株。移栽瓶苗先在温室里培养2~3周,温度控制在(25±2) ℃,相对湿度75%~85%。然后转到遮去50%光照的条件下培养4周,最后移栽于室外苗圃,但应避免在阳光直射环境下培养,1个月后调查成活率可以达到90%以上,获得了鄂西红豆健壮、完整的植株(图5)。

表8 鄂西红豆组培苗的移栽成活率及生长情况Table 8 Survival rate and growth of tissue cultured plantlets of Ormosia hosiei Hemsl & Wils after transplanting

图5 移栽成活的鄂西红豆组培苗
3 讨论与结论
3.1 讨 论
采用鄂西红豆种胚进行鄂西红豆的组织培养主要包括4个环节,即成熟度80%种胚的诱导、继代芽的增殖、单株无根苗的壮苗培养以及生根诱导。通过反复试验,本研究成功建立了一套鄂西红豆离体再生和高效繁殖技术体系,并成功运用三维立体空间(此专利已授权)进行产业化、规模化生产,为鄂西红豆的大面积种植提供了技术支持,但同时也应注意以下几个方面的问题:
3.1.1 基本培养基的选择 臧新等[11]用MS和B5等培养基对南方红豆杉的离体胚进行培养,发现不同培养基对胚的诱导影响差别不大。而本研究发现,不同基本培养基对鄂西红豆离体种胚培养影响较大。MS培养基能促进根系产生和茎叶生长,是鄂西红豆离体种胚培养最适宜的基本培养基。MS培养基对南方红豆杉茎段生长亦较佳,但茎瘦弱且不利其根系的生长。1/2MS培养基不适于鄂西红豆的种胚培养,可能是鄂西红豆茎伸长生长需要高质量浓度的无机盐离子,根生长则以低质量浓度无机盐离子为宜,而茎叶和根的平衡生长则需要大量元素的协调配比。
3.1.2 外植体的选择 从野生鄂西红豆优良母树上选取当年结实、成熟度为80%且籽粒饱满的种子为材料。接种时发现有些种子的种胚已萌动,有些未萌动。萌动后的鄂西红豆种子具有较强的生长势和生理活性,而且此时内源激素含量高于其他时期;而未萌动的种子中发芽抑制物的含量较高[12-13],会抑制种子的萌发生长。试验中观察发现,萌动后成熟度为80%的种胚更容易诱导出芽,这可能与鄂西红豆种胚内源激素随种胚成熟度而发生变化有关,而常规木本植物种子育苗时需要经过一定时间的沙藏处理才能发芽,而且出芽参差不齐。
3.1.3 增殖培养中的问题 在增殖培养中存在一个矛盾:若要提高增殖倍数,常需增加植物生长调节物质的用量,但得到的芽苗往往比较细弱;而若要让苗长得完整、强壮,则增殖倍数就会相对降低。本研究结果表明:芽的增殖随6-BA质量浓度的增加而增加,且丛生芽生长旺盛,有效芽苗多;当6-BA质量浓度大于1.5 mg/L时,丛生芽密集,但不伸长,有的变成愈伤组织,有效苗少。因此以WPM+6-BA 1.5 mg/L+KT 0.3 mg/L+TDZ 0.02 mg/L+NAA 0.5 mg/L培养基对芽的增殖与伸长效果最好,平均诱导芽数达3.0个,芽苗平均长达3.9 cm,且生长旺盛健壮,利于扩繁及生根成苗。这与黄烈健等[14]对马占相思优树的研究结果相似。
3.1.4 生根过程中的问题 在诱导生根过程中,发现在芽的继代增殖环节中,如果长时间未进行继代,培养基体积变小,有些芽可直接生根,说明在诱导生长过程中合理适时调整培养基配比有利于木本植物的生根。但为了避免继代芽直接生根而导致试管苗生根过程缓慢,在继代培养环节中,间隔1个半月应更换继代培养基。上述培养基对红豆树生根的影响可能是生根培养基中加入的生根剂所致,陆孝建[15]的研究中也有同样的问题,有待进一步研究。
3.2 结 论
本研究以野生优良鄂西红豆母树成熟度80%的种子为外植体,建立了鄂西红豆种胚植株再生及繁殖技术体系。初代芽诱导培养基为MS+6-BA 0.5 mg/L+KT 0.5 mg/L+NAA 0.5 mg/L+维生素B10.1 mg/L+蔗糖30 g/L+琼脂6.5 g/L+活性炭1.5 g/L;继代芽增殖培养基为WPM+6-BA 1.5 mg/L+KT 0.3 mg/L+TDZ 0.02 mg/L+NAA 0.5 mg/L+蔗糖30 g/L+琼脂6.5 g/L+活性炭1.5 g/L;壮苗培养基为WPM+NAA 0.5 mg/L+IBA 1.0 mg/L+IAA 1.0 mg/L+蔗糖30 g/L+琼脂6.5 g/L+活性炭1.5 g/L,生根培养基为1/2WPM + IBA 0.5 mg/L+NAA 1.5 mg/L+新型基因诱导生根剂0.05 mg/L+蔗糖30 g/L+琼脂6.5 g/L+活性炭1.5 g/L。
研究结果表明:采用鄂西红豆成熟度80%的种子进行种胚组织培养并繁育生产用苗,在技术上完整、可靠,通过该技术建立的再生体系可获得75%~85%的正常萌芽,且继代增殖效果良好,经壮苗和生根培养生根率达85%以上,瓶苗移栽成活率可达90%以上。
[1] 国务院.国家重点保护野生植物名录(第一批) [J].植物杂志,1999 (5):4-11.
The Sate Council.Key wild plants under state protection(The first batch) [J].Journal of Plant,1999 (5):4-11.(in Chinese)
[2] 郑天汉,汤文彪,陈清根,等.鄂西红豆树开花结实规律及种子发芽试验 [J].林业科技开发,2006,20(6):38-41.
Zheng T H,Tang W B,Chen Q G,et al.Prelmiinary research on characteristics of florescence and seed germination ofOrmosiahosieiHemsl & Wils [J].China Forestry Science and Technology,2006,20(6):38-41.(in Chinese)
[3] 倪 江,刘祥明.珍贵树种红豆树人工栽培丰产技术 [J].中国林副特产,2004 (4):23.
Ni J,Liu X M.Artificial high-yielding cultivation techniques inOrmosiahosieiwhich is valuable species [J].Quarterly of Forest By-product and Speciality in China,2004 (4):23.(in Chinese)
[4] 陈存及,陈伙法.阔叶树种栽培 [M].北京:中国林业出版社,2000.
Chen C J,Chen H F.The cultivate of broad-leafed trees [M].Beijing:China Forestry Publishing House,2000.(in Chinese)
[5] 范辉华,李朝晖,张 蕊,等.红豆树的组织培养技术 [J].福建林业科技,2011,38(3):101-102.
Fan H H,Li C H,Zhang R,et al.Ormosiahosieitissue culture technique [J].Journal of Fujian Forestry Science and Technology,2011,38(3):101-102.(in Chinese)
[6] 张 蕊,范辉华,李朝晖.红豆树组织培养方法:中国,201210144494.1 [P].2012-09-12.
Zhang R,Fan H H,Li C H.Ormosiahosieitissue culture method:China,201210144494.1 [P].2012-09-12.(in Chinese)
[7] 杨 波,李洪林,张建霞,等.花榈木快速繁殖的方法:中国,200510018970.5 [P].2008-01-09.
Yang B,Li H L,Zhang J X,et al.The method of rapid propagation inOrmosiahenryiPrain:China,200510018970.5 [P].2008-01-09.(in Chinese)
[8] 姚 军,李洪林,杨 波,等.花榈木的组织培养和快速繁殖 [J].植物生理学通讯,2007,43(1):123-124.
Yao J,Li H L, Yang B,et al.Tissue culture and rapid propagation ofOrmosiahenryiPrain [J].Plant Physiology Communications,2007,43(1):123-124.(in Chinese)
[9] 高 丽,李洪林,杨 波.花榈木胚轴愈伤组织的诱导及植株再生 [J].安徽农业科学,2009(33):16271-16273.
Gao L,Li H L,Yang B.Callus induction and plant regeneration from the hypocotyl ofOrmosiahenryiPrain [J].Journal of Anhui Agricultural Sciences,2009(33):16271-16273.(in Chinese)
[10] 高 丽,杨 波,李洪林,等.花榈木组培苗茎段低温胁迫培养及耐冷性诱导 [J].亚热带植物科学,2009,38(2):19-21,25.
Gao L,Yang B,Li H L,et al.Stems culture under low temperature stress and chilling tolerance induction ofOrmosiahenryiseedlings culturedinvitro[J].Subtropical Plant Science,2009,38(2):19-21,25.(in Chinese)
[11] 臧 新,吕晓辉,杨冬之,等.2种红豆杉的离体胚培养 [J].郑州大学学报:理学版,2006,38(2):107-109.
Zang X,Lü X H,Yang D Z,et al.The embryo cultureinvitroof twoTaxusspecies [J].Journal of Zhengzhou University:Natural Science Edition ,2006,38(2):107-109.(in Chinese)
[12] 张艳杰,高捍东,鲁顺保.南方红豆杉种子中发芽抑制物的研究 [J].南京林业大学学报:自然科学版,2007,31(4):52-56.
Zhang Y J,Gao H D,Lu S B.Germination inhibitors in methanol extract fromTaxuschinensisvarmaireiseed [J].Journal of Nanjing Forestry University:Natural Sciences Edition,2007,31(4):52-56.(in Chinese)
[13] 史锋厚,沈永宝,施季森.南京椴种子发芽抑制物研究 [J].福建林学院学报,2007,27(3):222-225.
Shi F H,Shen Y B,Shi J S.Study on germination inhibitor of Nanjing Linden seeds [J].Journal of Fujian College of Forestry,2007,27(3):222-225.(in Chinese)
[14] 黄烈健,陈相旭,张赛群.马占相思优树组培快繁技术研究 [J].林业科学研究,2012,25(2):227-230.
Huang L J,Chen X X,Zhang S Q.Tissue culture technique ofAcaciamangiumElite trees [J].Forest Research,2012,25(2):227-230.(in Chinese)
[15] 陆孝建.红豆树扦插育苗试验研究 [J].现代农业科技,2012 (15):126-127.
Lu X J.Cuttage seedling experiment ofOrmosiahosieiHemsl & Wils [J].Modern Agricultural Sciences and Technology,2012(15):126-127.(in Chinese)
Tissue culturing and plantlet regeneration ofOrmosiahosieiHemsl & Wils
HE Bi-zhu1a,GAO Xiang-xiong1a,PENG Dong-hui1b,WANG Rong-wen2
(1 aCollegeofHorticulture,bCollegeofLandscapeArchitecture,FujianAgricultureandForestryUniversity,Fuzhou,Fujian350002,China;2AgrotechnicalStation,KuiyangTown,NanjingCounty,Zhangzhou,Fujian363605,China)
【Objective】 An efficient,fast and high propagation coefficient sterile culturing system forOrmosiahosieiHemsl & Wils was established by treating explant with special methods and adjusting basic culture medium at different culturing periods.【Method】 UsingO.hosieiHemsl & Wils seeds with 80% maturity as explants,plant growth regulating substances with different concentrations and combinations were added in the medium to screen appropriate medium for bud induction,subculture multiplication,strong plantlet and rooting.The plantlets were also hardened and transplanted to get the survival rate.【Result】 The optimum medium for bud induction was MS+6-BA 0.5 mg/L+KT 0.5 mg/L+NAA 0.5 mg/L+B1Vitamin 0.1 mg/L+Sugar 30 g/L+Agar 6.5 g/L+Activated Carbon 1.5 g/L and the obtained induction rate of embryo was 85%;the optimum medium for bud subculture multiplication was WPM+6-BA 1.5 mg/L+KT 0.3 mg/L+TDZ 0.02 mg/L+NAA 0.5 mg/L+Sugar 30 g/L+Agar 6.5 g/L+Activated Carbon 1.5 g/L;and the optimum medium for strong plantlet was WPM+NAA 0.5 mg/L+IBA 1.0 mg/L+IAA 1.0 mg/L+Sugar 30 g/L+Agar 6.5 g/L+Activated Carbon 1.5 g/L.A complete plant was formed when the bud grew up to 4-5 cm and it was then transferred to the rooting medium,with the optimum medium of 1/2 WPM+IBA 0.5 mg/L+NAA 1.5 mg/L+ABT powder 0.05 mg/L+Sugar 30 g/L+Agar 6.5 g/L+Activated Carbon 1.5 g/L.【Conclusion】 The established sterile culturing system forO.hosieiHemsl & Wils obtained normal budding rate,rooting rate and plantlets transplanting survival rate of 75%-85%,>85% and 90%,respectively.
OrmosiahosieiHemsl & Wils;tissue culture;efficient propagation;efficient regeneration
时间:2015-11-11 16:16DOI:10.13207/j.cnki.jnwafu.2015.12.009
2014-04-10
国家林业局林业公益行业科研专项(201204604);中央财政林业科技推广示范项目(闽[2015]TG18)
何碧珠(1960-),女,福建福州人,高级实验师,主要从事园艺植物生物技术及遗传资源研究。 E-mail:954196684@qq.com
S722.3+7
A
1671-9387(2015)12-0049-09
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151111.1616.018.html

