2013年夏季北黄海浮游植物群集
张 健,李佳芮,翟伟康,潘 嵩,王园君
(国家海洋信息中心,天津 300171)
2013年夏季北黄海浮游植物群集
张 健,李佳芮,翟伟康,潘 嵩,王园君
(国家海洋信息中心,天津 300171)
利用Utermöhl方法,对2013年夏季取得的北黄海浮游植物样品进行鉴定分析,共鉴定出浮游植物3门60属114种(不包括未定名种),其中,硅藻42属75种,甲藻16属37种,金藻2属2种。群落组成以硅藻为主,其次是甲藻,然后是金藻。调查海区浮游植物的生态类型以温带近岸性为主,主要优势种为:小等刺硅鞭藻Dictyochafibula、裸甲藻Gymnodiniumsp.、螺旋环沟藻Gyrodiniumspirale、蜂腰双壁藻Diploneisbombus和具槽帕拉藻Paraliasulcata。浮游植物细胞丰度介于0.037 0 × 103~ 32.3 × 103cells·L-1,平均值为2.04 × 103cells·L-1;浮游植物细胞丰度大致从近岸到外海呈逐步降低趋势,在北黄海西部近岸的表层水体达到最高值32.3 × 103cells·L-1,调查区东南部靠近外海区域也出现了丰度高值区;浮游植物垂直分布总体特征是随水深的增加而减少,由近岸向外海逐步降低。香农-威纳多样性指数在调查区西南部较高,而Pielou均匀度指数则在东部呈现高值区域。典范对应分析(CCA)显示,影响浮游植物优势种丰度分布的主要因素是营养盐,而跟盐度和温度的相关性不明显。
浮游植物;群落结构;北黄海;夏季
0 引言
浮游植物作为海洋生态系统的初级生产者,在物质循环和能量流动中起着至关重要的作用,同时某些物种还可以作为海流、水团的指示种或赤潮的肇事种,浮游植物群落结构的变化也成为海洋环境变化的重要指标,通过对海洋环境信息的反馈,对了解和掌握海洋生物资源状况、变动规律和补充机制有着极为重要的意义[1]。此外浮游植物群落可以对海洋的生态环境造成影响,浮游植物在改变碳通量、云反照率、海水光通量和热通量上发挥着至关重要的作用[2]。此前对中国黄海海域浮游植物的研究大多采用拖网采样分析[3-5],这种方法容易遗漏小粒径的浮游植物,并且不能获得其在水体中垂直分布的信息。本文采用Utermöhl[6]分析方法分析了北黄海海域2013年8月的浮游植物群落分布特点,同时运用统计学方法——典范对应分析(Canonical Correspondence Analysis,CCA)对调查区的浮游植物数据和环境因子间的关系进行了相关性分析,以期为黄海的生态系统结构与功能研究提供基础资料。
1 材料与方法
1.1 站位设置及采样方法
2013年7月29日至2013年8月7日,在北黄海中部(34.0°~36.5°N,120.0°~124.5°E)进行海上调查。共设置45个采样站位(图1),参照《海洋调查规范》中标准层的采样原则[7]:水深小于60 m的站位,取表层、中层和底层3层;水深大于60 m的站位,取表层、次表层、中层和底层4层。采集浮游植物水样250 mL,倒入聚乙烯样品瓶中,立即用中性福尔马林固定(最终体积分数为1%~2%),共取得水样211个。
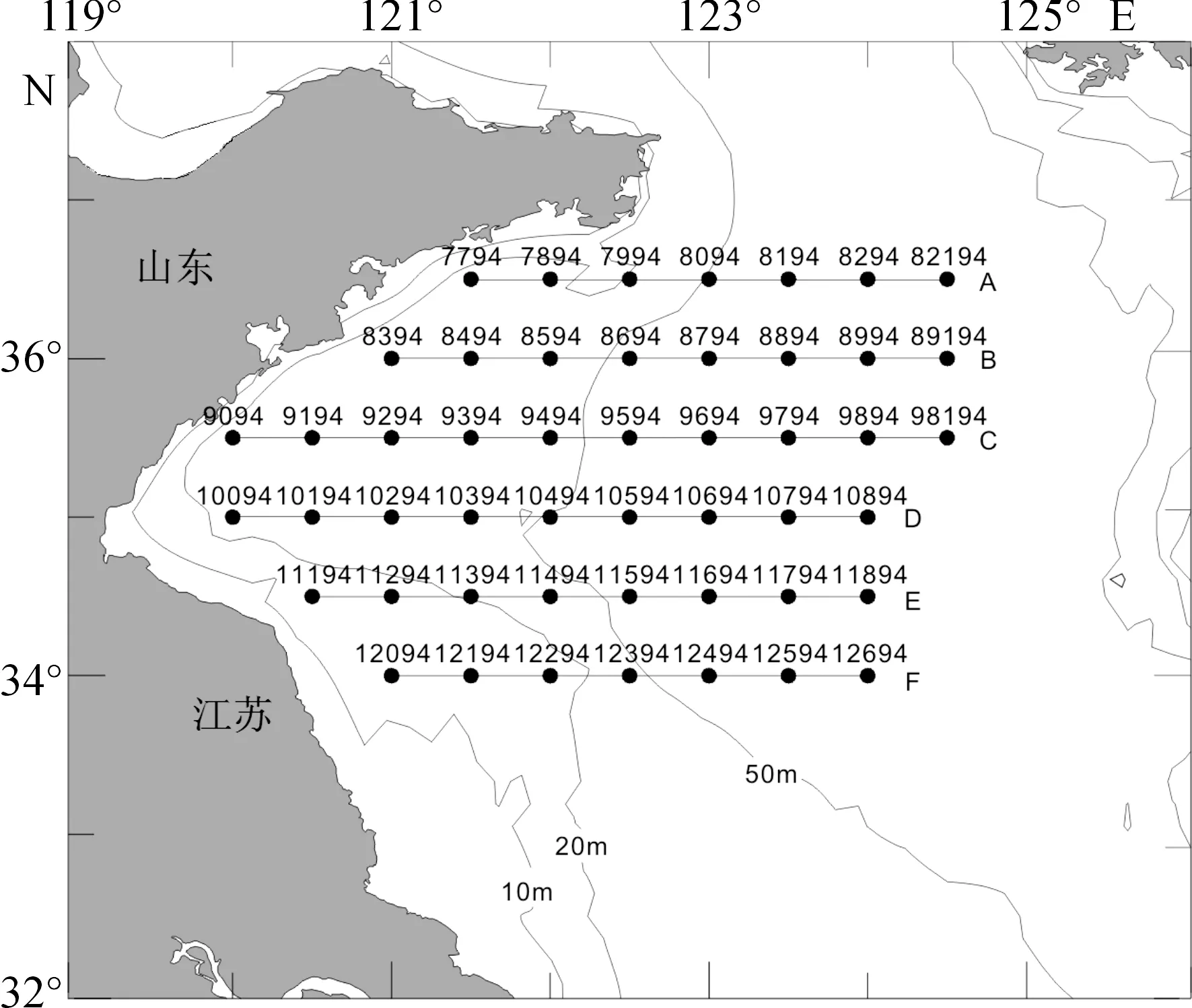
图1 调查海区和站位Fig.1 Study area and sampling stations
1.2 样品分析方法
样品在实验室进行浮游植物物种鉴定和细胞丰度分析。采用国际通用的Utermöhl方法对样品进行分析。取27 mL浮游植物样品于Hydro-bios的Utermöhl计数框,沉降24 h,用AO倒置显微镜在200或400倍下进行浮游植物物种鉴定与计数,细胞丰度的统计和误差处理参考文献[6]。
营养盐样品(硝酸盐NO3-N、亚硝酸盐NO2-N、氨氮NH4-N、磷酸盐SRP和硅酸盐DSi)经采集后立即进行过滤,滤膜采用预先经HCL处理过的醋酸纤维滤膜。NH4-N的测定采用722-分光光度计;NO3-N、NO2-N和SRP的测定采用德国“Bran+Luebbe”公司生产的AA3营养盐自动分析仪;DSi的测定采用Tri-223三同步营养盐自动分析仪。
1.3 浮游植物群落结构分析
浮游植物群落分析采用香农-威纳(Shannon-Wiener)物种多样性指数[8]、Pielou均匀度指数[9]和优势度指数[10]。
香农-威纳指数(H′)计算公式为:
物种均匀度指数(J)计算公式为:
优势度(Y)计算公式为:
式中:N为采集样品中所有物种的总个体数;S为样品中的物种总数;ni为第i种的总个体数;Pi=ni/N,为第i种在样品中的细胞丰度概率;fi为该种在各样品中出现的频率。
浮游植物与环境因子的典范对应分析(Canonical Correspondence Analysis,CCA)运用MVSP 3.1进行,得出主要优势种丰度与环境因子的双序图(biplot)。
2 结果与讨论
2.1 浮游植物物种组成
本次调查共发现浮游植物3门60属114种(不包括未定名种),其中硅藻门42属75种,占所有物种的65.8%;甲藻门16属37种,占所有物种的32.5%;金藻门2属2种,占所有物种的1.7%。
浮游植物以温带近岸种为主,占比例较大的物种为:小等刺硅鞭藻Dictyochafibula、裸甲藻Gymnodiniumsp.、螺旋环沟藻Gyrodiniumspirale、蜂腰双壁藻Diploneisbombus和具槽帕拉藻Paraliasulcata等。
各优势种出现频率和优势度见表1,此外,骨条藻Skeletonemaspp. 也作为常见种出现在山东半岛南岸以及近岸海域,而圆筛藻Coscinodiscusspp. 和海链藻Thalassiosiraspp. 在调查区的大部分海域几乎都有分布。
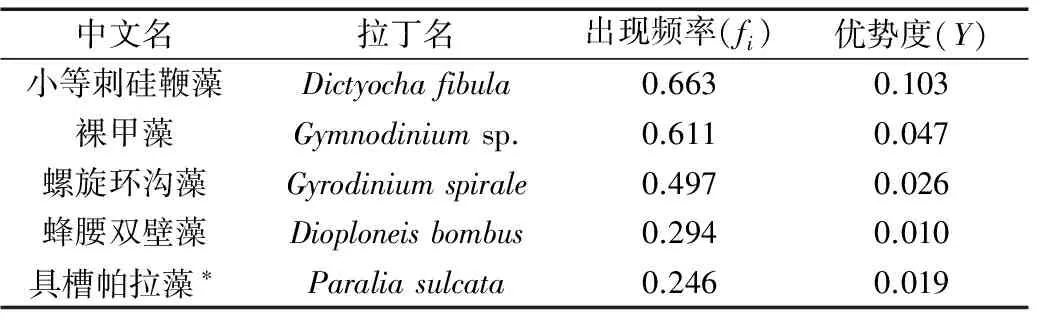
表1 2013年夏季调查海区浮游植物优势种Tab.1 Phytoplankton dominant species in the survey area in summer of 2013
2.2 浮游植物细胞丰度
2.2.1 细胞丰度的表层分布
表层浮游植物细胞丰度总体分布如图2所示,细胞丰度介于0.037 0×103~32.3 × 103cells·L-1,平均值为2.04 × 103cells·L-1。其中硅藻占浮游植物细胞丰度比例最大,为0.016 0×103~31.0×103cells·L-1,平均值为1.67 × 103cells·L-1,与浮游植物细胞丰度的总体分布情况相似;其次为甲藻,丰度为0.012 0×103~13.3×103cells·L-1,平均值为1.18×103cells·L-1;金藻出现频率与往年相比提高很多,丰度为0.010 0×103~11.9×103cells·L-1,平均值为0.420×103cells·L-1。
细胞丰度分布的总体趋势是从近岸到外海逐渐降低,高值区出现在苏北沿岸,其中在10294站位表层浮游植物细胞丰度达到调查区最高值32.3×103cells·L-1,在9094站位也达到25.4×103cells·L-1,相对丰度较高的主要是小等刺硅鞭藻、裸甲藻、角毛藻Chaetocerosspp. 和尖刺伪菱形藻Pseudo-nitzschiapungens,这与近岸充足的营养盐和光照有关。
另外,在外海的12694站位也有细胞丰度高值区出现,该站表层细胞丰度达到19.1 × 103cells·L-1,相对丰度较高的为角毛藻和丹麦细柱藻Leptocylindrusdanicus,这在很大程度上是受上升流和长江冲淡水影响所致,将营养盐输送到该海域,促进了浮游植物的生长[12]。
浮游植物在调查区中部偏东和北部丰度较低,很大程度上是因为北黄海陆架海区重要的海洋现象——黄海冷水团所致,7月份是其强度的鼎盛时期。已有的研究表明,黄海冷水团对海水化学要素和浮游生态系统的垂直分布具有重要影响。由于冷水团的存在,使得夏季成为跃层最为强盛的时期,从而阻断了营养盐的向上输送,同时,上层水体的营养盐由于浮游植物的摄取几乎被消耗殆尽,从而限制了浮游植物的繁殖和生长[13]。
总体来说,调查区硅藻占浮游植物细胞丰度比例最大,其丰度分布决定着浮游植物细胞丰度的总体分布;但甲藻也占有一定的比例,甚至在某些站位丰度较高,如在9094站表层甲藻细胞丰度达到13.3 × 103cells·L-1。本次调查中发现的金藻门中的小等刺硅鞭藻在许多站位成为丰度较高的物种。
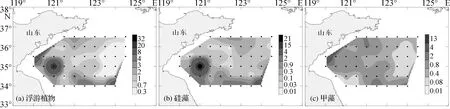
图2 调查海区表层浮游植物细胞丰度分布(单位:103 个/L)Fig.2 The distribution of surface phytoplankton cell abundance in the survey area(Unit:103 cells/L)
2.2.2 浮游植物细胞丰度的垂直分布
对调查区的A、B、C、D、E、F六个平行断面的细胞丰度进行作图(图3),来表征调查海域浮游植物的垂直分布特征。总体来说,这6个断面的浮游植物分布特征是随水深的增加而减少,由近岸向外海逐步降低。但在B、C和E断面,近岸的浮游植物细胞丰度却出现随水深的增加而增大的特点。这是因为北黄海春季水华过后的整个夏季,北黄海中央海域表层营养盐消耗殆尽,而跃层的存在阻碍了下层的营养盐向上传递。在水平方向,流场为环流结构,中央水域和边界水域交换较少,此时营养盐是上层浮游植物生长的主要限制性因子,由于营养盐的缺乏,细胞丰度较低,然而在紧贴温跃层下部,具有丰富的营养盐和合适的光照,且水体稳定,比较有利于浮游植物的生长[14]。
2.3 调查海域浮游植物的生态特征
调查海域浮游植物以沿岸性广温和广盐性种类为主,还有一定数量外洋性物种和底栖或附着性物种[15]。角毛藻属中的窄隙角毛藻Chaetocerosaffinis和柔弱角毛藻Chaetocerosdebilis等以及具槽帕拉藻、布氏双尾藻Ditylumbrightwellii等都属于沿岸广温性种。曲舟藻Pleurosigmapelagicum和新月柱鞘藻Cylindrothecaclosterium都属于底栖性种类。
作为优势种出现的角毛藻属的种类较多,主要为近岸性温带和热带种类,还有发现的菱形海线藻为分布极广的世界性种,其他种类都是适温、适盐范围较

图3 各断面浮游植物细胞丰度的垂直分布(单位:103个/L)Fig.3 The vertical distribution of phytoplankton cell abundance along sections in the survey area (Unit:103cells/L)
广宽的广布种和沿岸性种。也有少数属于外洋性种类,如扭角毛藻Chaetocerosconvolutus、星脐圆筛藻Coscinodiscusasteromphalus、笔尖形根管藻Rhizosoleniastyliformis为热带亚热带种。而发现的柔弱几内亚藻Guinardiadelicatula为南温带近岸性种类,常在暖海出现。
2.4 浮游植物群落的多样性指数分布
调查海域浮游植物多样性指数(Shannon-Wiener index)介于0.863~3.56之间,平均值为2.49,总体分布比较均匀,没有特别明显的高值区与低值区,但在山东半岛南岸与北黄海南部有2个相对高值区,分别达到3.45和3.56。而在调查区的东北部则出现低值区,数值为0.863。浮游植物的Pielou均匀度指数介于0.460~0.967,平均值是0.581,均匀度指数从近岸到远洋呈逐渐升高的趋势,高值区位于调查区的东部,而低值区出现在调查区北部近岸位置(图4)。
2.5 浮游植物优势种与环境因子的相关性分析
采用CCA分析法[16]分析功能类群与环境变量之间的对应关系(图5),对本次调查中相对丰度排名前10的物种进行了相关性分析。

图4 表层海水浮游植物群落的多样性指数分布Fig.4 Distribution of diversity indices of surface water in the survey area
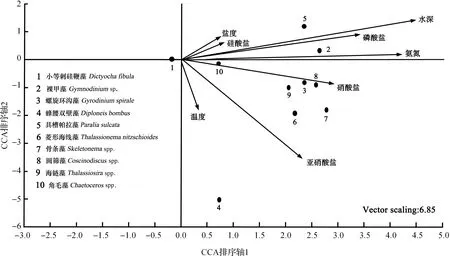
图5 优势种丰度与环境因子的典范对应分析(CCA)双序图Fig.5 Biplots of dominant species abundances and environmental variables in the survey area
如图5所示,氨氮、硝酸盐、磷酸盐等靠近排序轴1,因此营养盐条件是影响海区环境条件的重要因素。小等刺硅鞭藻在排序轴上,接近排序图中心,其丰度与环境因子的相关性不显著;而具槽帕拉藻与水深呈一定的正相关,印证了其丰度高值主要分布于底层。裸甲藻与氨氮和磷酸盐以及水深呈显著的正相关,且此处氨氮和磷酸盐的浓度相对较高;同时,裸甲藻跟温度的相关性不显著,最适的温度值可能偏低。螺旋环沟藻、菱形海线藻、骨条藻、圆筛藻和角毛藻都与硝酸盐和亚硝酸盐呈正相关,其中螺旋环沟藻、圆筛藻、角毛藻与硝酸盐呈极显著正相关,而三者的最适硝酸盐浓度圆筛藻最高,角毛藻最低。蜂腰双壁藻与营养盐的关系不密切,与温度呈正相关,温度可能是影响其丰度的重要因子。
2.6 本研究与历史资料对比分析
本次调查与已有的历史资料对比如表2所示。历史资料显示,黄海海域浮游植物群落的物种组成以硅藻和甲藻为主,其中硅藻类为多。但是,在不同的采样季节和区域,浮游植物群落的优势种存在较大变化。本次调查发现的优势种之一是金藻门中的小等刺硅鞭藻,这在以往的记录中是没有的。本次调查中裸甲藻和螺旋环沟藻也作为优势种出现,他们都属于甲藻门。具槽帕拉藻在历次调查中都作为优势种出现,其在该海域的分布相对稳定。但是,综合历史调查资料和本次调查资料,目前还不足以对北黄海乃至整个黄海的浮游植物群落有全面的认识。

表2 本研究与历史资料对比Tab.2 Comparisons of historical data with those in this study
3 结论
2013年夏季在北黄海中部的调查表明,硅藻在浮游植物群落中占绝对优势,其次是甲藻。浮游植物的细胞丰度介于0.037 0 × 103~ 32.3 × 103cells·L-1之间。金藻门中的小等刺硅鞭藻作为优势种出现,这在以往调查记录中未见。调查区浮游植物细胞丰度分布呈现明显的区域性,北黄海近岸站位的浮游植物细胞丰度明显高于外海站位,高值区在苏北沿岸以及北黄海东南部。细胞丰度在垂直方向上大体由表层向深层递减。
浮游植物多样性指数介于0.863~3.56,Pielou均匀度指数介于0.460~0.967。CCA分析结果显示,影响浮游植物优势种丰度分布的主要因素是营养盐,而跟盐度和温度的相关性不明显。磷、氮和硅等营养盐的水平是影响浮游植物群落结构的重要因素。
[1] LI Guan-guo. Marine ecology[M]. Beijing: Higher Education Press,2004. 李冠国.海洋生态学[M].北京:高等教育出版社,2004.
[2] SUN Jun, LIU Dong-yan, YANG Shi-min, et al. The preliminary study on phytoplankton community structure in the central Bohai Sea and the Bohai strait and its adjacent area[J]. Oceanologia et Limnologia Sinica,2002,33(5):461-471. 孙军,刘东艳,杨世民,等.渤海中部和渤海海峡及邻近海域浮游植物群落结构的初步研究[J].海洋与湖沼,2002,33(5):461-471.
[3] LIN Jin-mei. Ecological studies on planktonic dinoflagellate in the Southern Yellow Sea[J]. Acta Ecologica Sinica,1997,17(3):252-257. 林金美.南黄海浮游甲藻的生态研究[J].生态学报,1997,17(3):252-257.
[4] WANG Jun. Study on phytoplankton in the Yellow Sea in Spring[J]. Marine Fisheries Research,2001,22(1):56-61. 王俊.黄海春季浮游植物的调查研究[J].海洋水产研究,2001,22(1):56-61.
[5] WANG Jun. Study on phytoplankton in the Yellow Sea in Autumn and Winter[J]. Marine Fisheries Research,2003,24(1):15-23. 王俊.黄海秋、冬季浮游植物的调查研究[J].海洋水产研究,2003,24(1):15-23.
[6] SUN Jun, LIU Dong-yan, QIAN Shu-ben. A quantative research and analysis method for marine phytoplankton:An introduction to Utermöhl method and its modification[J]. Journal of Oceanography of Huanghai & Bohai Seas,2002,20(2):105-112. 孙军,刘东艳,钱树本.一种海洋浮游植物定量研究分析方法—Utermöhl方法的介绍及其改进[J].黄渤海海洋,2002,20(2):105-112.
[7] GB/T12763.4-91 The specification for marine monitoring(Part6): Marine biological survey[S].2007.GB/T 12763.4-91.海洋调查规范——海水化学要素观测[S].2007.
[8] SHANNON C E. A mathematical theory of communication[J].Bell System Technical Journal,195l,27:379-423.
[9] PIELOU E C.The interpretation of ecological data[M].New York:John Wiley&Sons,1984.
[10] SIMPSON E H. Measurement of diversity[J].Nature,1949, 163:688.
[11] SUN Jun, LIU Dong-yan. The preliminary notion on nomenclature of common phytoplankton in China Seas waters[J]. Oceanologia et Limnologia Sinica,2002,33(3):271-286. 孙军,刘东艳.中国海区常见浮游植物种名更改初步意见[J].海洋与湖沼,2002,33(3):271-286.
[12] ZOU E-mei, GUO Bing-huo, TANG Yu-xiang, et al. A number of hydrological characteristics and circulation analysis in Southern Yellow Sea and Northern East China Sea in summer[J]. Oceanologia et Limnologia Sinica,2001,32(3):340-348. 邹娥梅,郭炳火,汤毓祥,等.南黄海及东海北部夏季若干水文特征和环流分析[J].海洋与湖沼,2001,32(3):340-348.
[13] YU Fei, ZHANG Zhi-xin, DIAO Xin-yuan, et al. Analysis of evolution of the Huanghai Sea Cold Water Mass and its relationship with adjacent water masses[J]. Acta Oceanologica Sinica,2006,28(5):26-34. 于非,张志欣,刁新源,等.黄海冷水团演变过程及其与邻近水团关系的分析[J].海洋学报,2006,28(5):26-34.
[14] WEI Hao, WANG Lei, LIN Yi-an, et al. Nutrient transport across the thermocline in the central Yellow Sea[J]. Advances in Marine Science,2002,20(3):15-20. 魏皓,王磊,林以安,等.黄海中部营养盐的贯跃层输运[J].海洋科学进展,2002,20(3):15-20.
[15] JIN De-xiang. Marine planktonic diatoms of China[M].Shanghai:Shanghai Scientific & Technical Publishers,1965. 金德祥.中国海洋浮游硅藻类[M].上海:上海科学技术出版社,1965.
[16] JONGMAN R H G, TER BRAAK C J F, VAN TONGEREN O F R.Data analysis in community and landscape ecology[M].Cambridge:Cambridge University Press,1995:91-173.
[17] TIAN Wei, SUN Jun. Later spring phytoplankton community in Southern Yellow Sea in 2009[J]. Marine Sciences,2011,35(6):19-24. 田伟,孙军.2009年晚春黄海南部浮游植物群落[J].海洋科学,2011,35(6):19-24.
[18] GUO Shu-jin,SUN Jun. Phytoplankton communities in the northern Yellow Sea in autumn 2011[J]. Journal of Tianjin University of Science & Technology,2013,28(1):22-29. 郭术津,孙军.2011年秋季北黄海浮游植物群落[J].天津科技大学学报,2013,28(1):22-29.
[19] ZHANG Cui-xia, CHEN Ting, HUANG Xiao. Phytoplankton communities in the northern Yellow Sea in summer, 2011[J]. Transaction of Oceanology and Limnology,2014(1):81-93. 张翠霞,陈婷,黄晓.2011年夏季北黄海浮游植物群落[J].海洋湖沼通报,2014(1):81-93.
Phytoplankton community of the northern Yellow Sea in summer 2013
ZHANG Jian, LI Jia-rui, ZHAI wei-kang, PAN song, WANG yuan-jun
(NationalMarineDataandInformationService,Tianjin300171,China)
A total of 3 phyla 60 genera and 114 taxa(not including undefined species) were identified by the Utermöhl method in the survey area. The major groups were diatom and dinoflagellate. The ecotypes of most phytoplankton were temperate and coastal species. The dominant species wereDictyochafibula,Gymnodiniumsp.,Gyrodiniumspirale,DiploneisbombusandParaliasulcata. The cell abundance of phytoplankton ranged from 0.037 0× 103to 32.3 × 103cells·L-1, with an average of 2.04 × 103cells·L-1. The cell abundance of phytoplankton decreased offshore. Cell abundance was highest in west region of the northern Yellow Sea, about 32.3×103cells·L-1, and was also relatively high in southeast region in the survey area. The vertical distribution of phytoplankton was generally decreased with the increasing of water depth, and gradually decreased from coast to offshore. The Shannon-Wiener diversity was high in the southwest survey area, and the Pielou’s evenness index was high in the eastern survey area. According to canonical correspondence analysis (CCA), the main factors that influence the abundance distribution of dominant species are nutrients, and the correlation with salinity and temperature is not obvious.
phytoplankton; community structure; South Yellow Sea; summer
10.3969/j.issn.1001-909X.2015.03.012.
2014-12-30
2015-05-13
国家重点基础研究发展规划项目资助(2006CB400605)
张健(1986-),男,山东青岛市人,工程师,主要从事海洋生态方面的研究。E-mail:889900hhhhhh@163.com
Q178.53
A
1001-909X(2015)03-0084-07
10.3969/j.issn.1001-909X.2015.03.012
张健,李佳芮,翟伟康,等. 2013年夏季北黄海浮游植物群集[J]. 海洋学研究,2015,33(3):84-90,
ZHANG Jian, LI Jia-rui, ZHAI wei-kang, et al. Phytoplankton community of the northern Yellow Sea in summer 2013[J]. Journal of Marine Sciences, 2015,33(3):84-90, doi:10.3969/j.issn.1001-909X.2015.03.012.

