基于微流控技术的微液滴融合研究进展
申峰李 易刘赵淼曹刃拓王贵人(北京工业大学机械工程与应用电子技术学院,北京004)(Department of Mechanical Engineering&Biomedical Engineering Program, University of South Carolina,Columbia,SC,908,USA)
评述与进展
基于微流控技术的微液滴融合研究进展
申峰1,2李 易1刘赵淼*E-mail:lzm@bjut.edu.cn1曹刃拓1王贵人21(北京工业大学机械工程与应用电子技术学院,北京100124)
2(Department of Mechanical Engineering&Biomedical Engineering Program, University of South Carolina,Columbia,SC,29208,USA)
随着芯片实验(Lab-on-a-chip)研究的不断发展,利用微流控技术(Microfluidics)对微通道中的液滴进行精准操控,引起了越来越多的研究者关注。本文介绍了微通道液滴基本理论及融合机理,通过改变微通道几何结构和表面特性等影响因素实现微液滴融合的被动融合方式,通过施加外电场、磁场、温度场、表面声波和激光聚焦等作用实现微液滴融合的主动融合方式,以及液滴融合过程中的流体动力学特性。最后对微流控芯片液滴融合技术研究的发展前景进行了展望,为微流控器件设计、微液滴控制技术的广泛利用提供有价值的参考。
微流控技术;液滴融合;微通道;芯片实验室;评述
1 引 言
微流控芯片(Microfluidic chip)也称作芯片实验室(Lab-on-a-chip),是近十几年来发展迅速的多学科交叉研究领域[1],它是一种以在微米尺度空间对流体进行操控为主要特征的科学技术[2]。微流控芯片利用微电子机械系统(MEMS)技术在硅、玻璃或高分子材料等基片上制作微通道、微泵、微阀、微反应器等功能单元,并施加电场或压力等各种外力场驱动,对芯片中的微量流体进行控制和处理,充分利用微通道中流体的物理特性,可以实现对微量流体或样品的精确操纵、处理与控制的功能[3],可以将生物、化学等实验室的各种操作功能,如样品制备、反应、分离、检测及细胞培养、分选、裂解等,集成到一块几平方厘米(甚至更小)的芯片上[4]。相比于传统方法,微流控芯片具有成本低、样品消耗少、易自动化、灵活快速、易微型化等优势,在疾病诊断、细胞研究、药物筛选、环境监测、绿色能源、材料合成等领域展示出广阔的应用前景[4]。因此,Nature杂志评论认为芯片实验室可能成为“本世纪的技术”[5~7]。
微流控芯片液滴是一种新的操纵微小体积液体的技术。微液滴操控技术一般是指将两种不相融的流体,如水和油,其中一种作为连续相,另一种作为分散相微液滴体积单元(10-15~10-9L),并利用微流控技术,控制两相流动行为,以实现微液滴的生成、输运、分裂、融合、分选、定位和捕获等控制功能[2,4]。微流控芯片液滴技术已成为微流控芯片研究的一个重要发展方向[5~8]。微液滴具有高比表面积、传质传热时间短和扩散距离短等特点,在微液滴中进行反应的时间比常规体系短,因此,微流控芯片中的微液滴具有微反应器的功能[9~13]。此外,微液滴具有较高的单分散性、微小的体积,以及不受限的液滴生成数量,为化学和生物研究提供了一个独特的微型化平台,而且微液滴体积及运动行为可以精确操控,并具有可重现性。由于液滴界面张力的作用,微液滴内部可以产生与外界连续相流体不同的物理和化学反应环境,同时,微液滴内部流体可以与微通道壁面隔离,以减小通道表面性质对内部反应的影响[8]。由于微液滴平台的这些独特优势,其应用领域正在不断扩展,包括细胞和亚细胞结构分析[14~17]、蛋白质结晶[18,19]、纳米粒子的合成[20,21]和纳米分子自组装[22,23]以及高通量注射等[24,25]。
基于微液滴的生物化学反应,如微纳颗粒的材料合成过程中,需要将两种不同的液滴融合在一起,以便获得较好的混合反应效果,因此,液滴的可控融合(Coalescence)已成为一项重要的微流控技术,对于在液滴内实现多步反应十分重要[8~13]。微通道液滴融合是指将两个或多个微液滴接触并融合在一起。融合过程中需要克服液滴之间流体薄膜的表面张力作用,并使得液滴界面失稳才能实现融合。由于微通道上下壁面的限制作用,液滴之间的连续相流体需要从有限的空间排出,增加了融合的难度。同时,液滴界面通常不再是球形,液滴融合过程中毛细力-黏性力-惯性力的平衡方式与宏观尺度下的液滴融合过程不同,现有宏观尺度的液滴融合理论难以对其进行定量的描述[2]。此外,由于液滴界面的可变形性,导致了界面张力的不均匀变化和液滴的非线性问题等一系列新的流体力学问题[8,26],如微通道入口压力的微小变化可能引发流动由液滴向射流的转变,导致非线性不稳定流动的产生[2,8]。
目前,微液滴融合主要分为被动融合和主动融合两类[2,8,9]。被动融合主要利用液滴及连续相的流动特性,通过改变微通道几何结构、增加特殊的微结构、调节液滴生成速率和改变通道表面浸润性等方法,使上游液滴流速变慢(或暂时被捕获在某特定位置),使得下游液滴能追上上游液滴,并在特定位置处发生接触并融合。在两液滴相互靠近的过程中,液滴之间的连续相流体逐渐被排空;在接触过程中,由于压力或者剪切力作用,液滴界面变得不稳定并破裂,诱导发生两液滴融合[2]。被动融合方式不需要主动控制或电子设备,比主动控制的微流控系统更简单,但是需要对微通道结构进行更科学合理的设计,必须充分掌握微通道两相流动特性。被动融合方式的一个主要优势是对液滴内部物质的干扰较小,特别是进行细胞等生化分析时非常重要。此外,液滴被动融合受到流体表面张力波动等自然现象的限制,其融合效率一般比主动融合速率低[27]。
主动融合是指通过施加外加电场[28]、磁场[29]、温度场[30]、表面声波[31,32]和激光聚焦[33]等作用,诱导液滴界面失稳,发生融合。相比被动融合,主动融合方式本质上更加复杂,因为需要在微通道上制作微电极,并对电信号进行精确的时间控制。此外,微电极可能会对液滴内部物质造成干扰或污染,比如液滴内部物质可能沉积在微电极上,电信号可能对生物分子(DNA或蛋白质)的生物相融性造成影响。主动融合方式可以利用电极加速液滴表面张力的不稳定性促进融合发生,具有更高的效率[29]。
本文首先阐述了微通道内液滴融合的基本理论及其影响因素,然后详细综述了目前国内外研究中通过控制微通道内液滴融合影响因素,以实现微液滴融合的被动融合和主动融合两种融合方式,主要包括控制通道几何结构、表面活性剂和外加电场、磁场、温度场、表面声波和激光聚焦等方法,并阐述了微通道内液滴融合的流体动力学特性,最后对微通道内液滴融合技术的发展进行了展望。
2 微液滴基础理论
从微流体力学角度来看,基于微液滴的生成、输运、反应及合成等一系列控制功能都是以多相流形式进行的[2]。多相流的根本特点是流动中同时存在着被相界面明显分开的两种或者多种物质组分,界面的存在将非线性效应引入到微流动中,微液滴流动行为变得复杂[2,8,26]。同时,由于微通道壁面的限制作用,液滴的比表面积非常大,壁面浸润性引起的边界效应对微液滴流动行为也有重要影响,微液滴的演化规律与宏观流动下有显著不同[2]。深入研究微通道中液滴流动行为问题,将推进微流控芯片结构的优化设计和微液滴控制技术的创新,具有重要理论指导和实际应用价值[2,3,8,26,34~37]。
2.1 表面张力
由于液滴界面的存在,必须考虑界面张力的作用。界面张力σ是由于液体交界面处分子引力不均衡而产生的沿着界面的张力,定义为单位长度上的作用力(N/m),或者为单位面积上的能量(J/m2)[2,8]。当界面张力不平衡时,可以引发从低界面张力处到高界面张力处的流动(Marangoni对流)。由温度梯度或表面活性剂分子改变引起的界面张力驱动的流动分别称为热毛细对流或溶质毛细对流[8]。同时,界面张力作用使得液滴界面面积趋于最小化,以减小表面能量。孤立的液滴或气泡其表面是球形时表面积最小,然而,微通道中液滴还受到壁面限制作用,其界面往往不能收缩为球形,而是变为弯曲的。界面的曲率会导致内外产生压力跳跃,即拉普拉斯压力(Laplace pressure):
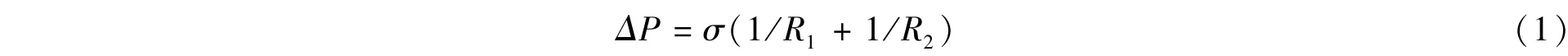
其中R1和R2为液滴界面不同位置处的曲率半径。半径越小,ΔP越大。由于液滴界面不同空间位置的曲率半径不同,液滴内部的压力分布也不同,其对液滴内外流场的流动演变过程起重要作用[2]。
2.2 无量纲参数
微液滴多相流的流动行为依赖于各种作用力,包括粘性力、惯性力、重力、表面张力、剪切力、分离压力等,它们对流动的相对影响可以用以下无量纲参数表述[2],即:
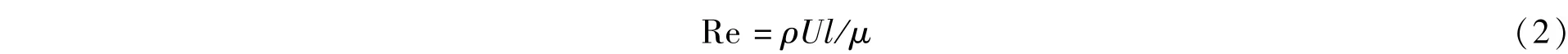
其中,ρ,μ,U和l分别为流体密度、粘度、特征速度及特征长度,Re是惯性力(ρU2/l)与粘性力(ρU/l2)的比值,一般小于10,流动表现为层流。多数情况下惯性力可以忽略,然而当微液滴速度很快或者液滴破裂瞬间,惯性力也有一定的影响作用。
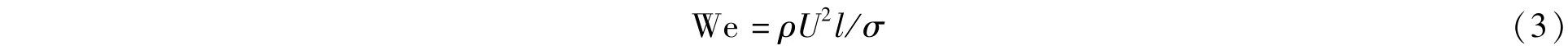
We表示惯性力与界面张力的比值。在微通道中,We一般较宏观尺度时小很多,界面张力对流动的影响明显。
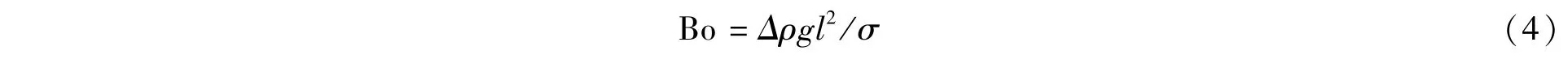
其中,g、Δρ分别为重力加速度和不同流体的密度差。Bo表示重力作用与界面张力之比,一般Bo远小于1,即重力的影响相对表面张力较弱,通常可以忽略重力的作用。
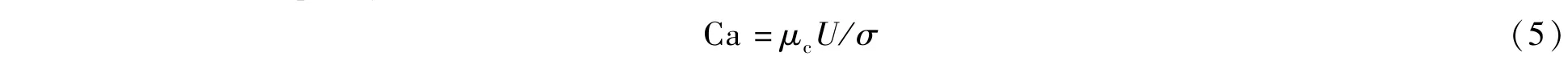
Ca表示粘性应力与界面张力的比值,其中,μc是两相流体中连续相粘度,U一般是指液滴融合处的特征速度,σ是连续相和分散相的界面张力。若Ca较小时,界面张力起主导作用,界面较稳定,液滴的端面易产生球形;反之,粘性力起主导液滴流动行为,液滴界面易产生较大的变形或者其形状变得不对称。
从上述无量纲参数的定义可以发现,微液滴流动的Re数、We数和Bo数都较小,具有粘性层流的特点,多数情况下粘性应力和表面张力占主导作用(Ca)。此外,微通道壁面对液滴界面的限制作用、通道壁面浸润性、微通道几何尺寸的比值及液滴大小与通道尺寸的关系等因素都对微液滴多相流有重要影响[8,26]。对于外加力场(如电场、光热、声波等)的情况,则需要表征外加力与表面张力的相对重要性,并描述其作用机制[26]。
2.3 表面活性剂作用
为了有利于微液滴的生成和输运,通常在微通道连续相中添加表面活性剂以降低界面张力。表面活性剂可使液滴界面变得相对稳定,液滴间不容易融合,从而使液滴成为一种微反应器。但是,由于流动和分子扩散等因素的影响,使得表面活性剂浓度的空间分布变得不均匀,导致界面张力的空间变化,进而影响界面流动。表面活性剂使液滴处于亚稳状态[38],当两个液滴相互靠近时,如图1a所示,有两种作用机制[26,37]:一是表面活性剂分子的排斥作用使相互靠近的界面更加稳定;二是连续相在排出过程中,流动导致界面表面活性剂浓度发生变化,改变了界面各点的界面张力σ,产生了Marangoni应力[8,38]:
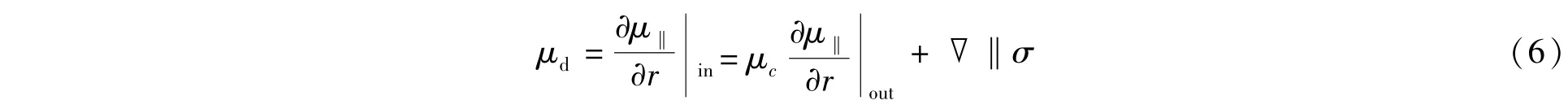
其中,μd和μc分别为离散相和连续相的黏度,μ‖为切向速度,r为半径方向,▽‖为界面某点处界面张力在切线方向的导数。Marangoni应力作用下,产生沿着界面向液膜中心的Marangoni对流,如图1b所示,阻碍了连续相的排出,延长了排液时间,使得微液滴更加稳定[38]。
2.4 微液滴融合机理
微液滴融合基本包括4个过程:(1)液滴的捕捉或定位;(2)两液滴的相互靠近、碰撞及变形过程;(3)液滴间连续相液膜排液过程;(4)液滴界面薄膜破裂及融合发生过程[39]。目前多数研究着重于微液滴的生成过程,而对于微液滴融合机理尚需深入研究。影响液滴融合的因素复杂,包括:通道几何结构、入口流速、表面活性剂、壁面性质和外加力场等。目前,外加力场作用对液滴的作用强度尚无法进行定量化的测量,无法准确表征外场力与表面张力的相对重要性。此外,由于外加力场作用下产生的液滴界面的变形及瞬态非线性振动等问题,一直是学术研究的难题,目前外加力场作用下的液滴融合尚无精确的理论分析,多数依靠实验经验进行。由于篇幅限制,本文未介绍这方面内容。
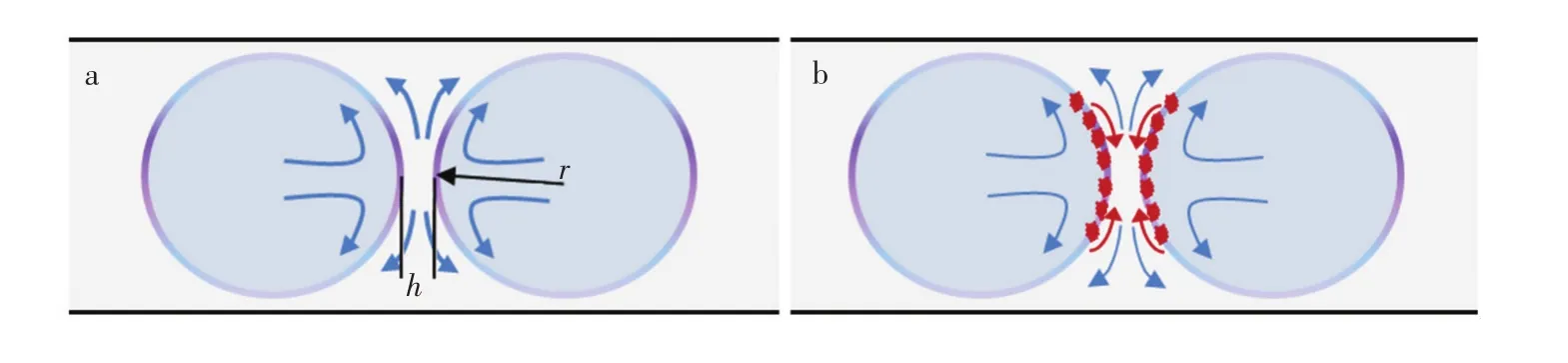
图1 微液滴排液过程示意图[26,37]Fig.1 Schematic representation of film drainage of continuous phase between drops[26,37](a)无表面活性剂排液过程;(b)表面活性剂浓度梯度引起的Marangoni应力(红色箭头)阻碍了排液。(a)Absence of surfactant;(b)Marangoni stress(red arrows)induced by the gradient of surface density of the surfactant counteracts the film drainage.
目前,许多学者用液膜排液理论(Film drainage model)描述两液滴的被动融合过程[39]。当下游液滴与上游液滴接触后,可能依附在一起,由于中间存在液膜而无法相互融合。两液滴接触后,具有相互挤压或者相对滑移的趋势,可能发生旋转,导致两液滴中心点连线不再与通道轴线平行。同时,液滴间的连续相液膜开始排液,而液膜之间多余的毛细力同时驱动其排液[40],排液速度由碰撞速度和液膜粘度等因素决定,即毛细数Ca。临界毛细数是判断融合是否发生的关键参数[3]。研究发现,液滴融合多数发生在低速率碰撞时,临界毛细数Cac≈10-2,低于临界值时更容易发生融合[3],如图2a所示。当毛细数大于临界值时,液滴可能会滑移过先前的液滴不发生融合[3],如图2b所示。
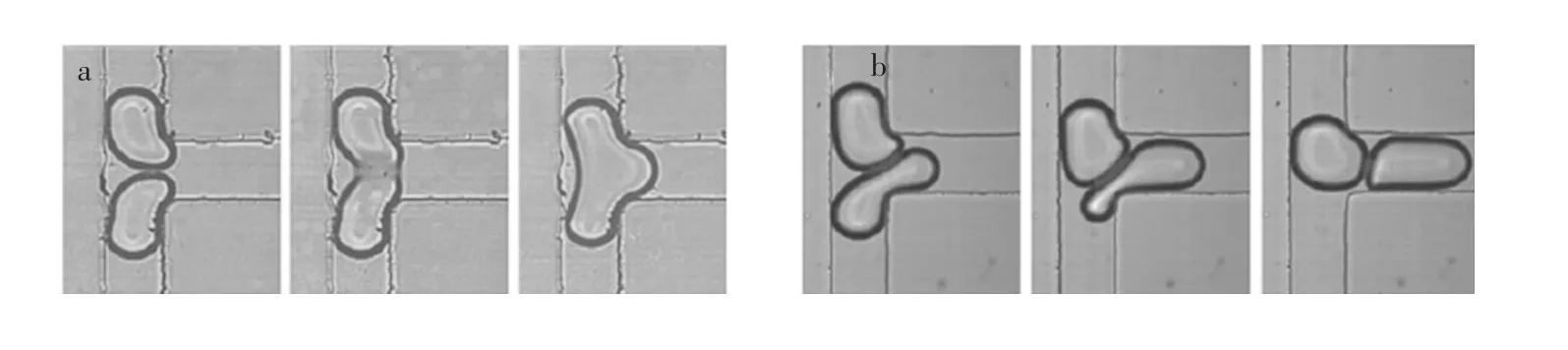
图2 毛细数对液滴融合的影响[3]Fig.2 Influence of capillary number(Ca)on drop coalescence[3](a)毛细数低于临界值,液滴发生融合;(b)毛细数大于临界值,液滴发生滑移而不融合。(a)Ca<Cac,coalescence;(b)Ca>Cac,slipping.
如果液滴保持足够长时间的接触,且液膜变得越来越薄,当液膜足够薄时,范德华力和其它分子间作用力开始起主导作用,液膜破裂且液滴融合发生[3]。通常液膜排液效率随毛细数的增大而增大。另外,液滴碰撞角度对排液时间也有一定影响[42]。Klaseboer等[43]给出了液滴正面碰撞时液膜排液时间的表达式:
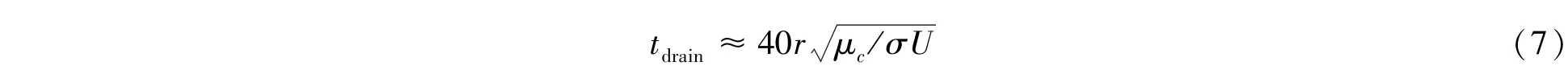
此外,Hu等[44]发现,两液滴正面碰撞时液滴融合的临界毛细数依赖于液滴的半径r和两相流体的粘度比λ=μd/μc,可以用以下公式表示:
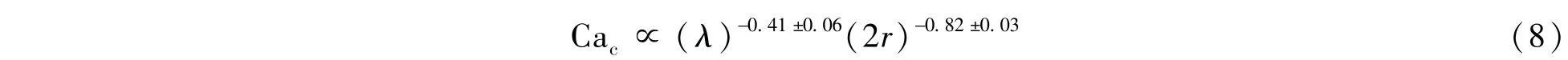
目前,大量实验及数值模拟研究表明,液膜排液时间、融合的临界毛细数及液滴融合角度还受到液滴尺寸[45,46]、粘度比[45,47]、液滴的整体变形[48,49]和碰撞的偏移[42]等因素影响。同时,壁面亲疏水性对液膜排液也有重要影响。Li等[50]研究了亲水微通道液滴和液柱间的融合,发现更好的亲水表面、更小的通道尺寸、更短的液滴到入口的距离、更大的液滴尺寸会诱发较大的毛细压力。融合过程的其它形式也得到了研究者的关注,例如简单的剪切流引发液滴融合[51,52],大量乳液在特殊结构中通过平滑表面促进液滴融合等[53,54]。
3 微液滴融合的控制方法
3.1 控制微通道几何结构实现微液滴融合的方法
3.1.1 利用流动阻碍结构实现液滴融合的方法通过微加工方法在通道内增加流动阻碍结构是最常见的实现微液滴融合的控制方法。Xu等[55]报道了壁面突起、圆形扩张截面和椭圆形扩张截面3种不同的流动阻碍结构。液滴融合的过程大致可以描述成:增加阻碍结构,使先到达的液滴停留,捕捉前面液滴,待后面的液滴到达时与其发生融合,之后共同运动。
为了实现前面液滴的流动减速,Tan等[56]设计并实验研究了3种液滴融合的通道结构,包括:矩形扩张结构,锥形扩张结构和流动聚焦结构,如图3所示。矩形扩张结构的作用是可以使液滴在扩张段减速,并有利于液滴间连续相液体的排出,减小液滴间距,使两液滴碰撞并而发生融合。扩张段长度与宽度以及两相流速度对液滴是否融合有重要影响。锥形扩张结构通道中,由于离散相液滴的速度急剧减小,以及连续相在锥形扩张中的连续排液,可以造成多个液滴的不断融合,融合液滴的数量不易控制。与前两种结构不同,十字形的流动整流结构可以通过控制下游上下两通道的流速,以控制两液滴间连续相液体的排液速度,从而实现液滴在十字交叉处的融合控制[56]。
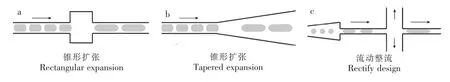
图3 通过流动控制实现液滴融合的不同微通道结构[56]Fig.3 Three differentmicrochannels for droplet fusion[56]
运用相似的流动整流方法,Gunes等[57]在微通道上、下两侧增加了许多垂直方向的流动可控的微通道,如图4a所示。通过控制垂直方向微通道内流体的流动,以加速两液滴间的排液速度,实现液滴的可控融合,并可以实现多液滴融合。此结构的优点为:液滴之间的碰撞与分离可以独立控制,不会产生明显的流动干扰。Tan等[58]研究了微整流通道宽度对通道交叉处液滴融合的影响,通过增加整流通道的宽度,可以实现2~6个多液滴融合,如图4b所示为2~3个不同液滴的融合过程。

图4 利用微整流通道控制的液滴融合(a)并列多个微整流通道控制[57];(b)增加整流通道宽度[58]。Fig.4 Controll of droplet fusion using(a)listof smallmediated flow channel[57]and(b)Widenedmediated flow channel[58].
Niu等[59]在通道扩大段设计加工了两排微柱作为液滴流动阻碍结构。由于微柱对液滴的挤压作用,液滴被捕捉在微柱腔内,直到与后来液滴发生挤压融合。当连续相液体压力大于液滴的界面张力时,融合后的液滴离开微柱腔。
在微通道中增加一段渐宽的通道已经成为液滴融合广泛采用的一种结构[56,58,60]。通道变宽处由于通道宽度增大,连续相速度降低,致使前面液滴被减速,并与后面液滴不断靠近直至发生融合。然而,与普遍认为的液滴间由于挤压融合的现象不同,Bremond等[61]实验发现,在扩展通道中液滴并不是第一次相遇时融合,而是在分离的过程中当前一个液滴进入到窄通道时与后一个液滴发生融合,如图5a所示。这种分离引起表面张力的瞬时不稳定,并产生了液滴表面的突起(图5b),进而打破了液滴的界面张力,使得这两个液滴能够迅速靠近并发生融合。此后,Lai等[62]研究了此现象的产生机理,结果表明,这种突起使得局部表面积迅速增加,从而导致液滴表面某些位置的不稳定性,进而使液滴发生融合。

图5 液滴在扩展通道分离时流动扰动引起的液滴(a)融合过程和(b)融合机理[61]Fig.5 Droplet in separation caused by flow destabilization of extend the channel(a)fusion process and(b)fusionmechanism[61]
3.1.2 利用交叉结构实现液滴融合的方法除了流动阻碍结构,微通道交叉结构也是一种常见的能够有效促进液滴融合的方法。其融合的基本原理是保证两相向运动的微液滴在交叉处相遇,由于挤压作用实现排液,并使液膜破裂,从而实现融合。相对于同方向运动的液滴融合,相向碰撞的液滴融合方法的效率较高,且不会产生多液滴融合的现象,液滴融合的可控性强。但是,为保证液滴相向流动时能够同时到达交汇处,必须对上游的微液滴运动进行精确的同步控制,增加了实际操作的困难。
微通道交叉结构一般包括T型和Y型两种。液滴融合过程中,液体粘度和两相流速度对是否融合有重要影响,一般增大连续相液体粘度与两相流速度会阻碍液滴融合。同时,根据液膜排液理论,两液滴表面接触时间与排液时间也是判断液滴是否融合的关键因素。其中,液滴在通道内的流速与总流量、液滴尺寸、微通道宽高比等对排液效率有重要影响。Yang等[63]实验研究了T型交叉微通道内气泡的融合,观察到了微气泡碰撞后会产生的3种融合现象,即:绝对融合(Absolute coalescence)、概率性融合(Probabilistic coalescence)和不融合(Non-coalescence),并对融合概率的影响因素进行了分析。
Christopher等[41]利用T型交叉微通道研究了液滴尺寸及流动速度对融合过程的影响,发现在通道的T型交叉处碰撞后会发生6种现象,即:除融合和滑移两种现象(图2)外,还会发生分裂、多次分裂、后融合和后滑移4种现象,如图6所示。研究发现,液滴尺寸及流动速度对融合过程有重要影响,碰撞速度较低时容易发生融合,小液滴流动速度较快时不发生融合,流速快的大液滴相互挤压会分裂成多个液滴。只有对液滴到达交叉处的时间进行精确的同步控制,使两微液滴到达的时间差远低于在交叉处停留的时间,才可使两液滴发生融合。
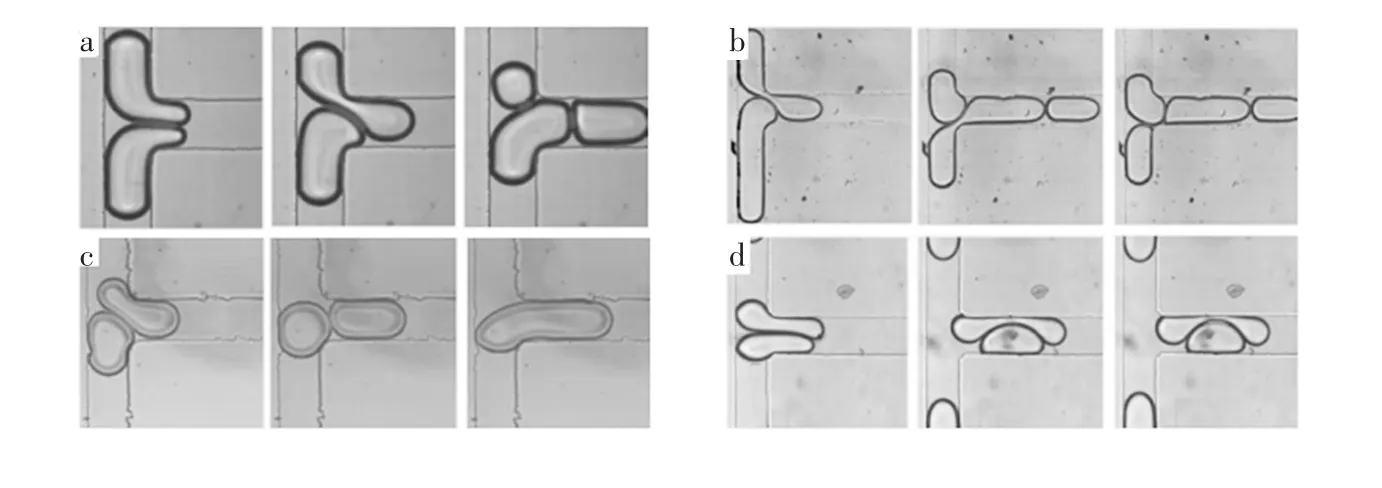
图6 液滴在通道交叉处碰撞的(a)分裂;(b)多次分裂;(c)后融合;(d)后滑移4种流动现象[41]Fig.6 Four different forms of droplet collision atmicrofluidic junctions(a)splitting,(b)multiple splitting, (c)late coalescence and(d)late splitting[41]
Liu等[64]研究了Y型交叉微通道不同夹角30°,60°,90°,120°,150°和180°对液滴融合的影响,发现液滴融合的临界毛细数随通道夹角的增大而减小,增大两相流速和通道夹角可以减小液膜排液时间。Wang等[65]设计了夹角为60°,120°和180°的3种Y型交叉微通道,观测了微液滴在交叉处接触、挤压、融合或分离的过程,分析了液滴尺寸、碰撞角度、流体物理性质对液膜排液时间、液滴接触时间以及融合临界毛细数的影响,实验结果表明,减小液滴碰撞角度能够更好的促进液滴融合,并提出了预测融合的临界毛细数公式。
上述两种交叉通道都需要对液滴到达交叉处的时间进行精确的同步控制,增加了实验的难度,为此,Wang等[66]设计了一种十字交叉型通道,解决了微液滴同步问题。与T型和Y型交叉结构相比,十字交叉型通道能提供上下对称相对稳定的流场,使先到达交叉处的液滴停留下来,直到对面的液滴运动到交叉处并与其发生接触,允许液滴到达交叉的时间有一定偏差。
Mazutis等[67]改变T型交叉微通道流动方式,让两种不同液滴在交叉处相遇形成配对,并在下游较宽的融合通道中共同运动,由流动致使液滴发生融合,其过程如图7a所示。由于液滴表面活性剂分子作用,两液滴表面接触,但并不融合。在融合通道中,由于流场作用使直径小的乳液滴绕大液滴发生旋转,旋转一定角度后,小液滴被拉长变形,两液滴中心点间距增大到临界值时,液滴表面张力变得不平衡,使两液滴发生融合,如图7b所示。此方法不但实现了单通道液滴旋转融合,还可以实现液滴与乳液数量比为1∶1,1∶2和1∶3的融合,如图7c所示。
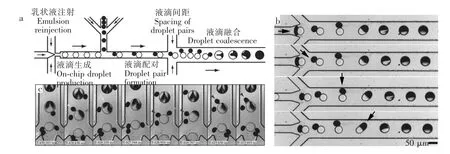
图7 (a)微流控芯片示意图;(b)流动致液滴旋转融合;(c)液滴与乳液数量比为1∶2的融合过程[67]Fig.7 (a)Schematic of the microfluidic chip;(b)Flow-induced droplet rotation and coalescence;(c)Process of 1∶2 coalescence[67]
3.1.3 利用微刀片结构实现液滴融合的方法Deng等[68]提出一种新颖的利用微刀片结构实现液滴融合的方法,通过在两液滴交汇处加入微刀片来促进液滴融合。当液滴流过微刀片时,液滴表面液膜平衡状态被刀片破坏,使表面活性剂发生临时的局部分散,通过“伤口”处诱导液滴融合,并分析了微刀片表面亲疏水性和尖端形状对融合的影响,如图8所示。结果表明,亲水的带尖端的刀片更有利于破坏液滴界面稳定性,诱发液滴融合。
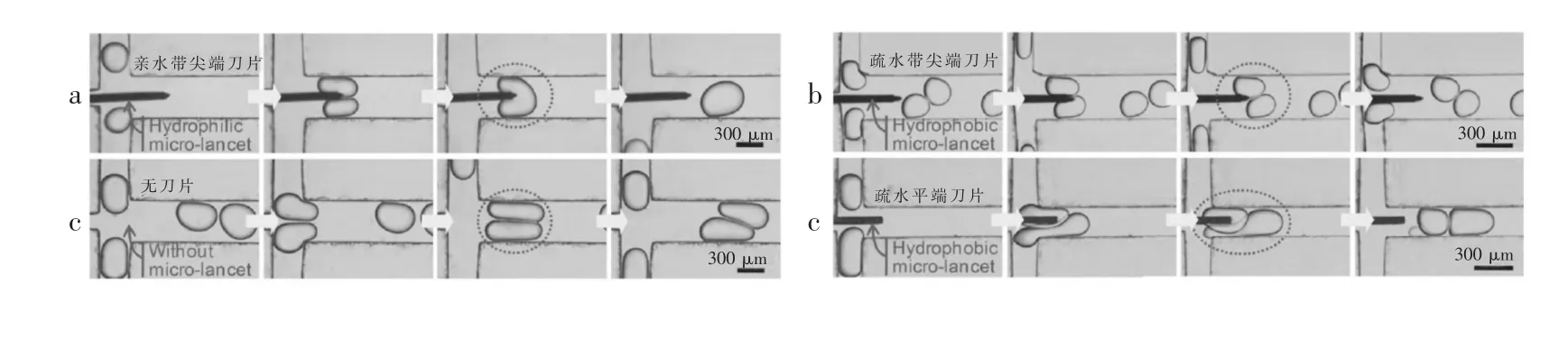
图8 利用微刀片结构诱导液滴融合过程[68]Fig.8 Droplets fusion induced bymicro-lancets[68]
3.2 通过表面活性剂实现微液滴融合的方法
除上述运用通道几何结构和流动特性促进液滴融合方法外,在微通道连续相中添加表面活性剂以降低界面张力,成为促进液滴融合的另一种方法。Baret等[37]综述了表面活性剂对微流控芯片液滴控制的重要影响,阐述了其在生物系统相融方面和液滴间的分子交换领域中破坏界面稳定性的机理,指出表面活性剂可以溶解在油分子中,通过油分子的扩散与另一个液滴融合。Mazutis等[69]研究了一种简单可靠的装置,可以在KHz的频率下达到液滴对在微流控系统中一对一的融合。这种技术需要在稳定的液滴表面加入活性剂,连接到合适的几何结构中实现液滴融合。Fryd等[70]研究了油包水的乳状液,应用一种离子表面活性剂保持液滴稳定,应用另一种带相反电荷的离子表面活性剂溶液与其发生融合。然而,表面活性剂的使用具有一定的双重性。Liu等[71]研究发现,随着表面活性剂浓度的增加,液滴尺寸逐渐减小并导致液滴不易发生融合。此外,Shestopalov等[21]研究发现,当表面活性剂重量增加到5% 时,额外的试剂会导致液滴分离,不发生融合。
Tullis等[72]提出了一种微通道内平行阵列中指定液滴对融合的有效方法。通过减小外部流动油相表面活性剂的含量移走液滴表面的活性剂来达到液滴成对的融合。研究发现,油相表面不加活性剂可以缩短液滴融合时间。然而,不使用表面活性剂也有其缺点,例如发生意外的融合,并且融合后进一步操控液滴受到限制。
还有一些学者研究了带有表面活性剂液滴的被动融合。Mazutis等[69]设计了一种尺寸明显不对称,在表面活性剂作用下实现液滴融合的微通道,发现液滴并不是按照预定的方式进行融合。因此,较好的融合方式应先使用表面活性剂使液滴稳定,后再借用外力使液滴融合。
3.3 利用外场作用的液滴主动融合方式
由于通道尺寸微小,液滴运动规律不易精确控制,要实现液滴捕获使其融合进行反应,可能需要施加外力作用。利用电场进行融合(Electro-coalescence)是目前最常用的主动融合方式[73~76],其原理为通过电诱导使液滴带相反电荷从而实现液滴对融合[73]。液滴可以在静电力作用下相互靠近并融合,或者电场产生的麦克斯韦应力使液滴界面变形并破裂,促进液滴融合。电场的作用条件可以很宽泛,电压为1~103V,频率从DC到数kHz,均能较好地控制液滴融合。此外,利用电场进行液滴融合时,可以将电极嵌入到微通道中或者是距离通道几mm远的位置,电场方向可以平行或垂直于液滴接触面。
Wang等[74]利用外加电场来捕获液滴,从而实现液滴对的融合,微流控芯片结构如图9a所示。研究发现,不加电场时液滴会沿着主通道流过,不会进入外凹槽。加入电场时主通道的液滴会进入微凹槽被捕获,并与下一个液滴融合,再去掉电场时,液滴又沿主通道运动,如图9b所示。
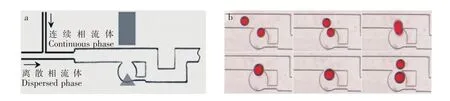
图9 外加电场实现液滴捕捉融合:(a)微流控芯片结构示意图;(b)液滴捕捉融合过程[74]Fig.9 Droplet trapping and fusing using electric field:(a)Microfluidic platform diagram;(b)Droplet trapping and fusing process[74]
Hao等[75]设计了一种可控的嵌入式局部电场,控制液滴在微通道内的融合。该系统利用电润湿原理,结合流体动力学控制,可以单独改变液滴的尺寸和生成频率。通过几百次的观察,发现按需求融合的效率达到98%。该系统采用了一种交叉电场促进液滴融合,关掉这种电场,此时的表面活性剂稳定,即便它们之间相互挤压也不发生融合。需要融合时,打开电场开关,液滴表面的不稳定导致液滴融合。
Schoeman等[76]设计了一种实现细胞液滴生成与融合的微通道结构,通过双T通道形成包裹单细胞的液滴,通过调节两相流速等参数,使两个包裹不同细胞的液滴同时到达Y型微通道交叉处实现液滴配对,再利用微电极施加电场作用使液滴融合,如图10所示。
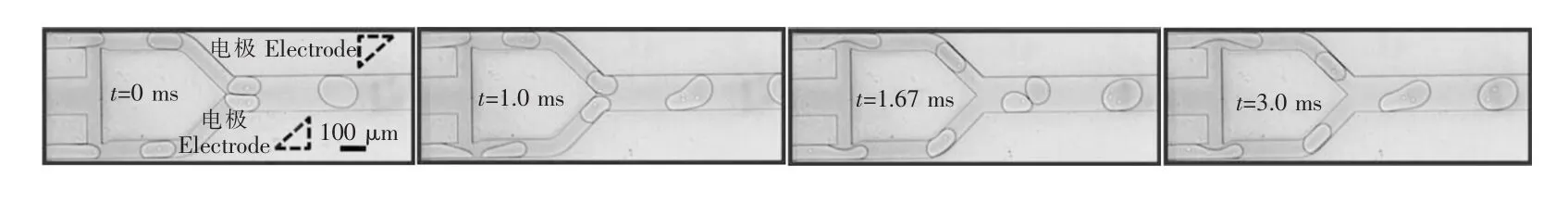
图10 单细胞液滴生成并配对以及融合过程[76]Fig.10 Process of single-cell encapsulation,droplet pairing and fusion[76]
除了外加电场实现微液滴融合方法外,其它主动控制的液滴融合方法还包括:磁场[29]、温度场[30]、表面声波[31,32]和激光聚焦[33]等。其中,表面声波不但可以进行微液滴操控[26,77],还可以控制微液滴的融合。Fu等[78]在一种压电基板上应用微电子技术安装了一个交互传感器和一个反射器,彼此间由表面声波互相干扰,实现微通道内液滴融合。研究表明,液滴的大小、距离和信号强度能够显著的影响液滴融合。基于声波在两相流体中的传播阻力不同会产生声散射作用力的原理,Muhsincan[79]等制作了表面声波装置,如图11a所示。利用表面声波将液滴捕捉在矩形微凹槽内,等待下一个液滴到来发生融合,可以实现2~3个液滴的融合。当融合后的液滴体积超过一定临界值时,在连续相流体作用力下从凹槽流出,如图11b所示。
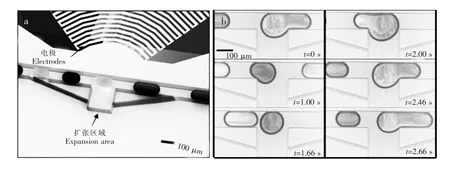
图11 表面声波液滴融合:(a)微流控芯片结构示意图;(b)液滴捕捉及融合过程[79]Fig.11 Dropletmerging using surface acoustic waves:(a)Microfluidic chip design;(b)Droplet trapping and merging[79]
利用电场进行融合一般需要相对较高的电压,而热融合的提出克服了被动融合与电场融合的弊端。文献[80,81]研究了液滴在融合室内加热时的融合过程,实验表明流速对临界温度具有显著影响。Peng等[82]研究了在加热的微室中,由于两个相邻液滴间间隙减小导致液滴融合的物理过程,并通过数学公式的推导,物理方程的求解进行了分析。液滴融合还可以通过引入激光束来实现,一些学者通过涡的捕捉和激光诱导的热梯度实现了光作用下的微液滴融合[83,84],利用激光的热效应对两液滴接触处进行加热,一方面排出了液滴界面处的表面活性剂分子,一方面诱导产生复杂的三维流动,这两方面作用都可以有效地排除液滴间的流体薄层,从而促进液滴融合[8]。Jin等[85]提出了一种高精度的光控法来诱导液滴融合。在融合前,利用光的分散性和梯度力挤压捕获液滴,并使用分析模型进行实验,实验数据和光对液滴行为的影响是一致的。
3.4 液滴融合过程中的流场特性研究
利用流体力学实验方法和显微流场测速技术(Micro-PIV),开展液滴融合过程流场特性研究,深入揭示液滴融合机理,成为目前微液滴控制研究重要内容。Jin等[86]研究了液滴在直通道和收敛通道中的融合过程。观测结果表明,液滴融合要通过接触、排液、表面融合、渗透或者包裹等步骤,主要依赖于通道的几何尺寸和各种力的作用。在直通道中,后面的液滴渗透入前面的液滴瞬间合并,如图12a所示。而在收敛通道中,后面的液滴包围住前面的液滴时有强烈的涡旋运动发生,如图12b所示。
Wang等[66]研究了十字通道交叉处液滴挤压和旋转两种状态下的液滴内部速度矢量场,并对其所受到的粘性剪应力进行分析。如图13a所示,两液滴接触处边缘的速度矢量沿着垂直方向,加之剪应力作用使液滴间相互挤压(图13b),有利于液膜排液,直至融合。图13c与13a速度矢量场完全不同,且剪应力是非对称的,液滴的移动对液膜排液并无帮助,因此液滴旋转后并未发生融合[66]。
Liu等[64]研究了30°的Y型通道中液滴在交叉处发生碰撞融合和分离融合过程的速度矢量场。研究发现,液滴前部碰撞接触处的相对剪切运动导致液滴内部涡的产生,速度最小的部分出现在液滴与通道壁面接触的位置。由于融合过程中后一个液滴对前一个液滴的挤压作用,导致前一个液滴在靠近接触区的部分速度显著增加。分离融合过程中,两液滴相对运动,由于液滴表面的突起作用发生急速融合,其中突起的相接触附近速度显著增加。
Yan等[87]将表面张力引入到纳维-斯托克斯方程(N-S方程),数值模拟研究了液滴在收敛微通道内融合的流动特性。液滴的初始速度决定了其在收敛微通道内的流动情况,并首次提出了描述收敛通道几何特性的微通道尺寸参数“Da”:
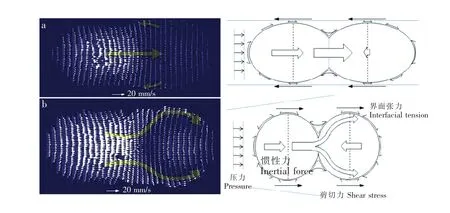
图12 微通道中(a)直通道和(b)收敛通道液滴融合瞬间的速度矢量场及各种力的作用示意图[84]Fig.12 Velocity vector and schematics of forces acting on the two droplets at the instant of coalescences in differentmicrochannels:(a)Straight channel and(b)Convergent channel[84]
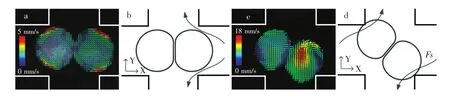
图13 不同状态下的液滴速度矢量场Fig.13 Velocity fields of droplet in two different conditions(a)液滴挤压;(b)粘性剪应力示意图;(c)液滴旋转;(d)剪应力导致液滴旋转示意图[66]。(a)Droplets squeezing;(b)Schematic diagram of the viscous shearing force;(c)Droplets rotating;(d)Schematic diagram of droplet rotation driven by shearing forces[66].
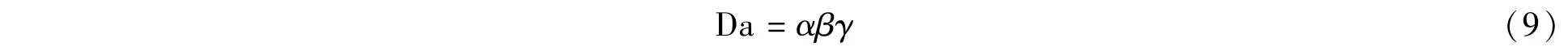
其中,α为通道两端宽度比率,β为液滴直径与间距比,γ为通道长度与液滴间距比,根据数值模拟结果归纳了不同尺寸参数Da与液滴初始速度情况下可能产生的3种融合情况,即完全融合、部分融合和不融合。研究结果表明,液滴融合位置和通道宽度比呈非线性关系,增大通道入口宽度、通道长度、液滴直径有利于促进液滴融合。
4 结论与展望
本文综述了微通道液滴基础理论及其影响因素,详细介绍了被动融合和主动融合两种微液滴融合方式的研究进展[2,8,9],阐述了液滴融合过程中的流体力学特性。目前,液滴融合技术的研究已取得了一定的进展,同时,对影响液滴融合的因素也进行了研究。然而,液滴融合技术仍面临着许多挑战:
微液滴的精确控制方面,特别是对多液滴融合的自动化控制尚存在一定的不确定性。目前研究多集中于两个液滴融合,多液滴融合技术研究较少。精确可控的多液滴融合技术将成为研究的重要方向。
目前,被动融合方式主要依靠液滴的流动特性实现融合,融合效率较低。多通道、并行化的高通量液滴融合技术将成为下一步实际应用研究的重点内容。
主动融合方式需要利用外场作用,需要外部设备并加工微电极等,增加了微流控芯片系统集成化的难度,限制了大规模集成化发展。此外,主动控制方式需要对外场工作条件进行优化调节,以实现融合并减小对生物细胞的影响,也是研究中的重要内容。
微液滴融合技术成为了生物细胞分析、多重乳液的精确控制等领域研究的新手段,其应用领域正在不断扩大,但实际应用中尚需克服许多具体难题,将继续成为未来研究的重要内容。
此外,液滴操控过程属于微尺度两相流动的研究范畴,其中的影响因素复杂、难以定量测量及控制,特别是由于微通道中液滴界面的可变形性导致的界面张力的非均匀变化和液滴的非线性问题引发的流体力学问题,尚需进行深入研究。主动融合过程中,外场作用更加复杂,尚无法进行定量化的研究,其融合机理尚不清楚。
总之,液滴控制技术已成为微流控芯片研究的一个重要发展方向[5~8],微液滴融合已成为其重要的研究内容之一[8~13]。微液滴反应器具有样品消耗少、混合速度快、通量高和反应条件稳定等优点,利用多学科交叉研究优势,可实现微液滴融合在多个领域的应用,其应用领域也在不断扩展,包括细胞和亚细胞结构分析[14~17]、蛋白质结晶[18,19]、纳米粒子的合成[20,21]和纳米分子自组装[22,23]以及高通量注射等[24,25]。深入揭示融合过程中的流体力学问题,特别是主动融合过程中外场力的影响,尚需流体力学研究者的继续努力。微液滴融理论研究尚需继续深入,为高精确的液滴控制技术提供理论指导。这一多学科交叉领域的发展,需要微电子机械学家、化学家、生物学家以及研究微流控的物理学家的努力与合作。
1 FANG Zhao-Lun.Microfluidic Chip.Beijing:Science Press,2003:23-78
方肇伦.微流控分析芯片.北京:科学出版社,2003:23-78
2 LIZhan-Hua,WU Jian-Kang,HU Guo-Qing,HU Guo-Hui.Fluid Flow in Microfluidic Chips.Beijing:Science Press, 2012:121-138
李战华,吴健康,胡国庆,胡国辉.微流控芯片中的流体流动.北京:科学出版社,2012:121-138
3 Stone H A,Stroock A D,Ajdari A.Annu.Rev.Fluid.Mech.,2004,36(1):381-411
4 LIN Bing-Cheng,QIN Jian-Hua.Graphic Laboratory on a Microfluidic Chip.Beijing:Science Press,2008:2-86
林炳承,秦建华.图解微流控芯片实验室.北京:科学出版社,2008:2-86
5 Whitesides G M.Nature,2006,442(7101):368-373
6 Joanicot M,Ajdari A.Science,2005,309(5736):887-888
7 Utada A S,Lorenceau E,Link D R,Kaplan PD,Stone H A,Weitz D A.Science,2005,308(5721):537-541
8 Charles N B,Francois G,Remi D.Lab Chip,2010,10(16):2032-2045
9 CHEN Jiu-Sheng,JIANG Jia-Huan.Chinese J.Anal.Chem.,2012,40(8):1293-1300
陈九生,蒋稼欢.分析化学,2012,40(8):1293-1300
10 ZHANG Kai,HU Ping,LIANG Qiong-Lin,LUO Guo-An.Chinese J.Anal.Chem.,2008,36(4):556-562
张凯,胡坪,梁琼麟,罗国安.分析化学,2008,36(4):556-562
11 SONGWen-Bin,DONG Chao-Qing,REN Ji-Cun.J.Anal.Sci.,2011,27(1):106-112
宋文斌,董朝青,任吉存.分析科学学报,2011,27(1):106-112
12 DENG Nan-Nan,WANG Wei,JU Xiao-Jie,XIE Rui,LIU Zhuang,CHU Liang-Yin.Scientia Sinica Chimica,2015, 45(1):7-15
邓楠楠,汪伟,巨晓洁,谢锐,刘壮,褚良银.中国科学:化学,2015,45(1):7-15
13 XIAO Zhi-Liang,ZHANG Bo.Chinese Journal ofChromatography,2011,29(10):949-956
肖志良,张博.色谱,2011,29(10):949-956
14 He M Y,Edgar JS,Jeffries G D M,Lorenz R M,Shelby JP,Chiu D T.Anal.Chem.,2005,77(6):1539-1544
15 Demirci U,Montesano G.Lab Chip,2007,7(9):1139-1145
16 Funfak A,Brosing A,Brand M,Kohler JM.Lab Chip,2007,7(9):1132-1138
17 ShiW,Qin J,Ye N,Lin B.Lab Chip,2008,8(9):1432-1435
18 Hansen C L,Classen S,Berger JM,Quake SR.J.Am.Chem.Soc.,2006,128(10):3142-3143
19 Li L,Mustafi D,Fu Q,Tereshko V,Chen D L,Tice JD,Ismagilov R F.Pro.Natl.Acad.Sci.USA,2006,103(51):19243-19248
20 Hung L H,Choi K M,TsengW Y,Tan Y C,Shea K J,Lee A P.Lab Chip,2006,62(2):174-178
21 Shestopalov I,Tice JD,Ismagilov R F.Lab Chip,2004,4(4):316-321
22 Steinbacher JL,Moy RW Y,Price K E,Cummings M A,Roychowdhury C,Buffy JJ,OlbrichtW L,HaafM,McQuade D T.J.Am.Chem.Soc.,2006,128(29):9442-9447
23 Schabas G,Wang CW,Oskooei A,Yusuf H,Moffitt M G,Sinton D.Langmuir,2008,24(19):10596-10603
24 Niu X,Gielen F,Edel JB,deMello A J.Nat.Chem.,2011,3(6):437-442
25 Brouzes E,Medkova M,Savenelli N,Marran D,Twardowski M,Hutchison JB,Rothberg JM,Link D R,Perrimon N, Samuels M L.Proc.Natl.Acad.Sci.USA,2009,106(34),14195-14200
26 CHEN Xiao-Dong,HU Guo-Qing.Advances in Mechanics,2015,45:201503
陈晓东,胡国庆.力学进展,2015,45:201503
27 Simon M G,Lee A P.Microdroplet Technology.New York:Springer,2012:23-50
28 ZagnoniM,Cooper JM.Lab Chip,2009,9(18):2652-2658
29 García A A,Egatz-Gómez A,Lindsay SA,Dominguez-Garcia P,Melle S.J.Magn.Magn.Mater.,2007,311(1):238-243
30 Köhler JM,Henkel T,Grodrian A,Kirner T,Roth M,Martin K,Metze J.Chem.Eng.J.,2004,101(1-3):201-216
31 Lin SC S,Mao X,Huang T J.Lab Chip,2012,12(16):2766-2770
32 ZHANG Yue,GAO Ting,HU Chu,HUANG Chang,YU Yi-Qing,ZHANG An-Liang.Piezoelectrics&Acoustooptics, 2012,34(5):676-679
张悦,高挺,胡楚,黄昶,尉一卿,章安良.压电与声光,2012,34(5):676-679
33 Baroud C N,de Saint Vincent M R,Delville JP.Lab Chip,2007,7(8):1029-1033
34 DONG Li-Chun,WU Ji-Zhou,REN Gui-Xiang,TAN Shi-Yu,HUANG Da-Fu,LIWen-Ping,HUANG Shao-Jian.Journal ofChongqing University,2011,34(1):134-139
董立春,吴纪周,任桂香,谭世语,黄大富,李文平,黄少建.重庆大学学报,2011,34(1):134-139
35 Wu P,Luo Z F,Liu Z F,Li ZD,Chen C,Feng L L,He LQ.Chinese J.Chem.Eng.,2015,23(1):7-14
36 WANG Jia-Nan,WANG Jia-Jun,FENG Lian-Fang,GU Xue-Ping.J.Chem.Eng.Chin.Univ.,2014,28(2):218-222
王佳男,王嘉骏,冯连芳,顾雪萍.高校化学工程学报,2014,28(2):218-222
37 Baret JC.Lab Chip,2012,12(3):422-433
38 Dai B,Leal L.Phys.Fluids,2008,20(4):1569-1579
39 Gunes D Z,Clain X,Breton O,Mayor G,Burbidge A S.J.Colloid Interface Sci.,2010,343(1):79-86
40 Chesters A K.Chem.Eng.Res.Des.,1991,69(4):259-270
41 Christopher G F,Bergstein J,End N B,Poon M,Nguyen C,Anna S L.Lab Chip,2009,9:1102-1109
42 Borrell M,Yoon Y,Leal L G.Phys.Fluids,2004,16(11):3945-3954
43 Klaseboer E,Chevaillier JP,Gourdon C,Masbernaty O.J.Colloid Interface Sci.,2000,229(1):472-485
44 Hu Y T,Pine D J,Leal L G.Phys.Fluids,2000,12(3):484-489
45 Baldessari F,Homsy G M,Leal LG.J.Colloid Interface Sci.,2007,307(1):188-202
46 Yang H,Park C C,Hu Y T,Leal L G.Phys.Fluids,2001,13(5):1087-1106
47 Yoon Y,Borrell M,Park C C,Leal L G.J.Fluid Mech.,2005,525(2):355-379
48 Baldessari F,Leal L G.Phys.Fluids,2006,18(1):302-309
49 Rother M A,Davis R H.Phys.Fluids,2001,13(5):1178-1190
50 Li SZ,Chen R,Wang H,Liao Q,Zhu X,Wang Z B.Appl.Therm.Eng.,2014,64(1-2):129-138
51 Burkhart B E,Gopalkrishnan P V,Hudson S D,Jamieson A M,Rother M A,Davis R H.Phys.Rev.Lett.,2001, 87(9):098304
52 Guido S,Simeone M.J.Fluid Mech.,1998,357(2):1-20
53 Aryafar H,Kavehpour H P.Phys.Fluids,2006,18(7):3453-3475
54 Mohamed-Kassim Z,Longmire E K.Phys.Fluids,2003,15(11):3263-3273
55 Xu B,Nguyen N T,Wong TN.Micro and Nanosystems,2011,3:131-136
56 Tan Y C,Fisher JS,Lee A L,Cristini V,Lee A P.Lab Chip,2004,4(4):292-298
57 Gunes D Z,Bercy M,Watzke B,Breton O,Burbidge A S.Soft Matter,2013,9(31):7526-7537
58 Tan Y C,Ho Y L,Lee A P.Microfluid.Nanofluid.,2007,3(4):495-499
59 Niu X,Gulati S,Edel JB,Demello A J.Lab Chip,2008,8(11):1837-1841
60 Liu K,Ding H J,Chen Y,Zhao X Z.Microfluid.Nanofluid.,2007,3(2):239-243
61 Bremond N,Thiam A R,Bibette J.Phys.Rev.Lett.,2008,100(2):024501
62 Lai A,Bremond N,Stone H A.J.Fluid Mech.,2009,632(10):97-107
63 Yang L,Wang K,Tan J,Lu Y C,Luo G S.Microfluid.Nanofluid.,2012,12(5):715-722
64 Liu ZM,Cao R T,Pang Y,Shen F.Exp.Fluids,2015,56(2):1-4
65 Wang K,Lu Y,Yang L,Luo G S.AICHE Journal,2013,59(2):643-649
66 Wang K,Lu Y,Tostado C P,Yang L,Luo G S.Chem.Eng.J.,2013,227(7):90-96
67 Mazutis L,Griffiths A D.Lab Chip,2012,12(10):1800-1806
68 Deng N N,Sun SX,Wang W,Ju X J,Xie R,Chu L.Lab Chip,2013,13(18):3653-3657
69 Mazutis L,Baret JC,Griffiths A D.Lab Chip,2009,9(18):2665-2672
70 Fryd M M,Mason TG.SoftMatter,2014,10(26):4662-4673
71 Liu K,Qin J.Nanotechnology,2013,24(12):1079-1094
72 Tullis J,Park C L,Abbyad P.Lab Chip,2014,14(17):3285-3289
73 Sarrazin F,Prat L,Miceli N D,Cristobal G,Link D R,Weitz D A.Chem.Eng.Sci.,2007,62(4):1042-1048
74 WangW.Lab Chip,2009,9(11):1504-1506
75 Hao G,Duits M H G,Mugele F.Int.J.Mol.Sci.,2011,12(4):2572-2597
76 Schoeman R M,Kemna EW M,Wolbers F,Albert V D B.Electrophoresis,2014,35(2-3):385-392
77 ZHANG An-Liang,XIA Xing-Hua.Chinese J.Anal.Chem.,2011,39(5):765-769
章安良,夏兴华.分析化学,2011,39(5):765-769
78 Fu X T,Zha Y,Zhang A L.TELKOMNIKA,2013,11(7):3767-3773
79 Sesen M,Alan T,Neild A.Lab Chip,2014,14(17):3325-3333
80 Luong T D,Nguyen N T,Sposito A.Appl.Phys.Lett.,2012,100(25):254105
81 Xu B,Nguyen N T,Wong T N.Biomicrofluidics,2012,6(1):263-268
82 Peng C H,Nguyen N T.Phys.Fluids,2013,25(8):840-840
83 Kotz K T,Gu Y,Gw.F.J.Am.Chem.Soc.,2005,127(16):5736-5737
84 Lorenz R M,Edgar JS,Jeffries G D M,Zhao Y,McGloin D,Chiu D T.Anal.Chem.,2007,79(1):224-228
85 Jin H J,Lee K H,Destgeer G,Kang S L,Cho H,Ha B H,Sung H J.Microfluid.Nanofluid.,2014,18(11):1522-1529
86 Jin B J,Yoo JY.Exp.Fluids,2012,52(1):235-245
87 Yan Y,Guo D,Luo J,Wen S.Biochip Journal,2013,7(4):325-334
(Received 22 June 2015;accepted 16 August2015)
This work was supported by the Natural Science Foundation of Beijing,China(No.7152012)
Advances in M icro-Droplets Coalescence Using M icrofluidics
SHEN Feng1,2,LIYi1,LIU Zhao-Miao*1,CAO Ren-Tuo1,WANG Gui-Ren21(College ofMechanical Engineering and Applied Electronics Technology, Beijing University of Technology,Beijing 100124,China)
2(Department ofMechanical Engineering&Biomedical Engineering Program, University ofSouth Carolina,Columbia,SC,29208,USA)
Recently,with the development of lab-on-a-chip researches,the use ofmicrofluidics to precisely control the droplet behavior in microchannel has received more and more research attention.This article introduces the basic theory and mechanism of the droplets coalescence,and then carefully reviews the passive methods of droplets coalescence used in current researches by changing microchannel geometry and adding surfactants.The active methods to trigger droplet fusion such as applied electric field,magnetic fields, temperature gradients,surface acoustic wave and focused lasers are also introduced briefly.We also introduce the fluid dynamics of the droplets coalescence and forecast its progress at last to provide useful guidance for microfluidic devices design and wide use of the drop-based microfluidics.
Microfluidics;Droplets coalescence;Microchannel;Lab-on-a-chip;Review
10.11895/j.issn.0253-3820.100509
2015-06-22收稿;2015-08-16接受
本文系北京市自然科学基金(No.7152012)、国家留学基金(No.201406545031)及北京工业大学“日新人才”培养计划项目(No.2015-RX-L02)资助

