慢病毒介导的shRNA靶向干扰I2PP2A胃癌稳定细胞株的建立
师海蓉,陈莹,李长雷,邱文洪
1.江汉大学医学院病理学与病理生理学教研室,湖北 武汉 430056;
2.江汉大学医学院免疫学教研室,湖北 武汉 430056;
3.江汉大学医学院实验动物中心,湖北 武汉 430056
慢病毒介导的shRNA靶向干扰I2PP2A胃癌稳定细胞株的建立
师海蓉1,陈莹1,李长雷2,邱文洪3
1.江汉大学医学院病理学与病理生理学教研室,湖北 武汉 430056;
2.江汉大学医学院免疫学教研室,湖北 武汉 430056;
3.江汉大学医学院实验动物中心,湖北 武汉 430056
背景与目的:蛋白磷酸酶2A抑制剂-2(inhibitor 2 of protein phosphatase 2A,I2PP2A)在包括胃癌的多种肿瘤中过度表达,提示其可能在胃癌的发生中发挥重要作用。为进一步探讨I2PP2A的功能及其在胃癌发生中的作用,建立稳定抑制I2PP2A基因表达的人胃癌BGC823细胞株。方法:筛选出I2PP2A基因的RNA干扰(RNA interference,RNAi)有效靶序列,合成靶序列的Oligo DNA并构建pGLV2-shRNA-I2PP2A慢病毒载体,酶切和测序鉴定正确后,经病毒包装,感染BGC823细胞,经嘌呤霉素筛选稳定表达细胞株,通过实时定量PCR(real-time PCR,RT-PCR)和蛋白[质]印迹法(Western blot)鉴定I2PP2A的表达。结果:重组慢病毒质粒经测序鉴定正确;RT-PCR和Western blot证实干扰I2PP2A后,BGC823细胞株中I2PP2A表达水平明显降低,抑制率约为90%。结论:成功构建了I2PP2A shRNA慢病毒表达载体,建立了稳定抑制I2PP2A基因表达的人胃癌BGC823细胞株,为进一步研究I2PP2A在胃癌发生中的作用提供了可靠的细胞模型。
蛋白磷酸酶2A抑制剂-2;胃癌;慢病毒;稳定细胞株
蛋白磷酸酶2A抑制剂-2(inhibitor 2 of protein phosphatase 2A,I2PP2A),又称SET基因[1]、模板活化因子-1(template activating factor 1β,TAF1β)[2]等。已有研究表明I2PP2A广泛表达于人类不同组织和细胞系,其表达异常与多种疾病相关。对胃癌组织mRNA进行I2PP2A cDNA表达分析发现,肿瘤组织中I2PP2A表达是相应正常组织的2倍或更高[3]。在SETCAN转基因小鼠中伴随有胃黏膜的自发增生与β-catenin的过表达[4]。本实验室前期研究也发现,人胃癌组织中有I2PP2A的表达,且其表达水平明显高于癌旁黏膜及正常组织,提示I2PP2A蛋白在胃癌的发生、发展中具有重要的作用。为了探讨I2PP2A在胃癌的发生及发展中的作用,本实验通过构建干扰I2PP2A的慢病毒重组质粒,建立稳定靶向干扰I2PP2A表达的胃癌细胞株,为研究I2PP2A在胃癌发生中的作用提供了可靠的细胞模型。
1 材料和方法
1.1 材料
为了衡量算法的检测精度,定义均方根误差(Root Mean Square Error,RMSE),其数学表达式如下:
大肠杆菌DH5α、HEK293T细胞和人胃癌细胞BGC823均为本室保存。引物由上海吉玛制药技术有限公司合成。Pfu DNA polymerase购自生工生物工程(上海)股份有限公司。实验中使用到的DNA内切酶、DNA连接酶和DNA marker均购自加拿大MBI Fermentas公司。PCR产物纯化试剂盒、DNA片段纯化回收试剂盒及质粒抽提试剂盒购自德国Qiagen公司;慢病毒表达系统由上海吉玛制药技术有限公司提供;DMEM培养基、胎牛血清和胰蛋白酶购自美国Gibco公司;嘌呤霉素购自美国Sigma公司;兔多克隆抗体I2PP2A以及辣根过氧化物酶标记的羊抗兔IgG购自美国Santa Cruz公司,鼠单克隆抗体GAPDH购自武汉博士德生物工程有限公司。用于蛋白[质]印迹法(Western blot)检测的增强化学发光试剂ECL和BCA蛋白定量试剂盒购自美国Pierce公司。PVDF转印膜购自美国Millipore公司。
1.2 方法
1.2.1 shRNA序列的设计及合成
为进一步确定稳定筛选是否成功,取各组生长状态良好的细胞提取总蛋白做Western blot分析与鉴定,结果显示,与BGC823组相比,pGLV2-shRNA-I2PP2A的I2PP2A的表达明显减少(P<0.01),而pGLV2-shRNA.NC的I2PP2A表达未见下降。表明稳定表达siRNA-I2PP2A细胞构建成功。为进一步确定稳定细胞株构建成功,细胞传至50代再次进行鉴定,抑制效果仍非常显著(图3)。说明细胞株内I2PP2A的表达得到了稳定抑制,成功的建立了I2PP2A表达稳定抑制的胃癌细胞株。
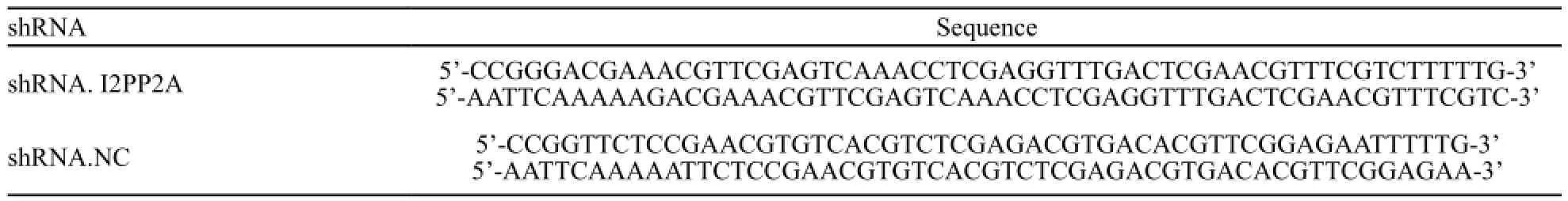
表1 shRNA干扰序列Tab. 1 Sequence of shRNA oligonucleotide
1.2.2 重组慢病毒质粒的构建和鉴定
1.2.5 实时定量PCR(real-time PCR,RT-PCR)检测I2PP2A mRNA的表达
分别溶解正义和反义单链shRNA模板,取等量模板寡核苷酸及10×DNA退火缓冲液,混匀后按照如下程序进行退火处理:95 ℃ 5 min;85 ℃ 5 min;75 ℃ 5 min;70 ℃ 5 min;得到浓度为10 μmol/L的shRNA模板。取pGLV2载体,经AgeI和EcoRI双酶切,并回收,将退火后的双链shRNA模板与线性化的载体于22 ℃连接1 h,转化JM 109感受态细胞,涂布于含Amp的LB平板上,37 ℃培养过夜;挑取单克隆菌落,接种于含Amp的LB培养液中,37 ℃培养过夜;收集菌液,抽提重组质粒测序鉴定(由上海英骏生物技术有限公司完成),测序正确的质粒命名为pGLV2-shRNA-I2PP2A及阴性对照质粒pGLV2-shRNA.NC。
1.2.3 慢病毒的制备及病毒滴度测定
1.2.7 CCK-8检测稳定表达细胞增殖
柏林的博物馆好看,柏林的咖喱香肠好吃,但如果你问我在柏林漫游时,对哪里印象最深刻,我一定会回答:街头形形色色的柏林熊!它们或呆萌,或文艺,或指明道路,或表示欢迎。这些花花绿绿、憨态可掬的“大块头”经过艺术家鬼斧神工的改造,幻化为个性鲜明的城市文化符号。从2002年开始,它们走出德国,开启“联合熊熊展”的世界环游之旅。很多国家都拥有一头代表自己国家的“柏林熊”,可爱的大熊们手牵着手,向世界呼喊着:“和平,和平!”
2.4 Western blot鉴定I2PP2A的表达
1.2.4 慢病毒感染及稳定表达细胞株筛选
以此证明,如果我们把后进生看作是未经雕琢的璞玉,那么老师的责任就是把它挖掘出来,琢去那些掩盖着它原来光辉的杂质,使它重放光芒。
该地铁区间隧道覆土厚16.15 m,产生沉降的隧道区域及联络通道底部土质为④3淤泥质粉质黏土层。隧道下部为软卧层,厚 8 m;软卧层含水量较高,为45.7%;压缩模量非常低,为2.48;标贯击数仅为1.6。该土层土质蠕变性非常敏感,且自身强度非常低,周边施工对土体扰动以及对隧道沉降与收敛影响非常明显。
收集细胞,以T R I z o l试剂提取细胞总RNA,紫外分光光度计定量RNA,琼脂糖凝胶电泳验证R N A完整性。以基因特异性引物进行PCR扩增,以GAPDH作为内参。I2PP2A引物序列:上游引物为5’-CAGAAGAGGTCAGAATTGATCGC-3’,下游引物为5’-TGGTTGACAAATGTTGTT ACCCA-3’,扩增片段长度为62 bp。GAPDH引物序列:上游引物为5’-CATGAGAAGTATGAC A A C A G C C T-3’,下游引物为5’-AGTCCTTCCACGATACCAAAGT-3’,扩增片段长度为113 bp。PCR扩增产物电泳结果显示,PCR产物大小正确,无杂带说明无非特异性扩增。实验重复3次。组间的表达差异通过计算2-ΔΔCt予以表示。反应条件:95 ℃变性3 min;95 ℃ 12 s,62 ℃ 40 s,共40个循环。实验重复3次。I2PP2A表达抑制率(%)=(1-转染组I2PP2A相对表达量/对照组I2PP2A相对表达量)×100%。用同样的方法分别测定第50代子细胞系对I2PP2A的抑制率,检测细胞传代对shRNA抑制力的影响。
1.2.6 Western blot检测I2PP2A蛋白的表达
培养的稳定表达细胞株至第10代,收集细胞提取总蛋白,进行SDS-PAGE电泳,电泳后湿转至PVDF膜,含5%脱脂奶粉的TBS-T(含0.05% Tween-20的TBS)37 ℃封闭60 min,加1∶1 000稀释的抗I2PP2A蛋白的多克隆抗体4 ℃温育过夜。TBS-T漂洗5 min×3次,加入1∶2 000稀释的辣根过氧化物酶标记的羊抗兔IgG 37 ℃温育45 min。TBS-T漂洗5 min×3次,ECL化学发光试剂检测。图像应用Gel-Pro Analyzer软件进行灰度分析。
将状态良好、处于对数生长期的293T细胞接种于10 cm细胞培养皿(约5×l06个细胞),培养过夜后,将重组质粒pGLV2-shRNA-I2PP2A及阴性对照质粒各4 μg,在LipofectamineTM2000介导下与包装质粒共转染293T细胞,具体操作按试剂说明书进行。转染后1 d,更换10 mL含10%血清DMEM培养液。置于37 ℃、CO2体积分数为5%的饱和湿度培养箱中继续培养;分别在转染后48和72 h后,收集细胞培养上清液进行浓缩,用0.45 μm孔径的滤器(Millipore公司产品)过滤,收集滤液,50 000×g离心提纯获得病毒纯化液1 mL,分装5管,每管200 μL,于-80 ℃冰箱中冻存备用。因包装所用病毒pGLV2-U6-puro不带GFP不便直接观察,实验选用pGLV2-U6-GFP病毒同时包装作参照,以判定病毒的包装滴度及目的细胞的侵染效率。
取生长状态良好的胃癌细胞,按5×103个/孔的细胞浓度接种于96孔板,每组重复5次。分别培养1、2、3、4 d,除去培养液,加入新鲜的培养基100 μL,每孔避光加入10 μL CCK-8,避光培养2 h,检测450 nm的吸光度(D450)值。
1.3 统计学处理
采用SPSS 13.0统计软件进行方差分析、t检验。P<0.05为差异有统计学意义。
随着经济全球化和文化多元化的不断深入,为推动区域性合作与全球性发展,在多种语言交织下达成共识,翻译行业发展迅猛。各国对翻译服务也出台了一系列的标准文件,希望通过统一标准对译文质量进行有效的控制。然而,相对国外比较健全的翻译质量管理体系,国内翻译市场准入门槛较低,屡现压价等恶性竞争,整个行业不够规范,翻译专业的课程设置远不能满足市场对人才的实际需求,这些问题都给翻译产出的质量带来了极大的挑战。
2 结 果
2.1 重组慢病毒质粒的鉴定
浅表层的危岩清理,采用人工配合风镐、撬棍、钢钎进行,施工作业前拴好安全绳,安全绳拴于稳定的树桩上或插筋上,清理时按4~6人为1作业小组,1人负责安全监护,其余人员用风镐、撬棍和钢钎进行清撬,多组平行错距作业,表层的危岩清撬完成后,及时请地质工程师及相关工程人员现场判定确认处理效果,明确是否继续进行清撬施工,如图2所示。
重组慢病毒质粒pGLV2-shRNA-I2PP2A经测序鉴定证实,插入的基因序列与设计的序列完全一致,无碱基突变(图1),表明慢病毒质粒构建成功。
2.2 稳定表达细胞株的筛选
病毒感染BGC823细胞24 h后,用不含病毒上清液的正常培养基培养细胞,待细胞培养至80%~90%融合时,加入致死浓度摸索试验中的嘌呤霉素最佳药物浓度(0.4 μg/mL),同时设立空白对照组。维持嘌呤霉素浓度,隔天换液,观察。经过3个嘌呤霉素筛选周期后,感染重组病毒组阳性细胞存活,而未感染病毒的野生BGC823细胞组细胞几乎全部死亡。至空白组细胞全部被杀死后(大约1周),收集存活的细胞并扩增培养建立稳定表达的pGLV2-shRNAI2PP2A及阴性对照质粒pGLV2-shRNA.NC细胞系(图2)。
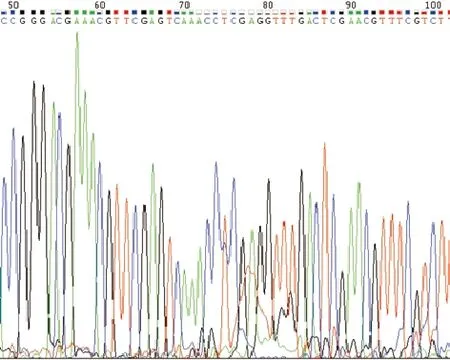
图1 重组慢病毒质粒的测序图谱Fig. 1 Sequencing of recombinant lentivirus plasmid

图2 嘌呤霉素筛选后各孔存活情况Fig. 2 Cells survival after puromycin selection
2.3 各组细胞中I2PP2A mRNA的转录水平
取各组生长状态良好的细胞提取RNA,用RT-PCR检测各组细胞I2PP2A的表达水平。结果显示,与BGC823和pGLV2-shRNA-NC两组相比,pGLV2-shRNA-I2PP2A的I2PP2A mRNA表达显著降低(P<0.01),而pGLV2-shRNA.NC中I2PP2A mRNA的表达与BGC823细胞相比,差异无统计学意义(P>0.05,表2)。表明经慢病毒介导的RNA干扰(RNA interference,RNAi)作用后,BGC823细胞I2PP2A基因mRNA的转录水平明显降低,抑制率为93%。细胞传至50代再次鉴定,I2PP2A的mRNA抑制率为91%,可见细胞传代对shRNA抑制力的影响差异无统计学意义(P>0.05)。
慢病毒侵染效率检测表明当慢病毒的滴度达到1×108TU/mL时,慢病毒侵染BGC823细胞的效率分别可达到75%。分别用阳性重组病毒和对照重组病毒以此滴度感染提前1 d接种于6孔细胞培养板中的BGC823细胞(1.5×106个细胞/孔),同时加入终浓度为5 μg/mL的聚凝胺。24 h后,用不含病毒上清的正常培养基培养细胞,待细胞培养至80%~90%融合时,加入致死浓度摸索试验中的嘌呤霉素最佳药物浓度(0.4 μg/mL),同时设立空白对照组。维持嘌呤霉素浓度,隔天换液,观察。至空白组细胞全部被杀死后(大约1周),收集存活的细胞并扩增培养建立稳定表达的pGLV2-shRNA-I2PP2A及阴性对照质粒pGLV2-shRNA.NC细胞系。
采用逐孔稀释法在293T细胞中测定病毒滴度。测定前1 d,将滴度测定所需的293T细胞接种于96孔板,每孔加3×104个细胞,用含10%FBS的DMEM培养基培养,体积为100 μL。将慢病毒原液10 μL,用10%FBS的DMEM培养基10倍稀释3个梯度(1∶10、1∶100、1∶1 000)后感染293T细胞,24 h后换液,72 h荧光显微镜观察荧光并统计表达GFP的细胞数目,计算病毒滴度。病毒滴度计算公式:病毒滴度(TU/mL)=带荧光的细胞数目/稀释的浓度梯度×103。
根据前期实验结果确定的有效靶序列,按如下结构设计:pGLV2-shRNA模板中的loop结构选用了CTCGAG以避免形成终止信号。正义链模板的5’端添加了CCGG,与AgeI酶切后形成的黏端互补;反义链模板的5’端添加了AATT,与EcoRI酶切后形成的黏端互补。按同样方法设计l条阴性对照(shRNA.NC)序列(表1)。
老姆登村位于怒江东岸的碧罗雪山,海拔从1300米至2300米,6个自然村,12个村民小组。全村有317户,1168人。村子海拔2000米以上为人工防护林及原始森林。种植业与林副业相结合,种植业尤为发达。目前村里正在实施一户一宅的政策,村民们不能建新房,也不能加盖房屋,因此限制了旅游发展。国家公园的建设将会对当地的旅游业发展带来机遇,但游客的到来也会破坏杜鹃林,因此,村委会制定了保护七莲湖的规定,包括禁止乱砍乱伐,呼吁导游带游客到七莲湖时自带煤炭来解决生活用火,并要求村民加强监督。
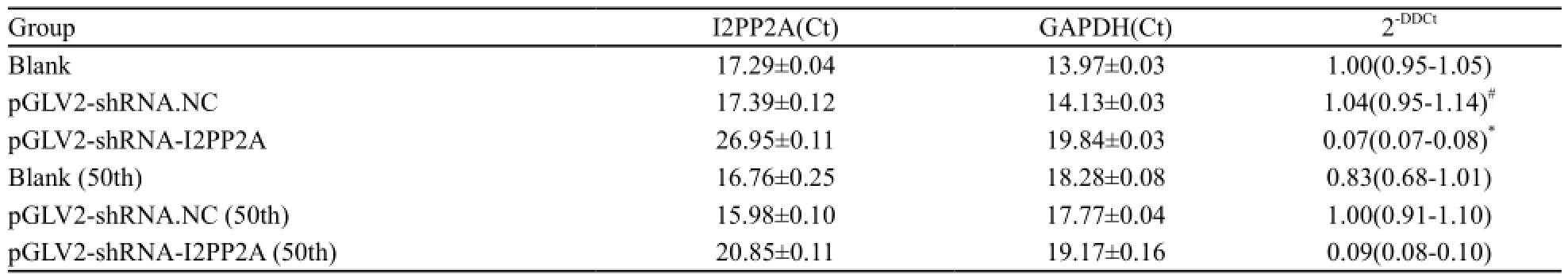
表2 各组细胞I2PP2A mRNA的转录水平Tab. 2 Transcription levels of I2PP2A mRNA in various groups

图3 Western blot检测I2PP2A蛋白的表达Fig. 3 I2PP2A protein detected by Western blot
2.5 CCK-8法检测稳定表达细胞株的增殖
增殖实验结果显示,I2PP2A稳定抑制后对细胞的增殖在24 h即出现明显抑制。与对照组相比,稳定表达细胞对增殖的抑制在1~4 d差异均有统计学意义(P<0.01)。由此可以看出,降低I2PP2A的表达水平可有效抑制胃癌细胞BGC823的增殖能力(图4)。
中国虽然已成为世界上第二大经济体,但在金融业发展水平上未能进入世界第一效率阵营,在金融服务及金融监管上仍需要向世界先进水平看齐。
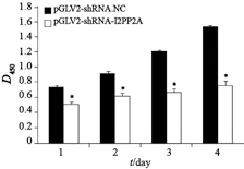
图4 CCK-8法检测稳定表达细胞增殖抑制作用Fig. 4 The proliferation of stable transfection cell lines tested by CCK-8 assay
3 讨 论
大量的研究表明I2PP2A广泛表达于人类不同组织和细胞系,具有高度保守的结构特征和进化机制,提示I2PP2A蛋白具有重要的功能,与多种生物活动相关,如细胞周期调控[5]、细胞凋亡[6-8]、迁移[9-10]和DNA损伤修复[11]及氧化应激[12]等多个生物过程,是重要的细胞因子,且I2PP2A的异常表达可能与胃癌的发生、发展密切相关[3-4]。本实验室前期研究也发现,人胃癌组织中I2PP2A的表达水平明显高于癌旁黏膜及正常组织,且I2PP2A在胃癌细胞株BGC823和SGC7901中均有很好的表达,与细胞的侵袭能力成正相关,提示I2PP2A蛋白在胃癌的发生、发展中可能具有重要的作用。目前研究认为I2PP2A可通过抑制肿瘤抑制因子蛋白磷酸酶2A(protein phosphatase 2A,PP2A)[13-14]和转移抑制因子nm23-H1[15]两条通路参与肿瘤的发生、发展。PP2A被认为是潜在的肿瘤抑制因子和治疗靶标[16-18],主要通过下调在肿瘤中异常表达的Akt、β-catenin和c-myc来发挥其抑癌作用[19-21]。因此,下调在胃癌中过表达的I2PP2A可作为一个潜在的肿瘤治疗的靶点。
畔湖镇伴湖,像截旧裤脚丢在洞庭湖边。那条青石板路终日里湿漉漉的,洒满鱼腥味。两排旧木板房歪歪斜斜,瓦脊上这里那里粘着干枯的青苔藓。街虽古旧,却因船码头仗势,人气挺旺。终日里肩担穿插,人流不断。镇政府坐落在地势较高的街北头,那里从前是救捞局的地盘,有一幢气派的古建筑。后来拆了建了办公楼。
RNAi能特异性抑制靶基因的表达,具有高特异性、高效性、高稳定性、可传播性和可遗传性等特点[22],已成为基因功能、人类疾病模型及基因治疗研究的常用技术[23-24]。siRNA转染技术的关键在于转染效率的高低,而慢病毒载体[25-26]不仅转导效率较高,还可以将外源基因或外源的shRNA有效地整合到靶细胞基因组中,是目前常用的有效实现目的基因或目的shRNA的长期、稳定表达的理想载体。本研究采用的慢病毒表达载体是以国际通用的第3代载体系统为基础,通过一定的改建,构成的4质粒体系。其中,转移载体包含转移目的基因的慢病毒骨架及其包装产生相应基因组RNA的所有顺式作用元件,并且可以单一或多重组合的稳定或条件诱导性表达转移基因或shRNA;另外,通过3个辅助质粒(pGag/Pol、pRev和pVSV-G),提供病毒包装所需的反式作用因子,同时采用“自我灭活”修饰,阻止子代病毒自我复制和转移,从而确保产生的慢病毒具备良好的生物安全性。与MuLV等逆转录病毒载体相比,慢病毒载体的整合更偏向于宿主细胞基因组的基因表达活跃区,激活沉默的原癌基因的概率可能比逆转录病毒载体低且U6启动子能在宿主细胞中指导siRNA持续表达。同时本实验中所用载体系统带有抗嘌呤霉素的抗性基因,可据此对侵染细胞进行筛选,可为方便有效获得稳定表达细胞株提供实验基础。
RT-PCR和Western blot检测稳定表达细胞株的I2PP2A mRNA和蛋白的表达水平,发现对I2PP2A的抑制率约为90%,并且实验结果也显示,在20、30和50代中,筛选出的稳定表达株仍具有较高的抑制效果。以上结果表明针对靶基因的特异RNAi慢病毒感染后获得了明显的干扰效果,证实了我们构建的RNAi慢病毒能在人胃癌细胞BGC823内能够高效、特异、稳定的对I2PP2A基因产生抑制作用。
稳定沉默I2PP2A的BGC823细胞系的获得为更深入的研究I2PP2A在胃癌中的调控作用及机制提供了可靠的体外细胞模型,为研究I2PP2A蛋白生物学功能的分子机制提供了有力工具。
[1] VON LINDERN M, VAN BAAL S, WIEGANT J, et al. Can, a putative oncogene associated with myeloid leukemogenesis, may be activated by fusion of its 3' half to different genes: characterization of the set gene [J]. Mol Cell Biol, 1992, 12: 3346-3355.
[2] NAGATA K, KAWASE H, HANDA H, et al. Replication factor encoded by a putative oncogene, set, associated with myeloid leukemogenesis [J]. Proc Natl Acad Sci U S A, 1995, 92: 4279-4283.
[3] CERVONI N, DETICH N, SEO S B, et al. The oncoprotein Set/ TAF-1beta, an inhibitor of histone acetyltransferase, inhibits active demethylation of DNA, integrating DNA methylation and transcriptional silencing [J]. J Biol Chem, 2002, 277(28): 25026-25031.
[4] OZBEK U, KANDILCI A, VAN BAAL S, et al. SET-CAN, the Product of the t(9;9) in acute undifferentiated leukemia, causes expansion of early hematopoietic progenitors and hyperproliferation of stomach mucosa in transgenic mice[J]. Am J Pathol, 2007, 171: 654-666.
[5] CANELA N, RODRIGUEZ-VILARRUPLA A, ESTANYOL J M, et al. The SET protein regulates G2/M transition by modulating cyclin B-cyclin-dependent kinase 1 activity[J]. J Biol Chem, 2003, 278(2): 1158-1164.
[6] MADEIRA A, POMMET J M, PROCHIANTZ A, et al. SET protein (TAF1beta, I2PP2A) is involved in neuronal apoptosis induced by an amyloid precursor protein cytoplasmic subdomain [J]. FASEB J, 2005, 19(13): 1905-1907.
[7] CHRISTENSEN D J, CHEN Y, ODDO J, et al. SET oncoprotein overexpression in B-cell chronic lymphocytic leukemia and non-Hodgkin lymphoma: a predictor of aggressive disease and a new treatment target [J]. Blood, 2011, 118(15): 4150-4158.
[8] SADDOUGHI S A, GENCER S, PETERSON Y K, et al. Sphingosine analogue drug FTY720 targets I2PP2A/SET and mediates lung tumour suppression via activation of PP2ARIPK1-dependent necroptosis [J]. EMBO Mol Med, 2013, 5(1): 105-121.
[9] TEN KLOOSTER J P, LEEUWEN I, SCHERES N, et al. Rac1-induced cell migration requires membrane recruitment of the nuclear oncogene SET [J]. EMBO J, 2007, 26(2): 336-345.
[10] LAM B D, ANTHONY E C, HORDIJK P L. Cytoplasmic targeting of the protooncogene SET promotes cell spreading and migration [J]. FEBS Lett, 2013, 587(2): 111-119.
[11] ALMEIDA L O, GOTO R N, PESTANA C R, et al. SET overexpression decreases cell detoxification efficiency: ALDH2 and GSTP1 are downregulated, DDR is impaired and DNA damage accumulates [J]. FEBS J, 2012, 279(24): 4615-4628.
[12] SOBRAL L M, SOUSA L O, COLETTA R D, et al. Stable SET knockdown in head and neck squamous cell carcinoma promotes cell invasion and the mesenchymal-like phenotype in vitro, as well as necrosis, cisplatin sensitivity and lymph node metastasis in xenograft tumor models [J]. Mol Cancer, 2014, 13: 32.
[13] LI M, GUO H, DAMUNI Z. Purification and characterization of two potent heat-stable protein inhibitors of protein phosphatase 2A from bovine kidney [J]. Biochemistry, 1995, 34: 1988-1996.
[14] LI M, MAKKINJE A, DAMUNI Z. The myeloid leukemiaassociated protein SET is a potent inhibitor of protein phosphatase 2A [J]. J Biol Chem, 1996, 271(19): 11059-11062.
[15] FAN Z, BERESFORD P J, OH D Y, et al. Tumor suppressor NM23-H1 is a granzyme A-activated DNase during C TL-mediated apoptosis, and the nucleosome assembly protein SET is its inhibitor [J]. Cell, 2003, 112(5): 659-672.
[16] MUMBY M. PP2A: unveiling a reluctant tumor suppressor[J]. Cell, 2007, 130: 21-24.
[17] JANSSENS V, JANSSENS V, GORIS J, et al. PP2A: the expected tumor suppressor [J]. Curr Opin Genet Dev, 2005, 15: 34-41.
[18] JUNTTILA M R, PUUSTINEN P, NIEMELÄ M, et al. CIP2A inhibits PP2A in human malignancies [J]. Cell, 2007, 130: 51-62.
[19] ARNOLD H, SEARS R. A tumor suppressor role for PP2AB56α through negative regulation of c-Myc and other key oncoproteins [J]. Cancer Metastasis Rev, 2008, 27: 147-158.
[20] GOTZ J, PROBST A, MISTL C, et al. Distinct role of protein phosphatase 2A subunit Calpha in the regulation of E-cadherin and beta-catenin during development [J]. Mech Dev, 2000, 93: 83-93.
[21] RESJO S, GORANSSON O, HARNDAHL L, et al. Protein phosphatase 2A is the main phosphatase involved in theregulation of protein kinase B in rat adipocytes [J]. Cell Signal, 2002, 14: 231-238.
[22] 王海伦. RNAi及其在肿瘤生物学研究中的应用[J]. 湖南省环境生物职业技术学院学报, 2011, 17: 20-23.
[23] HANNON G J. RNA interference [J]. Nature, 2002, 418: 244-251.
[24] WIZNEROWICZ M, SZULC J, TRONO D. Tuning silence: conditional systems for RNA interference [J]. Nat Methods, 2006, 3: 682-688.
[25] SAKUMA T, BARRY M A, IKEDA Y. Lentiviral vectors: basic to translational [J]. Biochem J, 2012, 443(3): 603-618.
[26] 刘晓军, 王娜, 姚旭东, 等. 前列腺特异抗原3慢病毒表达载体的构建与包装[J]. 中国癌症杂志, 2013, 23(11): 857-862.
Establishment of a stable gastric cancer cell line with lentivirus-mediated RNA interference for I2PP2A
SHI Hairong1,CHEN Ying1, LI Changlei2, QIU Wenhong3(1.Department of Pathology and Pathophysiology, School of Medicine, Jianghan University, Wuhan Hubei 430056, China; 2.Department of Immunology, School of Medicine, Jianghan University, Wuhan Hubei 430056, China; 3.Laboratory Animals Center, School of Medicine, Jianghan University, Wuhan Hubei 430056, China)
QIU Wenhong E-mail: qiuwenhong@hotmail.com
Background and purpose:Overexpression of inhibitor of protein phosphatase 2 A-2 (I2PP2A) in many tumors including gastric cancer suggests that I2PP2A may contribute to the development of gastric cancer. To further study the biological function of I2PP2A and its role in gastric cancer, we established a BGC823 cell line for stable expression of shRNA targeting human I2PP2A gene.Methods:A double-stranded shRNA targeting the I2PP2A was designed, synthesized and was inserted into a lentivirus vector (pGLV2), and the insertion was identified by restriction endonuclease analysis and DNA sequencing. BGC823 cells were then transfected with the packaged recombinant lentivirus, and resistant cell clones were selected with puromycin. The expression of I2PP2A was examined using real-time PCR (RT-PCR) and Western blot.Results:Sequencing result proved that recombinant lentivirus vector pGLV2-shRNA-I2PP2A was constructed correctly. RT-PCR and Western blot results confirmed that the expression of I2PP2A was significantly down-regulated in this infected BGC823 cell line. The efficiency of siRNA interference of I2PP2A could be up to about 90%.Conclusion:A lentiviral vector carrying a shRNA targeting the I2PP2A gene is successfully constructed, and a BGC823 cell line stably expressing I2PP2A shRNA is established with this lentiviral system.
Inhibitor 2 of protein phosphatase 2A; Gastric cancer; Lentivirus; Stable cell line
10.3969/j.issn.1007-3969.2015.05.006
R735.2
A
1007-3639(2015)05-0352-08
2014-05-27
2014-09-15)
国家自然科学基金(81001082)。
邱文洪 E-mail:qiuwenhong@hotmail.com

