不可切除晚期胰腺癌行移动式术中放疗的安全性和有效性研究
赵胜光,陈毅,徐卫慧,程东峰,刘永梅,彭承宏,金冶宁
1.上海交通大学医学院附属瑞金医院肿瘤放化疗科,上海 200025;
2.上海交通大学医学院附属瑞金医院普外科,上海 200025;
3.上海交通大学医学院附属瑞金医院手术室,上海 200025
不可切除晚期胰腺癌行移动式术中放疗的安全性和有效性研究
赵胜光1,陈毅1,徐卫慧1,程东峰2,刘永梅3,彭承宏2,金冶宁1
1.上海交通大学医学院附属瑞金医院肿瘤放化疗科,上海 200025;
2.上海交通大学医学院附属瑞金医院普外科,上海 200025;
3.上海交通大学医学院附属瑞金医院手术室,上海 200025
可移动直线加速器;术中放疗;胰腺癌
胰腺癌初诊时约有30%的患者为局部晚期,无法通过手术根治[6]。这些患者大多治疗策略是进行同步放化疗[2-3]或者单纯化疗[4-5],即便如此通常预后仍很差。故急需研究新的治疗方法或模式来提高局部晚期胰腺癌的疗效。
术中放疗(intraoperative radiation therapy)是指在手术中通过一次性大剂量照射肿瘤或瘤床的放疗技术。可移动式术中放疗Mobetron具有高达1 000 cGy/s高剂量率的特点,与国内以前直接加速器改造的方式有所不同,是新一代术中放疗设备。
由于术中放疗工作人员受照射范围广以及设备要求高等原因,目前Mobetron在国内仍为少有的大型设备。上海交通大学医学院附属瑞金医院自引进可移动式术中放疗加速器Mobetron开展工作以来,对局部晚期胰腺癌患者使用Mobetron术中放疗,通过剂量学测量、不良事件以及生存情况探讨胰腺癌术中放疗的安全性和有效性。
1 资料和方法
1.1 临床资料
收集2012年3月—2013年5月经我院诊治的12例局部晚期胰腺癌临床资料,患者特征见表1。本研究经过院医学伦理委员会批准。
入组标准:①所有患者术前均有CT、MR或PET/CT影像学诊断,以及糖类抗原19-9(CA19-9)等肿瘤血清学检查诊断,术中均行活检冰冻病理证实为胰腺导管腺癌;②患者影像学无远处转移,并为手术无法切除的局部晚期胰腺癌;③所有患者胰腺肿瘤均行CT以及MR影像学评估,直径小于Mobetron提供限光筒范围;④所有患者均签署知情同意书。

表1 一般资料和治疗参数Tab. 1 Primary disease and treatment characteristics
1.2 方法
术中放疗技术的详细步骤参考文献[6],简单可以概括为,①靶区确定及放置限光筒:外科医师先行开腹手术,在获取手术冰冻病理结果后,结合肉眼所见以及影像学判断肿瘤大小和深度,放疗科医师选择合适直径和斜面的限光筒,选择合适的射线能量和照射剂量,一般为9 MeV和12 MeV;外科与放疗科医师共同放置限光筒,限光筒包括肿瘤外正常组织1 cm,并将近的正常的射线敏感组织置于限光筒外;②进床对位:将Mobetron术中放疗单元安置于限光筒附近并利用激光软到位行精确对位;③出束:核对无误后操作控制单元产生高能电子线完成照射。
术中放疗照射胰腺癌剂量和限光筒孔径见表1,在胰腺附近的肝脏、十二指肠和胃等部位放置半导体测量仪,以测量术中放疗中正常组织的射线吸收剂量。
所有患者术后住院观察至无明显术后不良反应后出院,住院期间按照术后常规检测血常规,肝肾功能,血电解质,相关肿瘤指标CA19-9等,并观察术后引流管,患者是否有手术并发症。出院后门诊中位随访时间为15个月(7~21个月)。
1.3 统计学处理
数据采用IBM SPSS 20.0统计软件进行分析。所有计量资料行描述性分析,生存分析采用Kaplan-Meier方法。P<0.05为差异有统计学意义。
2 结 果
12例晚期胰腺癌患者均完成术中病理活检和术中放疗。其中2例(16.7%)术后1个月进行外照射50 Gy和单药吉西他滨化疗,10例(83.3%)由于患者拒绝未行术后放化疗。
2.1 术中放疗时间和剂量监测
12例晚期胰腺癌患者中位手术时间为(3.4±0.5) h;IORT中位总时间为(38.6±12.0) min,所占手术时间的19.2%±5.72%。术中放疗中周围正常组织剂量:限光筒周围为(54.3±48.8) cGy,胃壁为(11.0±2.0) cGy,肝脏为(9.6±8.2) cGy,十二指肠为(19.0±8.2) cGy。
2.2 术中放疗后正常组织并发症
术中放疗的不良事件参照CTCAE v4.0标准,由于术中放疗与手术同时进行,在明确为手术所导致的各种临床不良事件的情况下单独作为手术并发症记录,不计入术中放疗的并发症内。本组术中放疗均未见3度以上不良事件。
2.3 术后并发症
根据2010年中华医学会外科学分会胰腺外科学组发布的专家共识[7],胰漏A级1例,B级1例,无C级胰漏;术后出血0例;术后腹腔内感染1例;术后胃排空延迟 A级0例,B级1例,C级0例;胆瘘0例。平均引流管拔除时间为(5.8±1.2) d,住院天数为(20.6±9.0) d。
2.4 疗效
患者术前平均CA19-9为620 (21~1 990) μg/mL,术后1个月内为351(10~918)μg/mL,差异无统计学意义(P=0.07)。
疼痛判断:完全缓解指不借助任何止痛药物,无疼痛感;部分缓解指患者需间断服用镇痛药物耐受疼痛。12例晚期胰腺癌患者中10例有明显疼痛,治疗后完全缓解为2例(20.0%),部分缓解为6例(60.0%)。
患者术后随访中,2个月后行CT复查,根据实体瘤疗效评价标准(RECIST 1.1),7例(58.3%)评估为稳定,3例(25.0%)为部分缓解,2例(16.7%)为进展。中位无疾病进展时间为3.5个月,中位生存时间为7.3个月。1年生存率为20.0%。其中2例行术后同步放化疗的患者存活超过12个月(图1)。
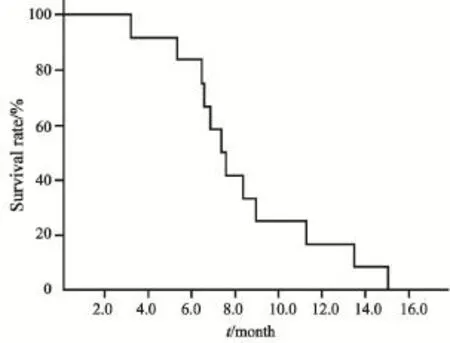
图1 12例晚期胰腺癌患者行术后放疗的生存曲线Fig. 1 Survival curve of 12 patients with local advanced pancreatic cancer receiving intraoperative radiation therap
3 讨 论
局部晚期胰腺癌的放疗作用依然面对诸多挑战。早期Ⅲ期临床实验GITSG采用放疗同步5-FU与单纯化疗比较,同步放化疗中位生存期(42周)优于单纯化疗(32周)。1年总生存率(41%)优于单纯化疗(19%)(P<0.02)[2]。而同一时代东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)研究胰腺癌和胃癌的同步放化疗的作用,认为同步放化疗与单纯化疗相比不增加疗效,且不良反应较大[8]。胰腺周围组织和器官较多,诸如肝脏、十二指肠、胃、肾脏等大多是放疗剂量敏感组织,限制了放射剂量提高,如果常规外照射剂量达到60 Gy,将明显增加胃肠道不良反应,使常规放疗在胰腺癌治疗中的作用有限。
术中放疗是有别于常规放疗的一种较为特殊治疗方式。通过在手术中直接暴露肿瘤或瘤床,直接将射线照射于肿瘤或淋巴结引流区域。其特点是能有效将肿瘤附近的放疗敏感组织通过手工方式分离出照射范围,从而降低放疗不良反应,进而有望提高肿瘤照射剂量。本研究中给予肿瘤照射一次性剂量10~20 cGy,相当于常规剂量20~45 Gy,而通过对于周围正常组织的监测提示,肝脏、十二指肠、胃等腹腔重要脏器的剂量约等于肿瘤照射剂量的1%~2%,通过术中剂量的监测方式目前国内鲜见报道。本研究显示,术中放疗对关键器官的剂量角度而言所造成的损伤忽略不计。这与常规放疗相比,体现了其放射剂量学的优势。
有关文献报道,胰腺癌术中放疗的并发症包括胃肠道出血,胆管纤维化,吻合口漏,外周神经炎等[9]。本研究结果显示,患者均体现了良好的耐受性,并未发生术中放疗的特殊严重不良事件。
胰腺癌术后并发症包括胰漏,术后出血,腹腔感染,术后胃排空延迟,胆瘘等[7]。本组研究中因在术中行病灶活检,为确保病理结果,活检组织较大。虽有胰漏合并感染的患者,但发生率和严重程度均无明显增高。值得注意的是,术中放疗患者后的引流液较多,引流管拔除时间较长,排除胰漏可能外,考虑与放疗后渗出液增多有关,故本组患者引流管拔除时间稍长。为了实验观察,本组患者住院时间较长,如果作为日常工作开展,住院时间还有进一步缩短的可能。
IORT与常规放疗的流程有较大不同,主要步骤包括靶区确定并放置限光筒,Mobetron进床对位,以及出束。其中每一个步骤的时间延长都会导致手术总时间的延长,使患者术后感染风险增加,麻醉药物加量,不利于术后恢复[6]。本研究术中放疗总耗时约40 min,与国外研究的20~40 min相符,胰腺癌姑息手术总时间>3 h对于手术室、麻醉科以及外科医师均在可控制范围。
本研究显示虽然大多数患者因为患者拒绝进一步治疗,没有行术后放化疗,包括一例患者因转流术的因素外,所有患者的胰腺癌敏感肿瘤指标CA19-9均有下降,但尚未达到统计学差异。局部晚期胰腺癌一般进展迅速,本组中位无进展时间为3.5个月,显示了单次术中放疗对于局部肿瘤的控制作用和较好的改善生活质量的作用[10]。值得注意的是,2例患者在完成术后放化疗后,其生存时间均超过12个月,提示术后放化疗在单次大剂量照射后仍可积极进行[11]。
综上所述,使用Mobetron行术中放疗对于晚期局部胰腺癌照射10~20 cGy,无明显不良反应,耐受性较好,并具有一定控制肿瘤的作用,对于多学科合作开展术中放疗具有可操作性,建议对于晚期胰腺癌术中放疗后进一步行同步放化疗。
[1] HIDALGO M. Pancreatic cancer[J]. N Engl J Med, 2010, 362(17): 1605-1617.
[2] Gastrointestinal Tumor Study Group. Treatment of locally unresectable carcinoma of the pancreas: comparison of combined-modality therapy (chemotherapy plus radiotherapy) to chemotherapy alone[J]. J Natl Cancer Inst, 1988, 80(10): 751-755.
[3] Gastrointestinal Tumor Study Group. Radiation therapy combined with adriamycin or 5-fluorouracil for the treatment of locally unresectable pancreatic carcinoma[J]. Cancer, 1985, 56(11): 2563-2568.
[4] BURRIS H A, MOORE M J, ANDERSEN J, et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial[J]. J Clin Oncol, 1997, 15(6): 2403-2413.
[5] LOUVET C, LABIANCA R, HAMMEL P, et al. Gemcitabine in combination with oxaliplatin compared with gemcitabine alone in locally advanced or metastatic pancreatic cancer: results of a GERCOR and GISCAD phase Ⅲ trial[J]. J Clin Oncol, 2005, 23(15): 3509-3516.
[6] 赵胜光, 沈文同, 张毅斌, 等. 失效模式和效果分析用于术中放疗风险管理模式初探[J]. 中华放射肿瘤学杂志, 2013, 22(2): 147-150.
[7] 赵玉沛. 胰腺术后外科常见并发症预防及治疗的专家共识(2010)[J]. 中华外科杂志, 2010,48(18): 1365-1368.
[8] KLAASSEN D J, MACINTYRE J M, CATTON G E, et al. Treatment of locally unresectable cancer of the stomach and pancreas: a randomized comparison of 5-fluorouracil alone with radiation plus concurrent and maintenance 5-fluorouracil--an Eastern Cooperative Oncology Group study[J]. J Clin Oncol ,1985, 3(3): 373-378.
[9] 翟医蕊, 冯勤付, 李明辉, 等. 腹部肿瘤术中电子线放疗安全性和急性副反应观察[J]. 中华放射肿瘤学杂志, 2010, 19(5): 448-451.
[10] WILLETT C G, DEL CASTILLO C F, SHIH H A, et al. Long-term results of intraoperative electron beam irradiation (IOERT) for patients with unresectable pancreatic cancer[J]. Ann Surg, 2005, 241(2): 295-299.
[11] 王成锋, 白晓枫, 张建伟, 等.术中放疗在局部晚期胰腺癌治疗中的作用[J]. 中华医学杂志, 2011, 91(4): 243-246.
10.3969/j.issn.1007-3969.2015.06.011
R735.9
A
1007-3639(2015)06-0473-03
2014-06-27
2014-10-13)

