干细胞转录因子SOX2、OCT4在不同分化程度胃癌组织中的表达及其临床意义
福建医科大学第一临床医学院,厦门大学附属第一医院厦门市肿瘤中心胃肠外科,福建 厦门 361003
干细胞转录因子SOX2、OCT4在不同分化程度胃癌组织中的表达及其临床意义
徐毅,丁伟基,李文鹏,陈跃达,魏斌,谢永进,罗琪,黄正接
福建医科大学第一临床医学院,厦门大学附属第一医院厦门市肿瘤中心胃肠外科,福建 厦门 361003
背景与目的:肿瘤组织的分化程度是决定胃癌预后的重要因素,本研究检测胃癌组织中性别决定相关基因簇2(sex determining region Y-box 2,SOX2)、八聚体结合蛋白-4(octamer binding factor 4,OCT4)的表达,探讨SOX2、OCT4的表达与胃癌患者临床病理因素及预后的关系及意义。方法:通过实时定量PCR(quantitative real-time PCR,qRT-PCR)、蛋白[质]印迹法(Western blot)和免疫组化检测了60例分化程度不同的胃癌组织与正常黏膜组织中SOX2和OCT4的mRNA及蛋白的表达量,并分析SOX2和OCT4基因的表达水平与患者临床病理参数的关系。结果:qRT-PCR、Western blot检测显示,高分化胃癌组织SOX2 mRNA和蛋白的相对表达量与正常胃黏膜组织比较差异无统计学意义(t=0.103 3,P>0.05;t=0.116,P>0.05),但显著高于中分化胃癌组织(t=12.48,P<0.05;t=22.78,P<0.05)和低分化胃癌组织(t=17.56,P<0.05;t=30.00,P<0.05),差异有统计学意义。与SOX2相反,高分化胃癌组织OCT4 mRNA的相对表达量与正常胃黏膜组织比较差异无统计学意义(t=2.436,P>0.05;t=1.064,P>0.05),但显著低于中分化胃癌组织(t=13.23,P<0.05;t=25.56,P<0.05)和低分化胃癌组织(t=12.10,P<0.05;t=69.48,P<0.05),差异有统计学意义。免疫组化显示,高分化胃癌组织中SOX2的阳性表达率(10/21)高于中分化胃癌组织(7/20)和低分化胃癌组织(2/19,P<0.05),高分化胃癌组织中OCT4的阳性表达率(2/21)低于中分化胃癌组织(6/20)和低分化胃癌组织(12/19,P<0.05),与临床病理参数相比较,胃癌中SOX2和OCT4蛋白的表达与患者的性别、年龄无关,差异无统计学意义(P>0.05)。与病理分期、浸润程度、淋巴结转移相关(P<0.05)。结论:SOX2基因的低表达水平和OCT4的高表达水平促进胃癌的发生、发展和侵袭,有望成为胃癌诊断、治疗和预后判断的一个指标。
胃肿瘤,性别决定相关基因簇2,八聚体结合蛋白-4,分化程度
恶性肿瘤已成为人类的第一杀手,严重危害人类的生命健康[1],肿瘤组织的分化程度是决定恶性肿瘤预后的重要因素[2]。胃癌在我国具有高发病率和高死亡率,探索影响胃癌分化程度的相关因素对于胃癌的早期诊治和改善预后具有重要意义。研究表明干细胞基因的异常表达与恶性肿瘤的发生有重要关系,在胃癌的发生、发展、复发和转移中起着决定性作用[3],干细胞转录因子性别决定相关基因簇2(sex determining region Y-box 2,SOX2)的异常表达会导致胃黏膜上皮细胞的分化失去稳态或者产生紊乱,促进肿瘤的发生;八聚体结合蛋白-4(octamer binding factor 4,OCT4),是维持细胞多能性的重要标志物,对细胞的正常分化起决定性作用[4]。目前,干细胞转录因子SOX2、OCT4的表达与肿瘤分化程度关系的报道比较少。本研究以高发病率的胃癌为对象,综合利用实时定量PCR(quantitative real-time PCR,qRT-PCR)、蛋白[质]印迹法(Western blot)、免疫组织化学实验方法,在人胃癌组织标本方面研究转录因子SOX2、OCT4在不同分化程度胃癌组织中的表达水平,探讨SOX2、OCT4的表达水平在不同分化程度胃癌中的作用,为胃癌的临床诊断、治疗和预后判断提供可能的参考指标。
1 材料和方法
1.1 材料
1.1.1 主要试剂
RPMI-1640培养基和RNA抽提试剂盒购自天根生物科技(北京)有限公司;PCR及qRT-PCR试剂盒购自Fermentas公司;细胞蛋白RIPA裂解液及BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;Western blot、免疫组化检测所用一抗:兔抗人SOX2多克隆抗体(购自美国abcam公司,工作效价:1∶3 000,产品编号:ab97959)、兔抗人OCT4单克隆抗体(购自美国Abcam公司,工作效价:1∶5 000,产品编号:ab18976)、兔抗人β-肌动蛋白(β-Actin)单克隆抗体(购自武汉博士德生物工程有限公司,工作效价1∶400,产品编号BM0627);Western blot、免疫组化检测所用二抗:辣根过氧化物酶标记的羊抗兔IgG(购自福州迈新生物技术开发有限公司,工作效价1∶100,产品编号KIT-9710);SOX2、OCT4和GAPDH引物购自美国Invitrogen公司; 逆转录试剂盒、Taq酶 、Seyb PCR酶购自宝生物工程(大连)有限公司公司;免疫组化染色超敏试剂盒购自福州迈新生物技术开发有限公司。
1.1.2 PCR引物
引物按参考文献[5]设计,由美国Invitrogen有限公司合成(表1)。

表1 PCR引物Tab. 1 PCR primers
1.1.3 组织标本
选择2013年1月—2014年4月在厦门大学附属第一医院肿瘤外科手术的60例胃癌患者,手术切除的胃癌标本离体后30 min内,于无菌状态下先取距肿瘤边缘5 cm外的正常胃黏膜组织,然后在肿瘤组织中切取无坏死的癌组织,将其放入无RNA、DNA酶的1.5 mL EP管中,立即投入液氮中,随后将其转入-80 ℃冰箱保存。全部标本均经病理组织学确诊,包括高分化腺癌21例,中分化腺癌20例 ,低分化腺癌19例(包含未分化癌和印戒细胞癌),正常胃黏膜组织20例。记录并分析60例患者术后临床病理参数,肿瘤分期标准为2010年美国癌症联合委员会(AJCC)新修订的胃癌 TNM 分期标准[6]。
1.2 方法
1.2.1 总RNA的提取及逆转录
根据TRIzol总RNA提取试剂盒提供的方案分别对高、中、低分化胃癌组织和正常胃黏膜组织标本进行总RNA提取,并各取总RNA 1 μg,加Oligod(T)引物将抽提的细胞总RNA逆转录成cDNA。
1.2.2 qRT-PCR检测
引物设计按照参考文献[5],根据RealMasterMix(SYBR Green)试剂盒内说明书提供的20 μL反应体系,依次加入上游引物0.5 μL、下游引物0.5 μL、cDNA模板1 μL、2.5×RealMasterMix/20×SYBR solution 9 μL,最后补超纯水至20 μL。Real time-PCR在ABI 7500 system仪器上进行两步法反应,反应条件为95 ℃起始模板变性30 s,95 ℃扩增15 s,58 ℃扩增15 s,65 ℃延伸1 min,循环45次。实验中分别以高、中、低分化胃癌组织和正常胃黏膜组织的cDNA为模板,同时设等体积水为模板空白组,重复实验3次。实验结果经ROCHE Light cycler 480自带软件分析实验数据,采用2-ΔΔCT方法计算SOX2、OCT4基因相对mRNA表达量。
1.2.3 蛋白的提取和Western blot检测
高、中、低分化胃癌和正常胃黏膜组织进行蛋白提取,具体提取步骤参考RIPA裂解液说明书,将得到的蛋白进行浓度测定,详细步骤参考BCA蛋白浓度测定试剂盒内说明书。按照总蛋白30 μg的量在上样缓冲Buffer中煮沸10 min,进行12%SDS-PAGE电泳分离蛋白,然后通过电转将目的蛋白及内参蛋白转至PVDF膜上。PVDF膜在含5%脱脂奶粉的TBST溶液中封闭90 min后,分别加靶蛋白一抗兔抗人SOX2多克隆抗体(购自美国Abcam公司,工作效价1∶3 000,产品编号为ab97959)、兔抗人OCT4单克隆抗体(购自美国Abcam公司,工作效价1∶5 000,产品编号为ab18976)及内参一抗兔抗人β-Actin单克隆抗体(购自武汉博士德生物工程有限公司,工作效价1∶400,产品编号为BM0627);40 ℃温育过夜,然后用TBST洗涤10 min×3次,随后都加二抗:辣根过氧化物酶标记的羊抗兔IgG(购自福州迈新生物技术开发有限公司,工作效价1∶100,产品编号为KIT-9710),室温反应90 min,再次洗涤10 min×3次,放人暗盒中曝光于X线胶片上,经显影和定影后保存。曝光处理后进行灰度值计算,以目的蛋白和内参蛋白灰度值比值作为目的蛋白相对表达量。
1.2.4 免疫组织化学检测
每组切片检测均设阴性对照和阳性对照,用SOX2和OCT4阳性的胃组织切片作为阳性对照,用0.01%mol/L的PBS液替代一抗作为阴性对照。结果判定:每张切片至少观察3个以上的高倍视野。抗原染色表达评分方法为综合染色强度和染色细胞数两项指标。染色强度分级评分标准为:0级,无着色;1级,弱染色;2级,中等强度染色;3级,强染色。按照每张切片阳性细胞数的比例进行染色细胞数评分,阳性细胞数比例取各视野记数的平均数:0级,阳性细胞为0%;l级,阳性细胞<25%;2级,阳性细胞25%~50%;3级,阳性细胞>50%~75%;4级,阳性细胞>75%。组织学评分=染色强度评分×阳性细胞数比例评分。总评分:0~12分,根据两项评分之积判断阳性强度:(-)为0分,(+)为1~4分,(++)为5~8分,(+++)为9~12分,将(++)、(+++)定义为阳性表达。
1.3 统计学处理
2 结 果
2.1 qRT-PCR检测SOX2、OCT4基因的mRNA的表达
高分化胃癌组织SOX2 mRNA的相对表达量(△Ct=2.48±0.18)与正常胃黏膜组织比较差异无统计学意义(t=0.103 3,P=0.922 7),但显著高于中分化胃癌组织(△Ct=4.64±0.24,t=12.48,P=0.000 2)和低分化胃癌组织(△Ct=4.73±0.13,t=17.56,P<0.000 1),差异有统计学意义(表2、3,图1A)。而OCT4 mRNA的相对表达量与SOX2相反,高分化胃癌组织OCT4 mRNA的相对表达量(△Ct=8.23±0.12)与正常胃黏膜组织比较差异无统计学意义(t=2.436,P=0.071 5),但显著低于中分化胃癌组织(△Ct=6.58±0.18,t=13.23,P=0.000 2)和低分化胃癌组织(△Ct=6.36±0.24,t=12.10,P=0.000 3),差异有统计学意义(表2、3,图1B)。

表2 SOX2基因的相对表达Tab. 2 The relative expression of gene SOX2

表3 OCT4基因的相对表达Tab. 3 The relative expression of gene OCT4

图1 胃癌和正常胃黏膜组织中SOX2 mRNA、OCT4 mRNA表达量Fig. 1 The expression level of SOX2 mRNA and OCT4 mRNA in gastric cancer and normal gastric mucosa
2.2 Western blot检测结果
Western blot检测结果显示,与中分化胃癌组织(0.25±0.05,t=22.78,P<0.000 1)和低分化胃癌组织(0.22±0.03,t=30.00,P<0.000 1)的SOX2蛋白相对表达量比较,高分化胃癌组织的SOX2蛋白相对表达量(1.09±0.04)最高,与正常胃黏膜组织的SOX2蛋白相对表达量(1.09±0.02)相仿(t=0.116,P=0.913)。而高分化胃癌组织的OCT4蛋白相对表达量(0.33±0.02)低于中分化胃癌组织(0.99±0.04,t=25.56,P<0.000 1)和低分化胃癌组织。差异有统计学意义(1.22±0.01,t=69.48,P<0.000 1)。但与正常胃黏膜组织的OCT4蛋白相对表达量(0.29±0.014)相仿(t=1.064,P=0.347,图2)。
2.3 免疫组织化学结果
SOX2、OCT4在胃癌组织中均有表达,不同分化程度胃癌组织的SOX2、OCT4表达量不同SOX2表达阳性产物呈棕黄色颗粒,主要表达于细胞质和细胞膜,高分化胃癌组织中SOX2的阳性表达率(10/21)高于中分化胃癌组织(7/20)和低分化胃癌组织(2/19,P<0.05),与正常胃黏膜组织的SOX2蛋白相对表达量相仿(15/20,χ2=3.228,P=0.072 4)。OCT4抗原阳性反应为位于细胞核内的棕黄色颗粒,高分化胃癌组织中OCT4的阳性表达率(2/21)低于中分化胃癌组织(6/20)和低分化胃癌组织(12/19,P<0.05),与正常胃黏膜组织的OCT4蛋白相对表达量相仿(2/20,χ2=0.002 6,P=0.959,表4,图3)。
2.4 免疫组化胃癌组织中SOX2 、OCT4蛋白的表达与临床病理参数的比较
胃癌中SOX2、OCT4蛋白的表达与患者的性别、年龄无关。差异无统计学意义(P>0.05)。与病理分期、浸润程度、淋巴结转移相关(P<0.05,表5)。
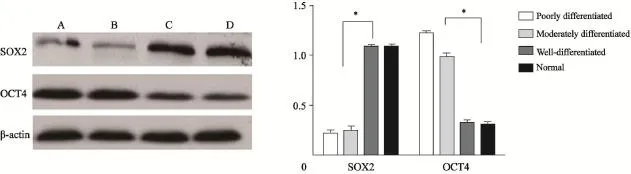
图2 胃癌组织SOX2、OCT4蛋白的表达Fig. 2 The expression level of SOX2 and OCT4 protein in gastric cancer

表4 SOX2和OCT4在胃癌和胃黏膜组织中的表达Tab. 4 The expression of SOX2 and OCT4 in gastric cancer and gastric mucosa

图3 免疫组化检测胃癌组织SOX2 、OCT4蛋白的表达Fig. 3 Immunohistochemical detect the expression of SOX2 and OCT4 protein in gastric cancer

表5 SOX2、OCT4蛋白的表达与临床病理参数的比较Tab. 5 The comparison of SOX2, OCT4 protein expression and clinicopathological parameters
3 讨 论
肿瘤干细胞理论为肿瘤组织内存在少量的干细胞样细胞,能无限增殖分裂为肿瘤细胞,这些肿瘤干细胞在肿瘤的发生、发展及侵袭转移上发挥重要的作用[7]。有研究提示,胃癌的发生、发展与组织内部的干细胞分化异常有非常密切的关系,胃癌可能是一种干细胞疾病[8]。SOX2和OCT4是干细胞的两个重要转录因子。SOX2基因的转录产物通过高迁移率组分区与DNA相连,决定细胞分化的方向与速度,并通过与靶基因高迁移率组分结构域特异结合,在调控胚胎及组织的发育、维持干细胞的多能性和自我更新能力等方面起重要作用[9-13]。通过瞬时转染使胃癌细胞系NGC3和GCIY过表达SOX2,能够明显抑制胃癌细胞的增殖,进一步研究表明,在胃癌早期,SOX2可能通过抑制细胞周期而阻止胃黏膜细胞癌变,而在晚期则会促进胃癌细胞凋亡[14-15]。OCT4基因是八聚核苷酸结合蛋白转录因子家族中的一员,人的OCT4蛋白属于八聚核苷酸结合蛋白家族第五类转录因子,有保守的DNA结合域八聚核苷酸结合蛋白结合域。OCT4蛋白在胃癌细胞内高表达,通过抗凋亡因子的作用而促进胃癌细胞的生长。SOX2能够与OCT4结合,形成OCT4/SOX2复合体,并以一种高度序列特异性的方式与靶基因结合,控制OCT4转录表达,在调节胚胎发育、维持胚胎干细胞自我更新以及定向分化能力方面具有重要作用[16-17]。OCT4的表达可能受到SOX2的反馈调节作用,两者呈现负相关性,SOX2基因在细胞周期中特定时期的高表达可能导致胃癌干细胞的分化和凋亡,而OCT4的高表达则可能是胃癌干细胞扩展的必须条件[18-19]。
胃黏膜的肠化生是肠型胃癌的癌前病变,有研究发现SOX2在胃黏膜组织中强表达,随着胃黏膜肠化生程度加重,SOX2表达水平逐渐减低[20]。而OCT4在人肠型胃癌中高表达,OCT4阳性高表达组生存率明显低于OCT4阴性表达组[21]。但是对于SOX2、OCT4的表达水平与胃癌组织分化程度的关系,目前尚少见报道。本实验通过荧光定量PCR及Western blot检测了60例胃癌组织与正常黏膜组织中SOX2和OCT4的mRNA及蛋白的表达量。结果显示正常黏膜组织SOX2 mRNA及蛋白表达量均显著高于癌组织,不同分化程度胃癌组织的SOX2表达水平不同,分化程度越高,SOX2表达水平越高,高分化胃癌组织的SOX2表达水平明显高于中、低分化胃癌组织(P均<0.05),提示SOX2在胃上皮细胞的分化过程中起了重要的作用,在胃癌的演变过程中具有抑癌基因的功能。尽管胃癌的发生、发展是多因素引起的渐进性过程,SOX2表达的缺失可能与胃癌的发生有一定的联系,SOX2的表达在胃黏膜细胞中的下调或丢失可能是胃癌发生、发展的重要机制之一。与SOX2相反,本实验中胃癌组织分化程度越低,OCT4的mRNA及蛋白的表达量越高,低分化胃癌组织的OCT4表达水平明显高于中、高分化胃癌组织(P均<0.05),表明OCT4基因的表达与胃癌细胞的分化程度密切相关。低分化胃癌组织的OCT4表达水平高,一方面因为胃癌细胞的分化程度越低,其基因结构及表型越接近原始的肿瘤干细胞,另一方面,低分化癌组织中具有干细胞特性细胞的比例可能大于中高分化胃癌组织的比例。
侵袭和转移是恶性肿瘤非常重要的生物学特征之一,肿瘤恶性程度越高,侵袭和转移能力越强。肿瘤细胞的分化程度与肿瘤的侵袭和转移能力密切相关,决定患者的预后。低分化癌细胞的增殖能力较强、恶性程度较高,容易侵犯周围组织和发生转移。本研究免疫组化实验中, 60例胃癌中有19例出现SOX2蛋白阳性表达,19例OCT4蛋白阳性表达。高分化胃癌组织中SOX2的阳性表达率高于中、低分化胃癌组织(P<0.05),与正常胃黏膜组织的SOX2蛋白相对表达量相仿。而高分化胃癌组织中OCT4的阳性表达率低于中、低分化胃癌组织(P<0.05),与正常胃黏膜组织的OCT4蛋白相对表达量相仿。进一步分析SOX2和OCT4的阳性表达率与临床病理参数之间的关系发现,不同性别、年龄胃癌患者标本SOX2和OCT4的阳性表达率无明显差异(P>0.05);患者的肿瘤浸润程度、淋巴结转移情况不同,SOX2和OCT4的阳性表达率有显著差异(P<0.05)。肿瘤浸润深度(T1+T2)的胃癌组织中SOX2阳性表达率大于(T3+T4),而OCT4的阳性表达率小于(T3+T4)(P<0.05)。淋巴结无转移组SOX2阳性表达率高,淋巴结转移组OCT4的阳性表达率高,提示胃癌组织浸润较深、合并淋巴结转移的胃癌组织中SOX2阳性表达率较低而OCT4的阳性表达率较高。反映在TNM病理分期上,与TNM(Ⅰ+Ⅱ)期的胃癌组织比较,(Ⅲ+Ⅳ)期胃癌组织低表达SOX2而高表达OCT4,提示SOX2和OCT4的阳性表达与胃癌的侵袭和转移有一定关联。同时实验中发现,SOX2和OCT4的阳性表达细胞多呈点状聚集, 提示SOX2和OCT4只是在少部分细胞阳性表达,这和肿瘤干细胞只占肿瘤组织的很少一部分理论是吻合的。
本研究结果表明,分化程度低、浸润程度深、合并淋巴结转移的胃癌组织中SOX2表达水平较低而OCT4的表达水平较高,提示SOX2基因的低表达水平和OCT4的高水平表达促进胃癌的发生、发展和侵袭,虽然目前对其分子机制还不清楚,但有望成为胃癌诊断、治疗和预后判断的一个指标。当然,本研究有一定的局限性,需要进一步行SOX2基因表达水平与胃癌患者生存期的相关性研究。
[1] 白玉盘, 杨小利, 欧周罗. mTOR 信号通路介导产生 XCL1可促进乳腺癌耐药细胞株的增殖[J]. 中国癌症杂志, 2014, 24(10): 770-776.
[2] 赵刚, 邱江锋, 吴志勇. 603 例胃癌根治术的预后因素分析[J]. 中国癌症杂志, 2007, 17(7): 556-559.
[3] XUE Z, YAN H, LI J, et al. Identification of cancer stem cells in vincristine preconditioned SGC7901 gastric cancer cell line[J]. J Cell Biochem, 2012, 113(1): 302-312.
[4] PAN C, JIA W, LU B, et al. Expression of TAT recombinant Oct4, Sox2, Lin28, and Nanog proteins from baculovirusinfected Sf9 insect cells[J]. Gene, 2015, 556(2): 245-248.
[5] OTSUBO T, AKIYAMA Y, YANAGIHARA K, et al. SOX2 is frequently downregulated in gastric cancers and inhibits cell growth through cell-cycle arrest and apoptosis[J]. Br J Cancer, 2008, 98(4): 824-831.
[6] WASHINGTON K. 7th edition of the AJCC cancer staging manual: stomach[J]. Ann Surg Oncol, 2010, 17(12): 3077-3079.
[7] ZEKRI A R N, BAHNASSY A, EL-BASTAWISY A E, et al. Stem cells like phenotype of inflammatory breast cancer and locally advanced breast cancer: increased expression of sox2 and oct3/4 contributes to poor response to treatment and reduced survival rates[J]. Cancer Research, 2014, 74(19 Suppl): 4735.
[8] LI N, DENG W, MA J, et al. Prognostic evaluation of Nanog, Oct4, Sox2, PCNA, Ki67 and E-cadherin expression in gastric cancer[J]. Med Oncol, 2015, 32(1): 1-9.
[9] WANG Z, ORON E, NELSON B, et al. Distinct lineage specification roles for NANOG, OCT4, and SOX2 in human embryonic stem cells[J]. Cell Stem Cell, 2012, 10(4): 440-454.
[10] JI J, WEI X, WANG Y. Embryonic stem cell markers Sox-2 and OCT4 expression and their correlation with WNT signal pathway in cervical squamous cell carcinoma[J]. Int J Clin Exp Pathol, 2014, 7(5): 2470.
[11] KALLAS A, POOK M, TREI A, et al. SOX2 is regulated differently from NANOG and OCT4 in human embryonic stem cells during early differentiation initiated with sodium butyrate[J]. Stem Cells Int, 2014, 2014: 298163.
[12] SHEN L, HUANG X, XIE X, et al. High expression of SOX2 and OCT4 indicates radiation resistance and an independent negative prognosis in cervical squamous cell carcinoma[J]. J Histochem Cytochem, 2014, 62(7): 499-509.
[13] YANG S-H, KALKAN T, MORISSROE C, et al. Otx2 and Oct4 drive early enhancer activation during embryonic stem cell transition from naive pluripotency[J]. Cell Rep, 2014, 7(6): 1968-1981.
[14] NG C K, LI N X, CHEE S, et al. Deciphering the Sox-Oct partner code by quantitative cooperativity measurements[J]. Nucleic Acids Res, 2012, 40(11): 4933-4941.
[15] AKSOY I, JAUCH R, CHEN J, et al. Oct4 switches partnering from Sox2 to Sox17 to reinterpret the enhancer code and specify endoderm[J]. EMBO J, 2013, 32(7): 938-953.
[16] WANG X, ZHAO Y, XIAO Z, et al. Alternative translation of OCT4 by an internal ribosome entry site and its novel function in stress response[J]. Stem Cells, 2009, 27(6): 1265-1275.
[17] ASADI M H, MOWLA S J, FATHI F, et al. OCT4B1, a novel spliced variant of OCT4, is highly expressed in gastric cancer and acts as an antiapoptotic factor[J]. Int J Cancer, 2011, 128(11): 2645-2652.
[18] BOURGUIGNON L Y, WONG G, EARLE C, et al. Hyaluronan-CD44v3 interaction with Oct4-Sox2-Nanog promotes miR-302 expression leading to self-renewal, clonal formation, and cisplatin resistance in cancer stem cells from head and neck squamous cell carcinoma[J]. J Biol Chem, 2012, 287(39): 32800-32824.
[19] MATSUOKA J, YASHIRO M, SAKURAI K, et al. Role of the stemness factors sox2, oct3/4, and nanog in gastric carcinoma[J]. J Surg Res, 2012, 174(1): 130-135.
[20] 牛海静, 陈鑫, 王邦茂. 胃黏膜肠化生中CDX2及SOX2的表达及其甲基化状态[J]. 中华内科杂志, 2011, 50(5): 426-427.
[21] 张永杰, 秦叔逵, 王杰军, 等. 肠型胃癌中HDAC1与Oct4表达的相关性研究[J]. 中华临床医师杂志 (电子版), 2013, 7(14): 6387-6390.
The expression and clinical significance of stem cell transcription factor SOX2, OCT4 in gastric cancer tissues varying degrees of cell differentiation
XU Yi, DING Weiji, LI Wenpeng, CHEN Yueda, WEI Bin, XIE Yongjin, LUO Qi, HUANG Zhengjie (The First Clinical Medical College, Fujian Medical University; Department of Gastrointestinal Surgery, the First Affiliated Hospital of Xiamen University, Xiamen Cancer Center, Xiamen Fujian 361003, China)
HUANG Zhengjie E-mail: h74zj@126.com
Background and purpose:Differentiation of tumor tissue is an important factor on determining the prognosis of gastric cancer. This study aimed to investigate the expression levels and clinical significance of gender determining region Y-box 2 (SOX2) gene and octamer binding factor 4 (OCT4) gene in gastric cancer tissues varying different differentiation degrees.Methods:Sixty cases with gastric cancer were recruited in this study. The gastric cancer tissues and corresponding normal mucosa of the 60 cases were obtained. The mRNA and protein level of SOX2, OCT4 gene are evaluated by the quantitative real-time PCR (qRT-PCR), Western blot and immunohistochemistry, respectively. The relationship between the expression levels of SOX2, OCT4 gene and clinical pathological parameters were also analyzed in this study.Results:The expression of SOX2 in both mRNA and protein levels had no significant difference between the well-differentiated gastric cancer tissues and normal gastric mucosa (mRNA levels: t=0.1033, P>0.05; protein levels: t=0.116, P>0.05). However, both the mRNA and protein expression of SOX2 in patients with well-differentiated gastric cancer tissues were significant higher than not only in patients with moderately differentiated gastric carcinoma (mRNA levels: t=12.48, P<0.05; protein levels: t=22.78, P<0.05) but also in patients with than poorly differentiated gastric carcinoma (mRNA levels: t=17.56, P<0.05; protein levels: t=30.00, P<0.05). In contrast to SOX2, both the mRNA and protein expression of OCT4 in patients with well-differentiated gastric cancer tissues were significant lower than not only in patients with moderately differentiated gastric carcinoma (mRNA levels: t=13.23, P<0.05; protein levels: t=25.56, P<0.05) but also in patients with poorly differentiated gastric carcinoma (mRNA levels: t=12.10, P<0.05; protein levels: t=69.48, P<0.05). There was no significance of OCT4 mRNA and protein expression between the well-differentiated gastric cancer tissues and normal gastric mucosa (mRNA levels: t=2.436, P>0.05; protein levels: t=1.064, P>0.05). Immunohistochemical study demonstrated that the positive rate of SOX2 in patients with well-differentiated gastric cancer tissues (10/21) were higher than in patients with not only moderately differentiated gastric carcinoma (7/20) but also poorly differentiated gastric carcinoma (2/19, P<0.05), while the positive rate of OCT4 in cases with well-differentiated gastric cancer tissues (2/21) were lower than in cases with not only moderately differentiated gastric carcinoma (6/20) but also the poorly differentiated gastric carcinoma (12/19, P<0.05). There was no correlation between the expression of SOX2, OCT4 in gastric cancer and gender or age (P>0.05). Nevertheless, the expression of SOX2, OCT4 were positive or negative correlated with the pathological staging, the degree of infiltration and lymph node metastasis (P<0.05). Conclusion: Decreased SOX2 expression and increased expression level of OCT4 can promote the formation, development and invasion of gastric cancer and they may become biomarkers or the diagnosis, treatment and prognosis evaluation in gastric carcinoma.
Stomach neoplasms; Sex determining region Y-box 2; Octamer binding factor 4; Cell differentiation
10.3969/j.issn.1007-3969.2015.06.003
R735.2
A
1007-3639(2015)06-0416-08
2014-11-26
2015-02-10)
福建省医学创新课题(2012-CXB-29);福建省科技计划重点项目(2014D017);厦门市科技计划项目(3502Z20134011、3502Z20124018)。
黄正接 E-mail:h74zj@126.com

