Let-7a/g/i在骨肉瘤细胞中靶向调控Aurora-B表达
Let-7a/g/i在骨肉瘤细胞中靶向调控Aurora-B表达
周云飞,刘家明,陈宣银,朱粮博,龙新华,周 扬,张志宏,刘志礼南昌大学第一附属医院骨科,江西 南昌 330006
背景与目的:微小RNA(microRNA,miRNA)是一类具有重要调控作用的非编码小分子RNA,在多种肿瘤的发生、发展中起重要作用。该研究探讨可能在骨肉瘤细胞中调控Aurora-B激酶表达的miRNA,并为进一步探讨Aurora-B在骨肉瘤细胞恶性表型中的作用及调控机制奠定基础。方法:采用生物信息学预测软件(http://www.targetscan.org)以及荧光海肾素实验探讨可能靶向调控Aurora-B的miRNA;实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)和蛋白[质]印迹法(Western blot)进一步验证骨肉瘤细胞系U2-OS和HOS细胞中调控Aurora-B表达的miRNA。结果:生物信息学预测和荧光海肾素实验显示,Aurora-B基因可能是let-7a/b/c/d/e/f/g/i的靶基因;RTFQ-PCR和Western blot检测结果显示,上调let-7a/g/ i的U2-OS和HOS细胞中Aurora-B mRNA和蛋白的表达水平显著低于阴性对照组(阴性质粒转染细胞);但是上调let-7b/c/d/e/f的U2-OS和HOS细胞中Aurora-B mRNA和蛋白的表达水平和阴性质粒转染细胞比较差异无统计学意义。结论:Let-7a/g/i可能负向调控Aurora-B在骨肉瘤细胞中的表达。
骨肉瘤;Let-7;Aurora-B
本研究的前期研究发现Aurora-B在骨肉瘤细胞中过度表达并且与肺部转移呈正相关,抑制Aurora-B能显著抑制骨肉瘤细胞迁移侵袭[1-3]。但是,Aurora-B在骨肉瘤中过度表达调控机制尚不清楚。本研究通过生物信息学预测、荧光海肾素实验、实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)和蛋白[质]印迹法(Western blot)检测Let-7a/g/i在骨肉瘤细胞中靶向调控Aurora-B基因表达,为进一步研究Aurora-B在骨肉瘤侵袭转移中的作用及调控机制奠定基础。
1 材料和方法
1.1 细胞株
人源骨肉瘤细胞系U2-OS和HOS细胞株,购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。
1.2 主要试剂
RPMI-1640培养基和DMEN/F12 1∶1培养基购自北京索莱宝科技有限公司,转染质粒购自上海吉玛制药技术有限公司,胎牛血清、cDNA第一链合成试剂盒及RTFQ-PCR试剂盒购自北京全式金生物技术有限公司,Transwell侵袭小室购自美国Corning公司,基质胶购自美国BD公司,Western blot上样蛋白Marker和PVDF膜购自美国Formentas公司,一抗(兔抗人Aurora-B IgG,1∶5 000,鼠抗人β-actin IgG,1∶5 000)购自美国Santa Cruz公司,二抗(羊抗兔IgG和兔抗鼠IgG,1∶5 000)购自北京中衫金桥生物技术有限公司。
1.3 实验方法
1.3.1 生物信息学预测
采用靶基因在线预测软件(http://www. targetscan.org)对指定基因Aurora-B进行预测(表1)。
1.3.2 细胞培养
U2-OS和HOS细胞分别用含15%胎牛血清的RPMI-1640培养基和DMEM/F12 1∶1培养基置于37 ℃恒温、CO2体积分数为5%的饱和湿度培养箱中培养。
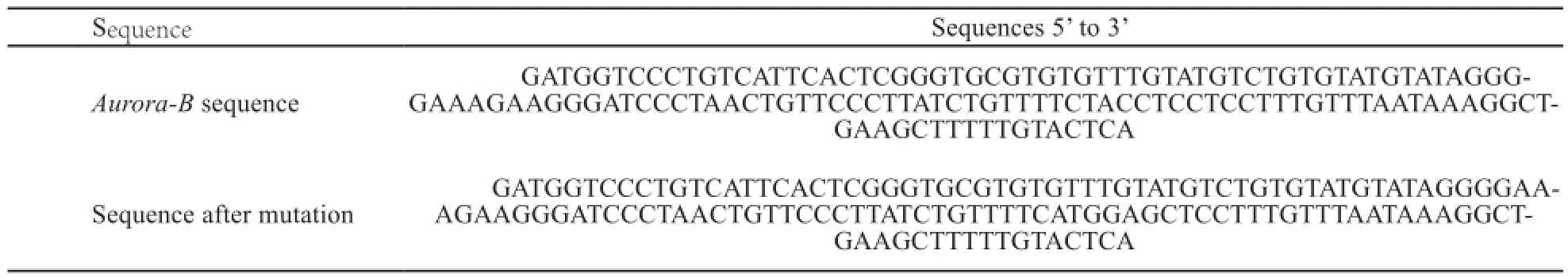
表1 Aurora-B基因序列及突变后序列Tab. 1 Nucleotide sequences of Aurora-B gene before and after mutation
1.3.3 转染
按照LipofectamineTM2000说明书提供的步骤进行。转染前1 d以(3×105~4×105)个/mL细胞悬液接种6孔板,每孔总体积为2 mL。当细胞达50%融合时转染。在转染前用无抗菌药物、不含血清的OPTI-MEM(购自美国Gibco公司)培养基培养3~4 h。取10 μL Mimics、5 μL LipofectamineTM2000(6孔板每孔的量),用OPTIMEM培养基分别稀释至250 μL,后者室温温育5 min,然后将两者混合均匀,室温温育20 min,然后逐滴加入培养板孔中,边滴加边“十”字晃动培养板,混合均匀。常规培养48 h后做表达检测(转染后6 h换含抗菌药物和血清的培养基常规培养)。
1.3.4 荧光海肾素实验
转染48 h后,将6孔板从培养箱中取出,小心吸去细胞培养上清液,PBS洗涤2次,将细胞用细胞裂解液裂解后,取5 μL细胞裂解液与萤火虫荧光素酶缓冲液及底物5 μL(按Promega双荧光报告系统测量试剂盒说明书操作)混匀测量荧光强度,然后加入荧光海肾素酶反应缓冲液及腔肠素底物5 μL,混匀再次测得荧光海肾素酶活性。将每个样品按照萤火虫荧光素酶活性进行均一化处理,比较荧光海肾素酶活性。
1.3.5 RTFQ-PCR检测
转染48 h 后收集各组细胞,用TRIzol法分别提取总RNA。将提取的RNA进行逆转录反应:16 ℃变性30 min,42 ℃延伸30 min,85 ℃终延伸10 min。结束后立即将cDNA产物取出,快速置于冰上冷却,后续所有步骤均在冰上进行。将cDNA产物稀释3~4倍,然后混匀并从中吸取2 μL(20 μL体系)做为模板,剩余产物存放于-20 ℃。RTFQ-PCR反应在ABI7500 RTFQPCR反应仪上进行,反应程序:95 ℃预变性3 min;95 ℃变性12 s,62 ℃延伸1 min,共40个循环;95 ℃终延伸15 s。在进行RTFQ-PCR定量时制作标准曲线,反应结束后确认扩增曲线和融解曲线等。不同时间重复6次实验。
1.3.6 Western blot检测蛋白表达
转染后48 h收集各组细胞,RIPA裂解,提取总蛋白,采用BCA法进行蛋白定量,10%SDS-PAGE凝胶电泳分离蛋白,转膜,5%脱脂奶粉封闭1 h,加入一抗室温温育2 h,TBST洗膜3次,加入二抗室温温育1 h,TBST洗膜3次,4℃过夜,ECL显影观察转染质粒对靶基因蛋白的影响。不同时间重复6次实验。
1.4 统计学处理
表2 引物信息Tab. 2 Primer information
2 结 果
2.1 生物信息学预测
为探讨可能调控Aurora-B基因的miRNA分子,本研究采用靶基因在线预测软件(http:// www.targetscan.org)对指定基因Aurora-B进行预测。结果显示,Aurora-B可能是let-7a/b/c/d/e/f/ g/i、miR-98、miR-4458以及miR-4500的靶基因(图1)。
2.2 Aurora-B基因可能是Let-7家族成员Let-7a/b/c/d/e/f/g/i的靶基因
荧光海肾素实验对let-7家族进行预测分析结果显示,let-7a/b/c/d/e/f/g/i突变型中的荧光海肾素酶活性相对于野生型显著增高(图2)。
2.3 let-7a/g/i负向调控Aurora-B基因在骨肉瘤细胞中表达
为验证let-7a/b/c/d/e/f/g/i是否负向调控Aurora-B基因在骨肉瘤细胞中的表达,我们分别采用let-7a/b/c/d/e/f/g/i mimics转染骨肉瘤细胞系U2-OS和HOS细胞,RTFQ-PCR检测细胞中let-7a/b/c/d/e/f/g/i及Aurora-B mRNA的表达;Western blot检测Aurora-B相关蛋白的表达。与阴性对照组相比,let-7a/g/i表达上调的细胞中Aurora-B mRNA及蛋白表达水平显著降低;结果显示,在骨肉瘤细胞中,let-7a/g/i表达上调可以抑制Aurora-B的表达(图3~5)。
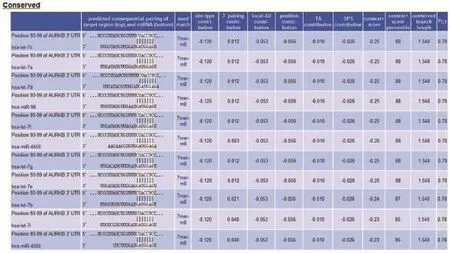
图1 靶基因在线预测结果(http://www.targetscan.org)Fig. 1 The result of the bioinformatics prediction (http://www.targetscan.org)
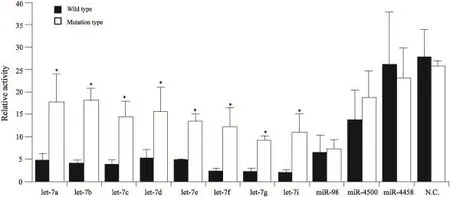
图2 荧光海肾素实验结果显示Aurora-B可能是let-7a/b/c/d/e/f/g/i的靶基因Fig. 2 The result of Luciferase assays showed that Aurora-B may be the target gene of let-7a/b/c/d/e/f/g/i
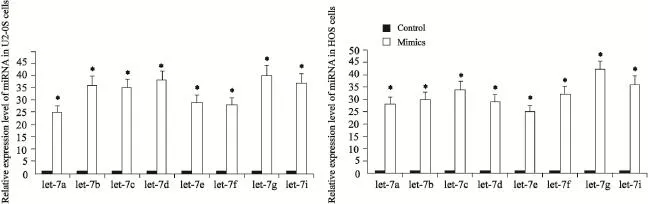
图3 RTFQ-PCR检测结果显示转染mimics细胞中let-7a/b/c/d/e/f/g/i的表达量显著高于未转染细胞Fig. 3 The result of RTFQ-PCR showed that the expression level of let-7a/b/c/d/e/f/g/i in U2-OS and HOS cells transfected with mimics was significantly higher compared to the control group
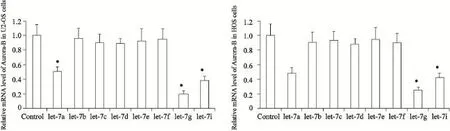
图4 上调let-7a/b/c/d/e/f/g/i后U2-OS和HOS细胞中Aurora-B mRNA水平Fig. 4 The relative Aurora-B mRNA level in let-7a/b/c/d/e/f/g/i up-regulated U2-OS and HOS cells
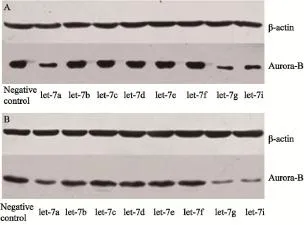
图5 Western blot检测let-7a/g/i表达上调后Aurora-B蛋白在骨肉瘤细胞系U2-OS及HOS中的表达水平Fig. 5 The expression of Aurora-B in let-7a/g/i up-regulated U2-OS and HOS cells by Western blot
3 讨 论
骨肉瘤是好发于儿童和青少年的一种恶性骨肿瘤,大约占恶性骨肿瘤的35%[4]。随着新辅助化疗药物的出现,骨肉瘤患者生存时间显著延长,但是近几十年来全球骨肉瘤的5年总生存率仍然徘徊不前[5],其根本原因在于骨肉瘤患者在临床确诊时,80%的患者已经发生肺转移[6]。而肺转移是骨肉瘤患者最主要的死亡原因。因此,深入研究骨肉瘤侵袭转移发生、发展的分子机制对提高骨肉瘤转移的疗效具有特殊意义。
有研究[7-8]表明,Aurora激酶家族成员参与细胞有丝分裂中的多个过程,包括着丝粒的复制、双极纺锤体的形成等,其家族成员中的Aurora-B激酶位于染色体17p13.1,是一类负责调控细胞有丝分裂的丝氨酸/苏氨酸激酶,它在有丝分裂的过程中起着调节染色体浓缩、双极定向和分离、调节细胞质分裂的作用。Aurora-B的过表达会在有丝分裂的过程中产生多处缺陷,包括失去着丝点附着微管和未经过分裂后期及细胞质分裂就完成有丝分裂、细胞染色体数目加倍、再经过多轮复制染色体发生随机丢失和产生非整倍染色体、进而导致癌变的可能等。由于Aurora-B激酶的生物学功能注定了其原癌基因的角色,故已引起研究者的重视。Aurora-B在多种恶性肿瘤中呈高表达状态,如肝癌[9]、多发性骨髓瘤[10]及肺癌[11-12]等,这都意味着Aurora-B可能与肿瘤的发生、发展有着密切的关系,被认为扮演着原癌基因的角色[13]。本研究的前期研究发现,Aurora-B在骨肉瘤组织中过度表达,并且可能与肺部转移呈正相关,而抑制Aurora-B在骨肉瘤细胞中的表达能诱导细胞凋亡、抑制增殖及迁移、侵袭[14]。
近年microRNA的发现为研究肿瘤转移的基因表达调控机制提供了新的视角。在真核生物中,除了反义RNA在翻译水平的调节作用以及RNA干扰(RNA interference,RNAi)机制在转录后水平通过降解特异mRNA阻遏基因表达外,microRNA在基因调控中同样也起着重要作用。microRNA具有调节细胞分化、增殖、死亡(主要是凋亡)、发育和代谢等功能。这些生物学效应是通过调控信号分子(如细胞因子、生长因子及转录因子等)的表达而实现。近年来,大量研究证实,microRNA不仅参与肿瘤的发生、增殖及凋亡,并且对肿瘤的转移具有调节作用[15-17]。至今为止,已发现超过1 000种人类microRNA,据推测它们可能调控着人类基因组内1/3以上基因的表达,寻找microRNA分子及其靶基因的研究已成为基因调控研究领域的重要分支和热点。近期的研究显示,let-7的表达与多种肿瘤的发生、发展有关[17-18]。本研究采用生物信息学预测及荧光海肾素实验分析发现,Aurora-B基因很可能是let-7a/b/c/d/e/f/g/i的靶基因。为探讨在骨肉瘤细胞中Aurora-B基因是否受let-7a/b/c/d/e/f/g/i的调控,本研究采用let-7家族成员mimics转染骨肉瘤细胞系U2-OS细胞和HOS细胞,经RTFQ-PCR和Western blot检测结果显示,Aurora-B在let-7a/g/i表达上调细胞中的表达水平显著低于其在阴性对照细胞中的表达,但是,在let-7d/b/c/e表达上调的细胞中Aurora-B表达水平无明显下调(与阴性对照细胞组比),这提示let-7a/g/i能负向调控Aurora-B在骨肉瘤细胞中的表达。
总之,本研究结果提示let-7a/g/i可以负向调控Aurora-B在骨肉瘤细胞中的表达,这为进一步研究Aurora-B在骨肉瘤侵袭转移中的作用及调控机制提供了帮助。
[1] 刘志礼, 尹庆水, 舒 勇, 等. Aurora-B, Ki-67在骨肉瘤中的表达及与远处转移的关系[J]. 解放军医学杂志, 2010, 36(10): 1092-1094.
[2] 罗 ? 刘志礼, 舒 勇, 等. Aurora-B在骨肉瘤中的表达及与远处转移的关系[J]. 中国现代医学杂志, 2011, 21(14): 1611-1619.
[3] ZHU X P, LIU Z L, PENG A F, et al. Inhibition of Aurora-B suppresses osteosarcoma cell migration and invasion[J]. Exp Ther Med, 2014, 7(3): 560-564.
[4] KIM S Y, HELMAN L J. Strategies to explore new approaches in the investigation and treatment of osteosarcoma[J]. Cancer Treat Res, 2009, 152(): 517-528.
[5] NISWANDER L M, KIM S Y. Stratifying osteosarcoma: minimizing and maximizing therapy[J]. Curr Oncol Rep, 2010, 12(4): 266-270.
[6] MUNAJAT I, ZULMI W, NORAZMAN M Z, et al. Tumour volume and lung metastasis in patients with osteosarcoma[J]. J Orthopaedic Surg (Hong Kong), 2008, 16(2): 182-185.
[7] PRIGENT C, GILL R, TROWER M, et al. In silico cloning of a new protein kinase, Aik2, related to drosophila Aurora using the new tool: EST blast[J]. Silico Biol, 1999, 1(2): 123-128.
[8] KATAYAMA H, OTA T, MORITA K, et al. Human AIM-1: cDNA cloning and reduced expression during endomitosis in megakaryocyte-lineage cells[J]. Gene, 1998, 224(1-2): 1-7.
[9] YASEN M, MIZUSHIMA H, MOGUSHI K, et al. Expression of Aurora B and alternative variant forms in hepatocellular carcinoma and adjacent tissue[J]. Cancer Sci, 2009, 100 (3):472-480.
[10] EVANS R P, NABER C, STEFFLER T, et al. The selective Aurora B kinase inhibitor AZD1152 is a potential new treatment for multiple myeloma[J]. Br J Haematol, 2008, 140(3): 295-302.
[11] 付达华, 熊典虹, 刘志礼, 等. Aurora-B 激酶在肺腺癌组织中的表达及其临床意义[J]. 南昌大学学报: 医学版, 2010, 50(2): 31-34.
[12] TAKESHITA M, KOGA T, TAKAYAMA K, et al. Aurora-B overexpression is correlated with aneuploidy and poor prognosis in non-small cell lung cancer[J]. Lung Cancer, 2013, 80(1): 85-90.
[13] MERALDI P, HONDA R, NIGG E A. Aurora kinases link chromosome segregation and cell division to cancer susceptibility[J]. Curr Opin Genet Dev, 2004, 14(1): 29-36.
[14] 刘志礼, 王 高, 舒 勇, 等. Aurora-B激酶特异性抑制剂AZD1152-HQPA对人骨肉瘤细胞株U2-OS细胞的抑制作用[J]. 南昌大学学报: 医学版, 2010, 50(10): 30-36.
[15] WANG W, DAI L X, ZHANG S, et al. Regulation of epidermal growth factor receptor signaling by plasmid-based microRNA-7 inhibits human malignant gliomas growth and metastasis in vivo[J]. Neoplasma, 2013, 60(3): 274-283.
[16] MAO J H, ZHOU R P, PENG A F, et al. MicroRNA-195 suppresses osteosarcoma cell invasion and migration in vitro by targeting VCP[J]. Oncol Lett, 2012, 4(5): 1125-1129.
[17] LONG X H, MAO J H, PENG A F, et al. Tumor suppressive microRNA-424 inhibits osteosarcoma cell migration and invasion via targeting fatty acid synthase[J]. Exp Ther Med, 2013, 5(4): 1048-1052.
[18] YANG W H, LAN H Y, TAI S K, et al. Repression of bone morphogenetic protein 4 by let-7i attenuates mesenchymal migration of head and neck cancer cells[J]. Biochem Biophys Res Commun, 2013, 29, 433(1): 24-30.
Let-7a/g/i targeted to Aurora-B in human osteosarcoma cells
ZHOU Yunfei, LIU Jiaming, CHEN Xuanyin, ZHU Liangbo, LONG Xinhua, ZHOU Yang, ZHANG Zhihong, LIU Zhili (Department of Orthopedics, the 1stHospital of Nanchang University, Nanchang 330006, Jiangxi Province, China)
LIU Zhili E-mail: zgm7977@163.com
Background and purpose:MicroRNA(miRNA) is a class of small non-coding RNA playing an important regulatory role in many tumors. This study investigated which miRNA might negatively regulate the expression of Aurora-B in osteosarcoma cells, and to lay the foundation for the further investigation of the effort and regulation of Aurora-B in osteosarcoma malignant phenotype.Methods:Bioinformatics prediction software (http:// www.targetscan.org) and luciferase assays were used to investigate which miRNA might target to modulate the Aurora-B. Real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR) and Western blot assay were used to further verify which miRNA could negative regulate the expression of Aurora-B gene.Results:Bioinformatics prediction showed let-7 family have the possibility to modulate the expression of Aurora-B; Luciferase assays showed that Aurora-B might be the target gene of let-7a/b/c/d/e/f/g/i; RTFQ-PCR and Western blot analysis testified that both the expression levels of Aurora-B mRNA and Aurora-B protein were significantly decreased in Let-7a/g/i up-regulated U2-OS and HOS cells, compared to the cells in the negative control group; but in Let-7b/c/d/e/f up-regulated U2-OS and HOS cells, the expression levels of Aurora-B mRNA and Aurora-B protein have no significant difference, compared to the cells in the negative control group.Conclusion:Let-7a/g/i may downregulate the expression of Aurora-B in human osteosarcoma cells.
Osteosarcoma; let-7; Aurora-B
10.3969/j.issn.1007-3969.2015.12.008
R738.6
A
1007-3639(2015)12-0966-06
2014-07-09
2014-09-16)
刘志礼 E-mail:zgm7977@163.com

