血清PARP-1蛋白高表达在胃癌中的临床意义
王 睿,王 岚,黎明新,朱明艳,刘 新
1.沈阳医学院附属中心医院检验科,辽宁 沈阳110024;2.沈阳医学院病原生物学教研室,辽宁 沈阳 110034
血清PARP-1蛋白高表达在胃癌中的临床意义
王 睿1,王 岚2,黎明新1,朱明艳1,刘 新2
1.沈阳医学院附属中心医院检验科,辽宁 沈阳110024;2.沈阳医学院病原生物学教研室,辽宁 沈阳 110034
背景与目的:PARP-1与恶性肿瘤密切相关。该研究旨在考察血清PARP-1蛋白水平在胃癌发生、发展中的临床意义。方法:收集145例胃癌患者血样以及112例健康体检者血清样本,应用酶联免疫吸附试验法检测血清中幽门螺杆菌(Helicobacter pylori,Hp)特异性IgA和PARP-1蛋白水平,并分析血清PARP-1蛋白水平与胃癌临床特征的相关性。结果:与健康人相比,胃癌患者血清PARP-1蛋白显著增高[(407±139) pg/mLvs(258±120) pg/mL,P=0.014];Hp阳性胃癌患者PARP-1的表达水平显著高于Hp阴性患者(P<0.001);血清PARP-1蛋白水平与胃癌患者的胃癌家族史(P=0.033)和饮酒史(P=0.015)有着显著正相关性;与血清PARP-1蛋白阴性的患者相比,PARP-1蛋白阳性的胃癌患者的总体生存期显著缩短(P=0.011);多变量COX回归分析未发现血清PARP-1蛋白水平为影响胃癌患者总体生存期的独立风险因素。结论:血清PARP-1蛋白高表达可能参与胃癌的发生、发展,抑制PARP-1有可能成为治疗胃癌的潜在新靶点。
胃癌;PARP-1;血清;幽门螺杆菌
胃癌是严重影响人们健康的常见恶性肿瘤之一。虽然近年来胃癌的治疗方法取得了较大发展,但胃癌在我国仍然属于常见的消化系统恶性肿瘤之一,其发病率及病死率均居于各种恶性肿瘤前列。PARP-1[poly(ADP-ribose)polymerases 1]是催化聚ADP 核糖化的重要功能酶,在DNA损伤修复、基因组稳定性、细胞周期调控、能量代谢、凋亡和肿瘤发生的过程中均发挥重要作用[1]。PARP-1与多种恶性肿瘤密切相关,在胃癌领域,目前多见PARP-1基因单核酸多态性(single nucleotide polymorphism,SNP)与胃癌的相关性研究[2-3],PARP-1蛋白水平与胃癌的相关性研究国内外均鲜见报道。本研究通过检测胃癌患者及健康体检者的血清标本中PARP-1蛋白含量,分析PARP-1水平与胃癌的发病以及相关临床特征的相关性,探讨血清PARP-1蛋白水平在胃癌中的临床意义。
1 材料和方法
1.1 病例血清标本
本课题组集中收集了2008年1月—2009年12月在沈阳医学院附属中心医院检验科送检的血液样本,包括确诊为胃癌的患者残留化验血样145例,以及健康体检者残留的化验血样112例。对于残留的血样标本,每例收集1 mL,室温静置30 min后离心收集血清,血清样本于-80 ℃深度冷冻冰箱中保存备用。
1.2 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血清中幽门螺杆菌(Helicobacter pylori,Hp)特异性IgA水平
取出-80 ℃保存的血清样本,解冻后应用ELISA检测试剂盒[KA0964,中国台北亚诺法生技股份有限公司]检测血清中人Hp特异性IgA水平,具体操作按试剂盒说明书进行,以试剂盒提供的标准品所作的质控曲线相关系数R2为0.999 3。
1.3 ELISA法检测血清中PARP-1蛋白水平
血清样本解冻后应用ELISA检测试剂盒[ABIN367354,联世生物科技(上海)有限公司]检测血清中人PARP-1蛋白水平,具体操作按试剂盒说明书进行,以试剂盒提供的标准品所作的质控曲线相关系数R2为0.999 0。
1.4 ELISA检测结果的分层
对于通过ELISA法测得的Hp特异性IgA水平和PARP-1蛋白水平,采用ROC曲线分析法,在检测值的诊断灵敏度与特异度之和最大时,判定上述两个指标在诊断胃癌时的分界值。
1.5 统计学处理
结果数据分析均采用SPSS 16.0软件包进行操作。ELISA法检测结果以表示,确定计量资料诊断二分类资料的分界值时采用ROC曲线分析法,计量资料的组间比较采用单因素方差分析(One-Way ANOVA)进行,计数资料之间的相关性分析采用Pearson卡方检验(χ2test)、Fisher确切概率法或Pearon相关分析进行,采用logrank检验绘制Kaplan-Meier曲线,采用Cox回归进行多变量生存分析。P<0.05为差异有统计学意义。
2 结 果
2.1 患者病例临床特征及预后资料
145例胃癌患者均为未经放化疗治疗的首诊患者。其中男性89例,女性56例,年龄22~74岁,有胃癌家族史(患者所在家族有多人患有胃癌)者32例,有吸烟史(连续或累积吸烟大于等于6个月)者76例,有饮酒史(每日酒精摄入量大于125 mL,持续时间大于等于6个月)者62例。根据胃癌Borrmann分型:Ⅰ型患者12例,Ⅱ型患者20例,Ⅲ型患者98例,Ⅳ型患者15例;发生淋巴结转移患者89例,未发生淋巴结转移患者56例;TNM分期Ⅰ期患者23例,Ⅱ期患者35例,Ⅲ期患者53例,Ⅳ期患者34例。同时,我们还收集了患者通过13C尿素呼气试验诊断的Hp感染情况,其中Hp阳性88例,Hp阴性57例。112例健康体检者中,男性70例,女性42例,年龄25~75岁。
145例胃癌患者给与临床治疗后,课题组定期随访患者预后情况,随访期6~68个月,定义患者确诊后至患者死亡或随访终点的时间为总生存期(overall survival,OS)。患者中71例因癌症死亡,平均OS为(47.9±18.5)个月。
2.2 胃癌患者血清中Hp特异性IgA和PARP-1蛋白水平
ELISA检测结果显示,145例胃癌患者血清中Hp特异性IgA含量为0.44±0.13(D值),112例健康体检者血清中Hp特异性IgA含量为0.28±0.11(D值)。与健康人相比,胃癌患者血清中Hp特异性IgA含量显著增高(P=0.008,图1A)。ROC曲线分析显示,Hp特异性IgA含量大于等于0.37时有患胃癌的趋势,故定义大于等于0.37为Hp特异性IgA阳性,小于0.37为Hp特异性IgA阴性(图1B)。按照该分层标准,胃癌患者中Hp特异性IgA阳性者92例,阴性者53例,与应用13C尿素呼气试验法诊断的Hp感染情况除仅有10例结果相悖外,有135例完全吻合(r=0.855,P<0.001),其中85例为Hp阳性,50例为Hp阴性。
145例胃癌患者血清中PARP-1蛋白含量为(407±139) pg/mL,112例健康体检者血清中PARP-1蛋白含量为(258±120) pg/mL,与健康人相比,胃癌患者血清中PARP-1蛋白含量显著增高(P=0.014,图1C)。ROC曲线分析显示,PARP-1蛋白含量大于等于366 pg/mL时有患胃癌的趋势(图1D),故定义大于等于366 pg/mL为PARP-1蛋白阳性,小于366 pg/mL为PARP-1蛋白阴性。按照该分层标准,胃癌患者中PARP-1蛋白阳性者108例,阴性者37例。
按照ELISA法和尿素呼气试验法均诊断为Hp阳性的85例胃癌患者中,PARP-1蛋白阳性者74例(87.1%),Hp阴性的50例患者中PARP-1蛋白阳性者28例(56.0%),可见Hp阳性患者PARP-1的表达水平显著高于Hp阴性者(P<0.001)。
2.3 胃癌患者血清PARP-1蛋白水平与临床特征的相关性
应用Pearson卡方检验或Fisher确切概率法分析胃癌患者血清PARP-1蛋白水平与临床特征的相关性(表1),结果发现,在有胃癌家族史(P=0.033)和饮酒史(P=0.015)的胃癌患者中,PARP-1蛋白水平显著增高。PARP-1蛋白水平在不同Borrmann分型的胃癌间差异有统计学意义(P=0.002)。而在具有不同年龄段、性别、吸烟史的胃癌患者中,PARP-1蛋白水平差异无统计学意义(P>0.05)。
2.4 胃癌患者血清PARP-1蛋白水平对患者生存期的影响
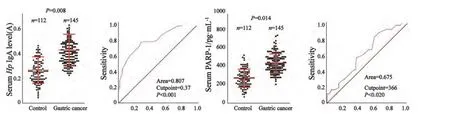
图 1 ELISA法检测血清中Hp特异性IgA和PARP-1蛋白水平Fig. 1 The Hp specific IgA level and PARP-1 protein level detected by ELISA method in the serum samples
采用log-rank检验绘制Kaplan-Meier曲线分析血清PARP-1蛋白水平对胃癌生存期的影响,结果发现,与血清PARP-1蛋白阴性者相比,PARP-1蛋白阳性的胃癌患者具有较短的OS(P=0.011)。单变量Cox回归进行生存分析发现(表2),胃癌家族史、吸烟史、饮酒史、Borrmann分型、淋巴结转移、TNM分期、Hp感染(尿素呼气试验法和ELISA法)、血清PARP-1蛋白均是影响患者OS的危险因素;进一步纳入此8项参数,以年龄进行校正,进行多变量Cox回归生存分析发现(表2),胃癌家族史(P=0.030)、Borrmann分型(P=0.025)、TNM分期(P=0.044)、Hp感染(尿素呼气试验法,P=0.027;ELISA法,P=0.042)为影响患者OS的独立风险因素。
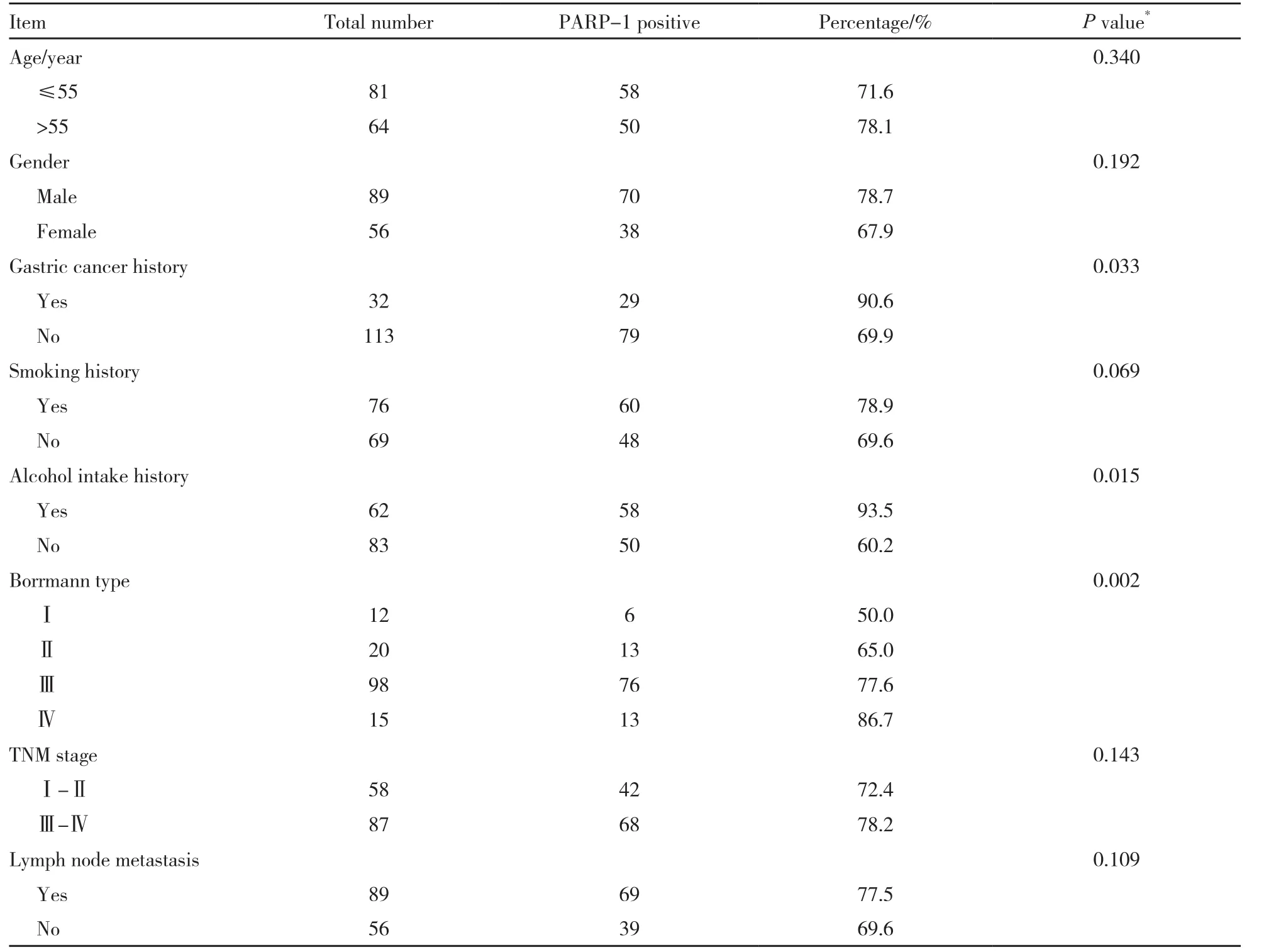
表 1 血清PARP-1蛋白水平与胃癌患者临床特征的相关性Tab. 1 The association of serum protein level with clinical pathological characters in gastric cancer patients
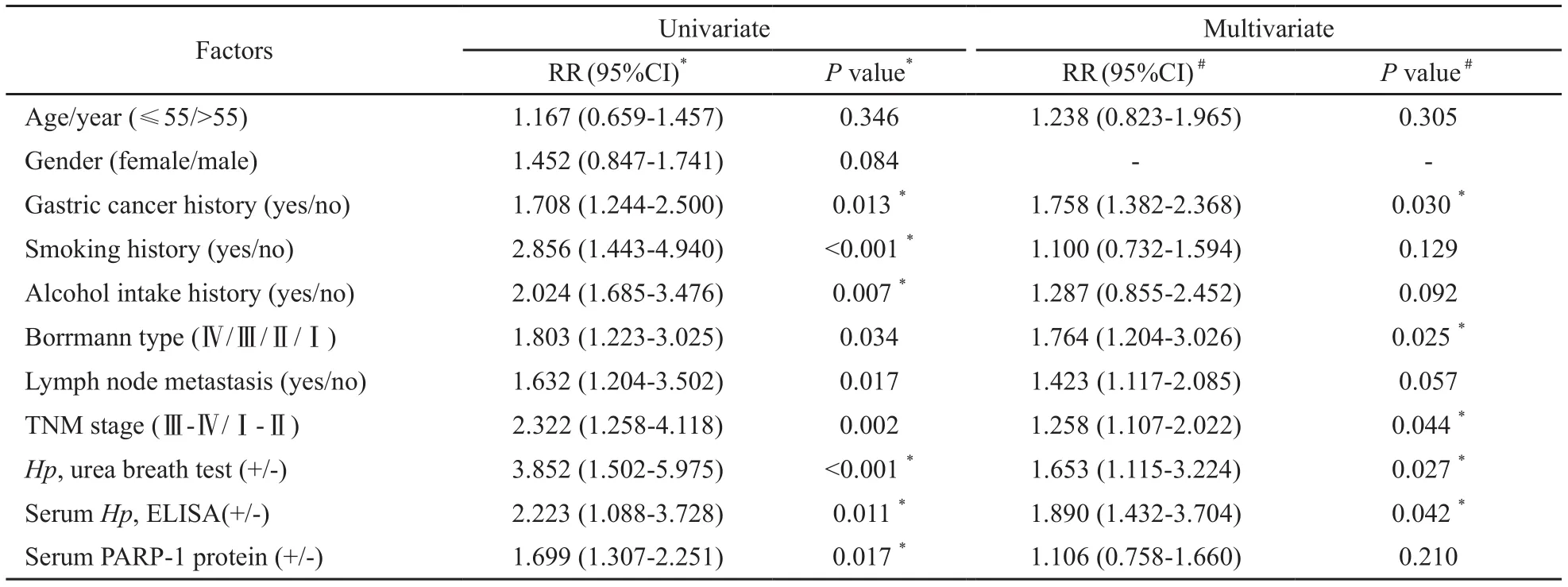
表 2 COX回归分析临床参数与胃癌患者OS的相关性Tab. 2 Cox regression analysis of clinical data correlated with OS in gastric cancer
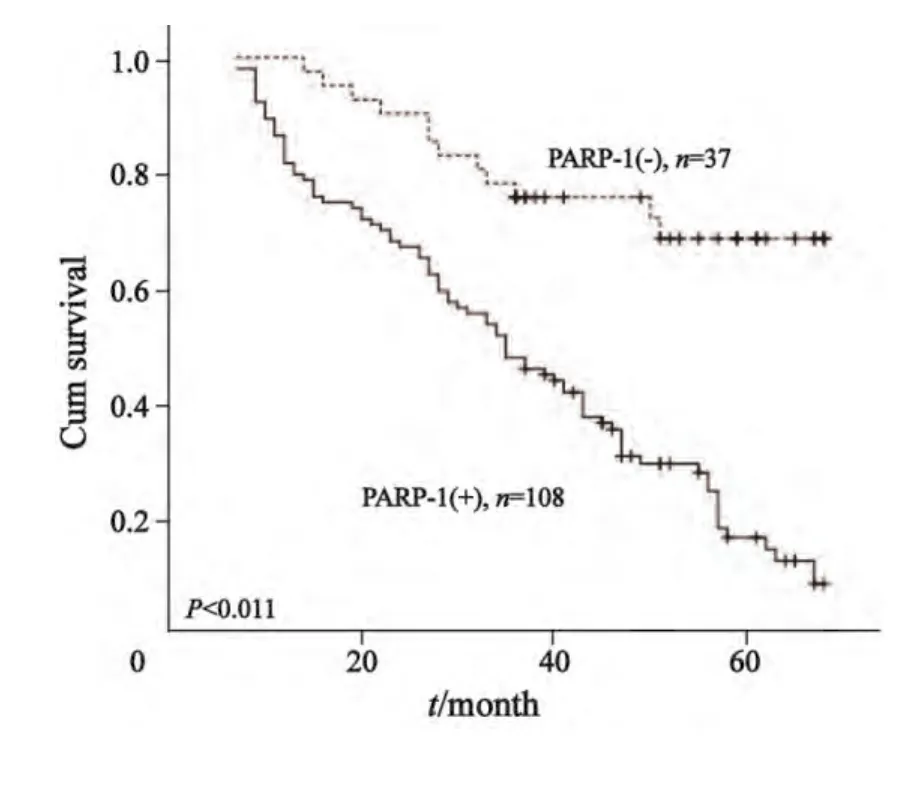
图 3 PARP-1蛋白表达水平对胃癌患者OS的影响Fig. 3 The inf l uence of PARP-1 protein level on OS in gastric cancer
3 讨 论
本研究首次检测了血清PARP-1蛋白水平对于胃癌的临床意义。我们通过ELISA法检测并比较了健康人群和胃癌患者的血清PARP-1蛋白水平,发现胃癌患者的血清PARP-1蛋白水平显著增高。Hp是公认的胃癌发病相关因子之一,因此我们收集了患者的Hp诊断结果(13C尿素呼气试验)。同时我们进一步应用ELISA法检测了血清中Hp特异性IgA含量,以判断患者Hp感染情况。通过尿素呼气试验和ELISA法联合对比,我们选取了两种方法诊断结果一致的135例患者,分析PARP-1与Hp感染的相关性,结果发现,Hp阳性患者PARP-1的表达水平显著高于Hp阴性患者。Nossa等[4-5]的研究发现Hp感染可激活PARP-1活性,上调其表达水平。我们的结果与之一致,这说明PARP-1可能在与Hp感染密切相关的胃癌发病过程中发挥一定的作用。
本研究进一步分析了血清PARP-1蛋白水平与胃癌患者的临床特征及生存期的相关性。我们发现,有胃癌家族史和饮酒史的胃癌患者的血清PARP-1蛋白水平均显著增高。这可能是因为有家族史的患者体内PARP-1蛋白调控机制出现异常,导致血清PARP-1蛋白水平升高;而长期饮酒者,酒精造成胃黏膜等的刺激损伤,可能会激发参与DNA修复、维持细胞存活的PARP-1蛋白表达上调。并且,血清PARP-1蛋白水平与主要依据组织学浸润深度而划分的胃癌Borrmann分型密切相关,浸润较深的Ⅲ、Ⅳ型有较高的血清PARP-1蛋白水平;另外,血清PARP-1蛋白阳性的胃癌患者DFS及OS显著缩短。可见PARP-1与胃癌的发病关系密切,其阳性表达是造成患者生存期缩短的危险因素。但是多变量Cox回归进行生存分析,未发现PARP-1是影响DFS或OS的独立风险因素,这可能是由于PARP-1与Hp感染、胃癌家族史和饮酒史等显著相关的原因。
PARP-1通过对DNA损伤进行修复,进而参与细胞的多种生物学行为,其高表达在多种疾病的发病中发挥重要作用,因而抑制PARP-1功能活性成为治疗许多疾病的新靶点[6-7]。在胃肠道疾病领域,Sánchez-Fidalgo等[8]在用化学物质诱导结肠溃疡大鼠模型研究的结果显示,应用PARP-1抑制剂可以显著下调损伤组织中过氧化物酶活性和前列腺素E2的表达水平,可能有益于溃疡的治疗;Le等[9]发现PARP-1抑制剂可以提高顺铂对人胃癌细胞的毒性;Liu等[10]研究发现木鳖子提取物可通过下调PARP-1表达,显著抑制人胃癌细胞的存活率。因此抑制PARP-1有可能成为胃癌治疗的潜在靶点。
我们的研究发现胃癌患者存在血清PARP-1蛋白高表达,并且与患者的Hp感染、胃癌家族史和饮酒史等临床特征显著相关,与患者无溃疡生存期缩短显著相关,这说明PARP-1可能参与胃癌的发生、发展过程,抑制PARP-1有可能成为治疗胃癌的新方向。
[1]HAKMÉ A, WONG H K, DANTZER F, et al. The expanding field of poly(ADP-ribosyl)ation reactions. ‘Protein modifications: Beyond the usual suspects’ review series[J].EMBO Rep, 2008, 9(11): 1094-100.
[2]ZHANG Q, LI Y, LI X, et al. PARP-1 Val762Ala polymorphism, CagA+ H. pylori infection and risk for gastric cancer in Han Chinese population[J]. Mol Biol Rep, 2009,36(6): 1461-1467.
[3]KIM J, PYUN J A, CHO S W, et al. Lymph node metastasis of gastric cancer is associated with the interaction between poly(ADP-ribose) polymerase 1 and matrix metallopeptidase 2[J]. DNA Cell Biol, 2011, 30(12): 1011-1017.
[4]NOSSA CW, JAIN P, TAMILSELVAM B, et al. Activation of the abundant nuclear factor poly(ADP-ribose) polymerase-1 byHelicobacter pylori[J]. Proc Natl Acad Sci USA, 2009,106(47): 19998-20003.
[5]NOSSA C W, BLANKE S R.Helicobacter pyloriactivation of PARP-1: usurping a versatile regulator of host cellular health[J]. Gut Microbes, 2010, 1(6): 373-378.
[6]MOHAMMAD G, SIDDIQUEI M M, ABU EL-ASRAR A M. Poly (ADP-ribose) polymerase mediates diabetesinduced retinal neuropathy[J]. Mediators Inflamm, 2013:510451[Epub ahead of print].
[7]赵 岩, 林添雨, 孙 茹, 等. 抑制PARP-1活性对博来霉素诱导的肺纤维化的改善作用[J]. 吉林大学学报: 医学版, 2015, 41(3): 442-447.
[8]SÁNCHEZ-FIDALGO S, VILLEGAS I, MARTÍN A, et al.PARP inhibition reduces acute colonic inflammation in rats[J]. Eur J Pharmacol, 2007, 563(1-3): 216-23.
[9]LE T V, SUH J H, KIM N, et al. In silico identification of poly(ADP-ribose)polymerase-1 inhibitors and their chemosensitizing effects against cisplatin-resistant human gastric cancer cells[J]. Bioorg Med Chem Lett, 2013, 23(9):2642-2646.
[10]LIU H R, MENG L Y, LIN Z Y, et al. Cochinchina momordica seed extract induces apoptosis and cell cycle arrest in human gastric cancer cells via PARP and p53 signal pathways[J].Nutr Cancer, 2012, 64(7): 1070-1077.
The clinical significance of serum PARP-1 protein high expression in gastric cancer
WANG Rui1, WANG Lan2, LI Mingxin1, ZHU Mingyan1, LIU Xin2(1. Department of Laboratory, the Central Hospital Affiliated to Shenyang Medical College, Shenyang 110024, Liaoning Province, China;2. Department of Pathogenic Biology, Shenyang Medical College, Shenyang 110034, Liaoning Province,China)
LIU Xin E-mail: sy_liuxin2000@126.com
Background and purpose: PARP-1 is closely related to malignant tumors. This study aimed to explore the clinical significance of serum level of PARP-1 protein in onset and progression of gastric cancer. Methods: The serum samples from 145 patients with gastric cancer and 112 healthy check-up cases were collected. The serumHPspecificity IgA and PARP-1 protein levels were detected using enzyme-linked immunosorbent assay method. The correlation of serum PARP-1 protein levels with clinical characteristics of gastric cancer was analyzed. Results: Compared with healthy people, serum PARP-1 protein levels were significantly higher in gastric cancer patients [(407±139) pg/mLvs(258±120)pg/mL,P=0.014). Serum PARP-1 protein levels were significantly higher inHp(+) gastric cancer patients than those in patients withHp(-) (P<0.001). Serum PARP-1 protein levels were positively correlated with family gastric cancer history(P=0.033) and alcohol intake history (P=0.015) in gastric cancer patients. Compared with serum protein PARP-1 negative patients, PARP-1 protein positive patients had a significantly shorter cancer-free survival (P=0.011). However serum PARP-1 protein level was not found to be an independent risk factor for the overall survival of gastric cancer patients using multivariate COX regression. Conclusion: High expression of serum PARP-1 protein may be involved in the pathogenesis and progression of gastric cancer. Inhibition of PARP-1 may be potential new target for the treatment of gastric cancer.
Gastric cancer; PARP-1; Serum;Helicobacter pylori
10.3969/j.issn.1007-3969.2015.12.009
R735.2
A
1007-3639(2015)12-0972-06
刘 新 E-mail:sy_liuxin2000@126.com
2015-05-20
2015-11-10)

