BTG1对喉癌细胞增殖和凋亡的影响及其机制研究
姜润学,胡万宁,孙国贵,李 军,韩晓晨,蔡海峰
1.河北联合大学附属唐山市人民医院头颈外科,河北 唐山063000;
2.河北联合大学附属唐山市人民医院放化疗科,河北 唐山063000
BTG1对喉癌细胞增殖和凋亡的影响及其机制研究
姜润学1,胡万宁1,孙国贵2,李 军1,韩晓晨1,蔡海峰1
1.河北联合大学附属唐山市人民医院头颈外科,河北 唐山063000;
2.河北联合大学附属唐山市人民医院放化疗科,河北 唐山063000
背景与目的:在多种细胞中B细胞易位基因1(B-cell translocation gene 1,BTG1)能够抑制细胞增殖,促进细胞凋亡,调节细胞周期进程及分化。该研究通过体外实验探讨BTG1高表达对喉癌Hep-2细胞增殖、凋亡及细胞周期的影响及其相关作用机制。方法:构建pEGFP-N1-BTG1,培养并转染喉癌Hep-2细胞,分为实验组(转染pEGFP-N1-BTG1的Hep-2细胞)和对照组(转染pEGFP-N1空质粒的Hep-2细胞)。采用蛋白[质]印迹法(Western blot)检测两组细胞中BTG1蛋白的表达水平;应用MTT法检测细胞的增值活性;使用流式细胞术检测细胞周期分布和磷脂酰丝氨酸外翻分析(Annexin Ⅴ-FITC/PI)检测细胞凋亡;采用Western blot法检测细胞周期调控蛋白Cyclin D1、凋亡相关蛋白Bcl-2表达情况。结果:成功构建pEGFP-N1-BTG1,Western blot检测结果显示,实验组细胞中BTG1蛋白表达水平明显高于对照组细胞(0.921±0.091 vs 0.308±0.047,P<0.05)。实验组与对照组细胞相比,从第24 h实验组细胞生长速度减慢,细胞增值能力降低,两组比较差异有统计学意义(P<0.05);实验组细胞中Cyclin D1蛋白表达水平下降(0.436±0.023 vs 0.916±0.092,P<0.05),细胞周期的G0/G1期细胞比例升高[(85.1±5.2)% vs (63.8±3.1)%,P<0.05)];S期细胞比例降低[(8.3±1.1)% vs (23.1±1.5)%,P<0.05];实验组细胞Annexin Ⅴ增多,细胞早期凋亡率升高[(10.3±1.1)% vs (2.8±0.3)%,P<0.05],抗凋亡蛋白Bcl-2表达水平降低(0.167±0.009 vs 0.834±0.084,P<0.05)。结论:BTG1高表达能明显抑制喉癌Hep-2细胞的生长增殖、诱导凋亡,其可能的机制与BTG1参与细胞周期调控、诱导细胞凋亡相关。
喉癌;BTG1;增殖;凋亡;细胞周期
B细胞易位基因1(B-cell translocation gene 1, BTG1) 在许多肿瘤组织中表达水平低下,但在体外实验中使其过量表达时则表现为肿瘤细胞的增殖和转移能力降低,凋亡增加[1-3]。因此,其可能是一种新型的抑癌基因并已受到广泛关注。喉癌是一种头颈部常见的预后较差的恶性肿瘤。本研究试图通过对喉癌Hep-2细胞株转染BTG1基因,以探讨该基因的高表达在体外对喉癌细胞增殖、凋亡的影响,以期为探讨喉癌治疗的新途径提供实验基础。
1 材料和方法
1.1 材料
人喉癌上皮细胞Hep-2购自上海拜力生物科技有限公司,质粒pEGFP-N1、XhoⅠ内切酶、KpnⅠ内切酶、T4连接酶购自宝生物工程(大连)有限公司,质粒pDonR223-BTG1购自长沙爱科博生物科技有限公司,LipofectamineTM2000、DH5a感受态细胞购自美国Invitrogen公司,鼠抗人BTG1单克隆抗体、鼠抗人Bcl-2单克隆抗体、鼠抗人CyclinD1单克隆抗体、鼠抗人β-actin单克隆抗体购自美国Santa Cruz公司,辣根过氧化酶标记的二抗(山羊抗鼠)购自北京中杉金桥生物技术有限公司,ECL发光试剂购自上海碧云天生物技术有限公司,高纯度质粒小提中量试剂盒购自天根生化科技(北京)有限公司,10%胎牛血清购自HyClone公司,DMEM完全培养基购自美国Gibco公司,BCA蛋白浓度测定试剂盒购自北京赛驰生物科技有限公司,PVDF膜购自Millipore公司,Annexin Ⅴ-FITC/PI凋亡试剂盒、MTT购自美国Sigma公司生物科技有限公司。
1.2 实验方法
1.2.1 细胞培养
用含10%胎牛血清的 DMEM 完全培养基培养细胞,置于37 ℃、CO2体积分数为5%饱和湿度的培养箱中;每周传代2次,用0.25%胰酶消化细胞。
1.2.2 pEGFP-N1-BTG1构建与鉴定
根据人BTG1 cDNA序列(NM_001731)设计B T G 1基因扩增引物,序列如下: 5’-CGCCTCGAGATGCATCCCTTCTAC-3’(上游)和5’-CGCGGTACCTCA CCTGATACAGT CATC-3’(下游)。上游引物包含XhoⅠ限制性内切酶位点,下游引物包含KpnⅠ限制性内切酶位点。引物由南京金斯瑞基因科技有限公司合成。PCR反应体系:10×PCR缓冲液5 µL,引物顺义链1 µL,引物反义链1 µL,dNTPs(10 mmol/L) 1 µL,pDonR223-BTG1 2 µL,Taq DNA聚合酶0.5 µL,ddH2O 39.5 µL,共计50 µL。反应条件:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。反应结束后进行1.2%的琼脂糖凝胶电泳,然后对目的片段进行回收。对回收后的片段以及pEGFP-N1载体进行XhoⅠ和KpnⅠ双酶切反应,反应体系:BTG1 36 µL,XhoⅠ2 µL,KpnⅠ 2 µL,10×缓冲液H 5 µL,ddH2O 5 µL,总共50 µL。pEGFP-N1 6 µL,XhoⅠ 1 µL,KpnⅠ 1 µL,10×缓冲液H 2 µL,ddH2O 10 µL,共20 µL。对以上酶切体系放置37 ℃水浴反应4 h后,进行1.5%的琼脂糖凝胶电泳鉴定,然后回收目的片段。并进行连接反应:BTG1酶切产物3.0 µL,pEGFP-N1 1.0 μL,10×T4连接酶缓冲液2.0 µL,T4连接酶1.0 µL,ddH2O 13.0 µL,混匀,16 ℃反应过夜。之后转化到DH5a感受态细胞中。挑取阳性克隆进行质粒提取备用,并将阳性克隆送交美国Invitrogen公司进行DNA序列测定。
1.2.3 Hep-2细胞株的瞬时转染
Hep-2细胞分成两组分别转染pEGFPN 1-B T G 1和p E G F P-N 1空质粒。采用LipofectaminTM2000转染试剂按其说明严格进行操作。
1.2.4 蛋白[质]印迹法(Western blot)检测转染后两组细胞BTG1蛋白及两组细胞中Cyclin D1、Bcl-2蛋白的表达情况
用IP裂解液分别提取两组细胞的蛋白质,用BCA蛋白浓度测定试剂盒测定蛋白浓度。每孔上样量为50 μg行聚丙烯酰胺凝胶电泳(SDSPAGE),稳压冰浴电转至PVDF膜上,用5%脱脂奶粉封闭PVDF膜2 h,加入一抗(1∶500的BTG1抗体),4 ℃摇床过夜,加入二抗(以辣根过氧化酶HRP 标记),室温温育2 h,杂交膜以ECL化学发光试剂在暗室中显影并曝光,以β-actin作为内参。Western blot法检测Cyclin D1、Bcl-2蛋白,一抗分别为Cyclin D1、Bcl-2抗体,具体操作步骤同前。
1.2.5 MTT实验检测高表达BTG1体外对喉癌Hep-2细胞增殖的影响
取对数生长期的两组细胞胰酶消化并制成等浓度分别加于96孔培养板内,每孔内加5 000个细胞,分别培养24、48、72和96 h,结束培养4 h前每孔加MTT溶液[5 mg/mL用PBS (pH<7.4)]20 μL在37 ℃下继续培养,到达时间后结束培养,弃去上清液,在每孔中加入异丙醇150 μL,摇荡10 min待结晶溶解后在酶标仪上测定490 nm波长的各孔光密度(D)值,以时间为横坐标、D值为纵坐标,将记录的结果绘制细胞生长曲线。
1.2.6 磷脂酰丝氨酸外翻分析检测细胞凋亡
取转染48 h后的两组细胞胰酶消化,悬浮细胞(1×106个)用PBS洗2次,加入100 μL结合缓冲液和FITC标记的Annexin Ⅴ(20 μg/mL)10 μL,室温避光放置30 min,再加入PI(50 μg/mL)5 μL,避光反应5 min后,加入400 μL结合缓冲液,立即用流式细胞仪检测。
1.2.7 流式细胞术检测细胞周期
取转染48 h后的两组细胞胰酶消化,离心去除上清液,用预冷的PBS液洗细胞2次,预冷70%乙醇,-20 ℃固定保存24 h。离心(800 r/min)固定的细胞5 min,去除乙醇,收集细胞,以1 mL的PBS洗细胞1次,加入500 μL PBS含50 μg/mL碘化丙啶(PI),100 μg/mL RNase A,4 ℃避光温育20 min。用流式细胞仪按照标准程序进行检测,汞激发波长488 nm,计数10 000个细胞,结果用MultiCycle软件分析,分别计算G0/ G1期、S期和G2/M期细胞的相对比例。
1.3 统计学处理
2 结 果
2.1 重组质粒pEGFP-N1-BTG1构成的鉴定
将pEGFP-N1-BTG1重组质粒进行XhoⅠ和KpnⅠ双酶切反应,酶切后的产物进行1.5%琼脂糖凝胶电泳图谱分析,如图1双酶切电泳图谱显示516 bp(BTG1序列大小)和4.7 kb(pEGFP-N1序列大小)的目的条带。

图1 双酶切电泳图Fig. 1 Electrophoresis pattern of double enzyme
该质粒行DNA序列测定显示与GenBank数据库中收录的人类B T G 1基因序列(NM_001731)一致,表明BTG1 cDNA已经成功克隆至pEGFP-N1载体。测序结果如下:ATGCATCCCTTCTACACCCGGGCCGCCACCA TGATAGGCGAGATCGCCGCCGCCGTGTCCT TCATCTCCAAGTTTCTCCGCACCAAGGGGC TCACGAGCGAGCGACAGCTGCAGACCTTCA GCCAGAGCCTGCAGGAGCTGCTGGCAGAA CATTATAAACATCACTGGTTCCCAGAAAAGC CATGCAAGGGATCGGGTTACCGTTG TATTCGCATCAACCATAAAATGGATCCTCTG ATTGGACAGGCAGCACAGCGGATTGG ACTGAGCAGTCAGGAGCTGTTCAGG CTTCTCCCAAGTGAACTCACACTCTGGGTT GACCCCTATGAAGTGTCCTACAGAATTGGA GAGGATGGCTCCATCTGTGTGCTGTATGA AGCCTCACCAGCAGGAGGTAGCACTCAAAA CAGCACCAACGTGCAAATGGTAGACA GCCGAATCAGCTGTAAGGAGGAACTTCTCT TGGGCAGAACGAGCCCTTCCAAAAACTA CAATATGATGACTGTATCAGGTTAA。
2.2 Hep-2细胞株中BTG1蛋白表达鉴定
采用Western blot法检测两组细胞中BTG1蛋白表达水平,从图2中可以看出,转染BTG1的实验组细胞中BTG1蛋白表达水平明显高于未转染BTG1的对照组Hep-2细胞(0.921±0.091 vs 0.308±0.047,P<0.05)。从实验结果可以清楚地看到,BTG1基因已经成功转染进入喉癌Hep-2细胞中,而且可以使转染细胞BTG1蛋白表达得到明显提高。
2.3 MTT实验检测BTG1体外对喉癌Hep-2细胞生长的影响
经MTT实验检测发现,与对照组细胞相比较,从第24 h实验组细胞生长即明显降低,相对增值能力下降,D值明显降低。各个时间点两组比较差异均有统计学意义(P<0.05,图3)。本实验结果表明,提高BTG1表达对喉癌Hep-2细胞生长具有明显的抑制作用。
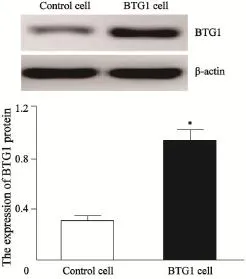
图2 Western blot鉴定BTG1蛋白的表达Fig. 2 Identification of the expression of BTG1 protein by Western blot

图3 BTG1高表达对细胞增殖的影响Fig. 3 The effects of BTG1 overexpression on the cell proliferation
2.4 BTG1对喉癌Hep-2细胞凋亡的影响
采用Annexin Ⅴ分析法检测结果显示,实验组细胞中早期凋亡率为(10.3±1.1)%,而对照组细胞早期凋亡率为(2.8±0.3)% 。两者比较,实验组早期凋亡率明显高于对照组,差异有统计学意义(P<0.05,图4A、B)。
2.5 BTG1对喉癌Hep-2细胞周期的影响
应用流式细胞仪分析两组细胞周期分布显示,实验组中,G0/G1期细胞所占比例明显高于对照组细胞[(85.1±5.2)% vs (63.8±3.1)%,P<0.05];而S期细胞明显低于对照组细胞[(8.3±1.1)% vs (23.1±1.5)%,P<0.05];G2/ M期细胞与对照组细胞无明显差异(P>0.05)。本实验结果显示,使BTG1基因表达水平提高可以影响喉癌Hep-2细胞的细胞周期分布,BTG1可以导致Hep-2细胞G0/G1期阻滞,S期细胞明显减少,G2/M期细胞阻滞不明显(图5A、B)。
2.6 BTG1对喉癌Hep-2细胞Cyclin D1、Bcl-2蛋白的影响
Western blot检测结果显示,实验组细胞中Cyclin D1、Bcl-2蛋白表达水平均明显低于对照组细胞(0.436±0.023 vs 0.916±0.092和 0.167±0.009 vs 0.834±0.084, P<0.05)。作为内参的β-actin蛋白表达基本一致,说明Cyclin D1、Bcl-2蛋白表达水平的下降是由于BTG1基因表达水平提高所致。Cyclin D1为细胞周期蛋白,调控细胞周期变化;Bcl-2为抗细胞凋亡蛋白,阻碍细胞凋亡。本实验结果表明,在实验组细胞中BTG1基因高表达从而下调Cyclin D1、Bcl-2蛋白表达水平是导致Hep-2细胞G0/G1阻滞和促进Hep-2细胞凋亡的机制之一(图6A、B)。

图4 BTG1高表达对细胞凋亡的影响Fig. 4 The effects of BTG1 overexpression on the cell apoptosis

图5 BTG1高表达对细胞周期的影响Fig. 5 The effects of BTG1 overexpression on the cell cycle

图6 高表达BTG1对Cyclin D1和Bcl-2的影响Fig. 6 The effects of BTG1 overexpression on Cyclin D1 and Bcl-2
3 讨 论
喉癌在所有癌症中所占的比例超过3%,其已成为全球第六位最常见的癌症[4]。尽管不断改进喉癌的诊断和治疗方法,但是在过去20年里其患者生存期并没有得到显著改善。喉癌的形成是一个长时期、多因素参与、多阶段的过程,这一过程会有多个癌基因的突变、抑癌基因的失活以及凋亡调节基因和DNA修复基因的改变等,需有众多基因参与其中。在恶性肿瘤形成过程中目前已知有众多癌基因及抑癌基因起着重要作用,当抑癌基因缺失或突变导致其表达异常从而常会引起细胞不受调控的增殖进而导致恶性肿瘤的发生。只有对喉癌的遗传基础及其发生的分子机制进行深入的研究和不断的探索,才会在临床中对喉癌的早期诊断、基因治疗和预后评价具有进一步的指导作用。
BTG1是BTG/TOB基因家族成员之一,BTG/ TOB家族包括BTG1、BTG2/PC3/Tis21、BTG3/ ANA、BTG4/PC3B、Tob1/Tob及Tob2等6种基因,最初BTG1为慢性B淋巴细胞性白血病染色体在t(8;12)(q24;q22)进行易位相关的基因进行克隆得到[5]。20世纪90年代初法国Rouault等[6]从淋巴母细胞中分离出5620 bP的BTG1基因全长cDNA, 其定位在12q22染色体,mRNA 长度为1.8 kb,编码相对分子质量为19×103的蛋白。已知该家族所有成员都具有抑制细胞增殖及负向调控细胞周期的功能。BTG/TOB家族的主要特点是具备多个氨基酸N末端区域,被称为BTG/TOB同源域。这个同源域结构包括A盒和B盒,均为较短并且高度保守的同源区,A盒具有抗增殖作用,B盒具有和许多靶分子结合的功能[7]。
在喉癌的发生、发展中肿瘤细胞异常生长增殖发挥着重要的作用,正常情况下应该凋亡的细胞未发生凋亡而继续生存,显示出恶性增长行为[8]。本研究通过脂质体转染法而明显提高了BTG1表达水平的喉癌Hep-2细胞进行MTT细胞生长增殖实验检测,结果发现,高表达 BTG1 蛋白的Hep-2细胞株生长减慢,增殖明显受到抑制,说明BTG1在其中发挥了重要的生物学作用,且随着作用时间的延长表现出与对照组细胞体外增殖能力差异的显著增大。本实验采用流式细胞仪检测细胞周期实验中提高喉癌Hep-2细胞中BTG1的表达量,结果发现实验组G0/G1期细胞所占比例升高,S期细胞比率减少,Hep-2细胞被阻滞在G0/G1期,这一检测结果所显示通过诱导细胞G0/G1期阻滞来抑制喉癌Hep-2细胞的生长是BTG1的一重要分子机制。Western blot检测还发现转基因细胞中Cyclin D1蛋白表达明显降低,表明BTG1高表达抑制细胞生长,诱导细胞周期的阻滞,可能与BTG1使细胞周期蛋白Cyclin D1表达下降有关。Cyclin D1被认为是一种原癌基因,是Cyclin D家族基因的重要成员,在人类多种肿瘤组织中高表达或存在突变[9]。Cyclin D家族还包括Cyclin D2、Cyclin D3,其功能与Cyclin D1相似,可以形成CDK4/Cyclin D以及CDK6/Cyclin D复合物,促进G1/S期转换的发生。有研究[10-11]结果显示,BTG1基因家族中BTG2和TOB2也能够使得细胞周期蛋白表达下调。本研究结果显示,BTG1基因是一个喉癌细胞增殖抑制基因,其作用机制之一是通过CDK/Cyclin D1途径参与并影响肿瘤细胞周期的调控。
细胞凋亡在生理或病理条件下均可发生,其是一种自发的、程序化的细胞死亡过程。在其发生过程中会受到体内、外许多因素的影响并涉及到一系列相关基因的变化[12]。增强对肿瘤细胞的诱导,促进其凋亡也是肿瘤基因治疗的又一有效途径。我们在Annexin Ⅴ实验中发现,提高喉癌Hep-2细胞中BTG1的表达,可以诱导细胞凋亡。Corjay等[13]对患有遗传性高脂血症的人群进行研究时发现,含有大量巨噬细胞组织内的凋亡细胞中BTG1会出现高表达现象。Lee等[14]经过实验证实,在脑胶质细胞瘤细胞凋亡的过程当中BTG1发挥着积极的促进作用。Nahta等[15]研究证明,在Bcl-2的反义核酸介导乳腺癌MCF7细胞凋亡过程中BTG1出现高表达。我们随后通过Western blot检测发现,Hep-2细胞中抗凋亡蛋白Bcl-2表达明显下降,Bcl-2是重要的抗凋亡基因,同时又是癌基因,通过阻断内源性核酸内切酶的DNA剪切活性或抑制凋亡刺激信号从而起到阻滞细胞凋亡的作用。当某种因素使Bcl-2基因出现过度表达时,导致细胞不能启动正常的凋亡程序,细胞过长时期生存会促使肿瘤形成[16],并且高表达Bcl-2的肿瘤患者其预后较差[17-18]。本研究采用Annexin Ⅴ分析法检测了BTG1高表达对细胞凋亡的影响,实验结果显示转染BTG1的喉癌细胞早期凋亡率明显高于对照组(P<0.05),表明BTG1高表达能够诱导喉癌Hep-2细胞的凋亡。结合以上的研究结果,BTG1诱导喉癌Hep-2细胞凋亡的机制之一是通过下调Bcl-2的表达来实现的。
在急性B淋巴细胞性白血病患者中由于BTG1基因缺失而引起其低表达占9%,但是在急性T淋巴细胞性白血病患者中未发现此现象[19]。因此,BTG1表达与遗传及表观遗传的关系仍然有待我们进一步研究。在本实验中,我们在体外模型中论证了BTG1高表达能够影响喉癌细胞周期调控蛋白、抗凋亡蛋白的表达水平,可以使喉癌细胞发生细胞周期阻滞,通过上述的作用能够使喉癌细胞的增殖生长受到抑制,诱导凋亡。
[1] ZHAO Y, GOU W F, CHEN S, et al. BTG1 expression correlates with the pathogenesis and progression of ovarian carcinomas[J]. Int J Mol Sci, 2013, 14(10): 19670-19680.
[2] 曹倪豪, 陈明. BTG1在肾透明细胞癌组织中的表达及对786-O细胞株增殖和凋亡的影响[J]. 东南大学学报: 医学版, 2011, 30(4): 583-587.
[3] ZHU R, ZOU S T, WAN J M, et al. BTG1 inhibits breast cancer cell growth through induction of cell cycle arrest and apoptosis[J]. Oncol Rep, 2013, 30(5): 2137-2144.
[4] SIEGEL R, WARD E, BRAWLEY O, et al. Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J]. CA Cancer J Clin, 2011, 61(4): 212-236.
[5] RIMOKH R, ROUAULT J P, WAHBI K, et al. A chromosome 12 coding region is juxtaposed to the MYC protooncogene locus in a t(8;12)(q24;q22) translocation in a case of B-cell chronic lymphocytic leukemia[J]. Genes Chromosomes Cancer, 1991, 3(1): 24-36.
[6] ROUAULT J P, RIMOKH R, TESSA C, et al. BTG1, a member of a new family of antiproliferative genes[J]. EMBO, 1992, 11(4): 1663-1670.
[7] WINKLER G S. The mammalian anti-proliferative BTG/Tob protein family[J]. J Cell Physiol, 2010, 222(1): 66-72.
[8] MARTINEZ-OUTSCHOORN U E, PAVLIDES S, SOTGIA F, et al. Mitochondrial biogenesis drives tumor cell proliferation[J]. Am J Pathol, 2011, 178(5): 1949-1952.
[9] KOFF A, CROSS F, FISHER A, et al. Human cyclin E, a new cyclin that interacts with two members of the CDC2 gene family[J]. Cell, 1991, 66(6): 1217-1228.
[10] IKEMATSU N, YOSHIDA Y, KAWAMURA-TSUZUKU J, et al. Tob2, a novel anti-proliferative Tob/BTG1 family member, associates with a component of the CCR4 transcriptional regulatory complex capable of binding cyclin-dependent kinases[J]. Oncogene, 1999, 18(52): 7432-7441.
[11] TIRONE F. The gene PC3(TIS21/BTG2), prototype member of the PC3/BTG/TOB family: regulator in control of cell growth, differentiation, and DNA repair?[J]. J Cell Physiol, 2001, 187(2): 155-165.
[12] NICHOLSON D W, THORNBERRY N A. Apoptosis, life and death decisions[J]. Science, 2003, 299(5604): 214-215.
[13] CORJAY M H, KEARNEY M A, MUNZER D A, et al. Antiproliferative gene BTG1 is highly expressed in apoptotic cells in macrophage-rich areas of advanced lesions in Watanabe heritable hyperlipidemic rabbit and human[J]. Lab Invest, 1998, 78(7): 847-858.
[14] LEE H, CHA S, LEE M S, et al. Role of antiproliferative B cell translocation gene-1 as an apoptotic sensitizer in activationinduced cell death of brain microglia[J]. J Immunol, 2003, 171(11): 5802-5811.
[15] NAHTA R, YUAN L X, FITERMAN D J, et al. B cell translocation gene 1 contributes to antisense Bcl-2-mediated apoptosis in breast cancer cells[J]. Mol Cancer Ther, 2006, 5(6): 1593-1601.
[16] VAUX D L, CORY S, ADAMS J M, et al. Bcl-2 gene promotes haemopoietic cell survival and cooperates with c-myc to immortalize Pre-B cells[J].Nature, 1988, 335(6189): 440-442.
[17] ERMIAH E, BUHMEIDA A, KHALED B R, et al. Prognostic value of bcl-2 expression among women with breast cancer in Libya[J]. Tumour Biol, 2013, 34(3): 1569-1578.
[18] GU Y, PAN Y, MENG B, et al. High levels of bcl-2 protein expression do not correlate with genetic abnormalities but predict worse prognosis in patients with lymphoblastic lymphoma[J]. Tumour Biol, 2013, 34(3): 1441-1450.
[19] WAANDERS E, SCHEIJEN B, VAN DER MEER, et al. The origin and nature of tightly clustered BTG1 deletions in precursor B-cell acute lymphoblastic leukemia support a model of multiclonal evolution[J]. PLoS Genet, 2012, 8: e1002533.
The effect of BTG1 overexpression on the proliferation and apoptosis of laryngeal cancer cells and its molecular mechanism in vitro
JIANG Runxue1, HU Wanning1, SUN Guogui2, LI Jun1, HAN Xiaochen1,CAI Haifeng1(1.Department of Head and Neck Surgery, Tangshan People’s Hospital of Hebei United University, Tangshan 063000, Hebei Province, China; 2.Department of Chemoradiotherapy, Tangshan People’s Hospital of Hebei United University, Tangshan 063000, Hebei Province, China)
HU Wanning E-mail: rmyy_hwn@163.com
Background and purpose:B-cell translocation gene 1(BTG1) can inhibit cell proliferation, promote cell apoptosis and regulate cell cycle progression and differentiation in a variety of cell types. This study aimed to explore the influence on cell proliferation, apoptosis and cell cycle and its related mechanism of laryngeal cancer Hep - 2 cell lines through BTG1 overexpression by in vitro experiments.Methods:The BTG1 expression plasmids were constructed and transfected into Hep-2. They were divided into experimental group (transfected BTG1 of Hep-2 cells) and control group (transfected empty plasmid of Hep-2 cells). Western blot method was used to identify BTG1 protein expression levels of cells; proliferation activity of cells was detected by MTT assay; flow cytometry was used to analyze the cell cycle distribution and Annexin Ⅴ-FITC/PI cell apoptosis; Western blot was also used to assay cell cycle regulatory protein and apoptosis-related protein expression.Results:The pEGFP-N1-BTG1 plasmid was constructed successfully, and the expression of BTG1 protein was higher in experimental group than that in control group(0.921±0.091 vs 0.308±0.047, P<0.05). Compared with the two group of laryngeal cancer Hep-2 cells, the cell growth in experimental group was slowed down and the proliferation was reduced (P<0.05); Cyclin D1 protein expression level was decreased (0.436±0.023 vs 0.916±0.092, P<0.05), the proportion of G0/G1phase cell cycle was increased [(85.1±5.2)% vs (63.8±3.1)%, P<0.05], the proportion of S phase cell was decreased [(8.3±1.1)% vs (23.1±1.5)%, P<0.05], phosphatidylserine ectropion in experimental group was increased, cell early apoptosis was significant [(10.3±1.1)% vs (2.8±0.3)%, P<0.05] and anti-apoptotic protein Bcl-2 expression level was reduced(0.167±0.009 vs 0.834±0.084, P<0.05).Conclusion:BTG1 high expression could inhibit the proliferation growth of laryngeal Hep-2 cells and promote its apoptosis, and the possible mechanisms are interrelated with BTG1 involved in cell cycle regulation and causing cell apoptosis.
Laryngeal cancer; BTG1; Proliferation; Apoptosis; Cell cycle
10.3969/j.issn.1007-3969.2015.12.007
R739.63
A
1007-3639(2015)12-0959-07
2014-07-12
2015-03-25)
胡万宁 E-mail:rmyy_hwn@163.com

