花生发芽过程中脂氧合酶活力的变化
张雅君,杨 选,杨 震,韩永斌*
花生发芽过程中脂氧合酶活力的变化
张雅君,杨 选,杨 震,韩永斌*
(南京农业大学 农业部农畜产品加工与质量控制重点开放实验室,江苏 南京 210095)
选用“花育30号”品种作为实验材料,对花生脂氧合酶活力的测定体系进行优化,研究发芽过程中花生不同部位脂氧合酶活力的变化。结果表明:花生脂氧合酶活力测定的最适条件为:测定温度32℃,磷酸盐缓冲液pH 6.8,磷酸盐缓冲液浓度0.10 mol/L。发芽36 h时花生脂氧合酶活力最高,其后酶活力总体呈下降趋势。该酶在子叶和胚芽中的活力呈现出与全粒花生几乎相同的变化趋势,且胚芽中酶活力比子叶中酶活力低。
花生;发芽;脂氧合酶
花生(Arachis hypogaeaL.)为蝶形花科,落花生属植物,花生仁中脂肪含量为44.27%~58%,蛋白质含量25%~36%。在世界范围内,花生油占食用植物油年产量的14%,居世界第4位,花生植物蛋白资源居第3位,占世界植物蛋白年产量的11%,是重要的食用植物油和植物蛋白资源[1]。我国是世界三大花生主产国之一,总产量在1 000万t左右,约占世界总产量的30%以上,占我国油料作物总产量的50%左右,其单产、总产和出口量均居世界首位[2]。作为重要的油料资源,花生中有8种脂肪酸,其中油酸和亚油酸约占80%,具有较高的营养价值[3]。
脂氧合酶(lipoxygenase,LOX,EC 1.13.11.12),也称作脂肪氧化酶,是一种广泛存在于动植物体、真菌和细菌中的氧化还原酶[4-6]。LOX在生物体内的主要作用是催化含有顺,顺-1,4-戊二烯结构的多不饱和脂肪酸及其相应酯类的加氧反应,生成具有共轭双键的多不饱和脂肪酸氢过氧化物,统称为氧脂。谷物、豆类等种子中固有的LOX能催化不饱和脂肪酸过氧化,形成脂肪酸氢过氧化物从而对其营养价值和风味产生不良影响[7-9]。LOX也具有有利的一面,有研究表明在小麦粉中加入部分的大豆粉或是纯化的大豆LOX可以提高面筋筋力,改变面团的流变学性质,改善面团的稳定性并且具有增白剂的效果[10-13]。来源于大豆的LOX在大多数欧洲国家已被允许作为面粉酶制剂使用[14]。此外,在生物体外利用LOX氧化油脂产生的挥发性物质可以作为香精等天然的食品添加剂[15]。LOX在食品加工中的应用已经成为研究热点。
关于谷物豆类种子发芽过程中LOX活性变化的研究主要集中在大豆上,蒋和体等[16]研究发现大豆LOX活力随发芽时间延长而降低。而赵甲慧[17]研究发现大豆发芽后LOX活性总体提高,在芽长2 cm时活性最强,是未发芽种子中LOX酶活力的2倍左右。对于花生种子发芽方面的研究,目前主要集中在花生生理生化[18-19]、蛋白酶抑制剂[20]、过敏原[21]和贮藏蛋白种类及含量变化[22]方面。而对花生LOX的研究则主要集中在酶活性测定以及同工酶鉴定等方面[23]。花生发芽过程中LOX活性变化规律的相关研究尚未见报道。因此,本实验拟检测发芽处理过程中LOX活力的变化,旨在探索花生发芽过程中LOX的变化规律,为研究LOX在花生发芽过程中的作用提供基础数据。
1 材料与方法
1.1材料与试剂
供试花生为“花育30号”,由徐州金农种子公司提供,4℃避光保存。将发芽处理的花生每隔12 h取样,因花生芽苗在发芽96 h后长出侧根及嫩叶,并且芽苗已出现木质化,故后面实验均采用发芽96 h以内的花生作为研究材料。
磷酸二氢钠、磷酸氢二钠(分析纯)汕头市西陇化工厂;牛血清白蛋白(albumin from bovine serum,BSA)(生化试剂)上海蓝季科技发展有限公司;考马斯亮蓝G-250(生化试剂)中国医药集团上海化学试剂公司;亚油酸钠(分析纯)阿拉丁试剂有限公司。
1.2仪器与设备
HH-6型数显恒温水浴锅常州国华电器有限公司;JA2003型电子天平上海精密科学仪器有限公司;UV-2802型紫外-可见分光光度计尤尼柯(上海)仪器有限公司;PGX-250智能光照培养箱宁波海曙赛福实验仪器厂;BX-801贝欣智能芽菜机沈阳梦飞扬科技有限公司;Orion818型pH测试仪默飞世尔科技(中国)公司;H1650-W台式高速离心机湖南湘仪公司;TDL-40B离心机上海安亭科学仪器厂。
1.3方法
1.3.1花生LOX粗酶液的提取
粗酶液的提取参考文献[24]的方法做部分调整:将5 g去红衣花生加入40 mL磷酸盐缓冲液(0.05 mol/L,pH 7.0)于冰浴下研磨成匀浆后4℃、12 000 r/min离心40 min,取上清液于4℃冰箱保存备用。
1.3.2 LOX活力测定方法
根据文献[24]方法,经过调整后采用3 mL反应体系,以亚油酸钠为底物。取磷酸盐缓冲溶液2.90 mL、花生LOX粗酶液60μL、5 mmol/L的亚油酸钠40μL混合均匀,在234 nm波长处观察OD234nm的变化,每10 s记数1次,5 min后停止记录,平行测定5次,结果取平均值,绘制OD234nm变化曲线,选取OD234nm随时间变化呈线性且斜率最大的部分计算酶活力。以每分钟OD234nm增加0.01所需的酶量作为LOX的一个酶活力单位(U)。
1.3.3 LOX活力测定方法的优化
1.3.3.1温度对LOX活力的影响
选择0.05 mol/L pH 7.0的磷酸盐缓冲液,温度设置在18~40℃,每2℃一个梯度,共11个梯度。测定前水浴保温30 min,其他实验步骤同1.3.2节。
1.3.3.2 pH值对LOX活力的影响
在优化的温度条件下选择0.05 mol/L的磷酸盐缓冲液,pH值分别为6.0、6.5、7.0、7.5、8.0,其他实验步骤同1.3.2节。在此梯度下的最适pH值周围设置更小的pH值梯度进行再次验证,以确定最佳反应pH值。
1.3.3.3磷酸盐缓冲液浓度对LOX活力的影响
在优化的温度及磷酸盐缓冲液pH值条件下,设置磷酸盐缓冲液浓度分别为0.05、0.10、0.15、0.20 mol/L进行实验,其他实验步骤同1.3.2节。
1.3.4花生发芽过程中LOX活力测定
参照Uwaegbute等[25]的方法,根据花生的发芽特性,经过多次实验做出部分修改。花生种子经过筛选、除杂后,于体积分数为1%的次氯酸钠溶液中浸泡30 min,后每隔10 min用去离子水冲洗,冲洗数次后于30℃条件下黑暗浸泡12 h,用去离子水润洗数次后置于发芽机中于培养箱中30℃黑暗条件下发芽,每隔24 h换水一次,发芽时间共96 h,每隔12 h取样,液氮速冻,存于-20℃冰箱中备用。将种胚芽和子叶剥离,测定不同发芽时间花生种子不同部位的LOX活力。蛋白质的测定采用考马斯亮蓝G-250法。
1.4数据统计分析
实验设3次重复,数据采用Microsoft Excel和SPSS 19.0统计分析软件进行统计分析,显著性水平设定P<0.05。
2 结果与分析
2.1花生LOX活力测定方法的优化
2.1.1酶活力测定时间范围的确定
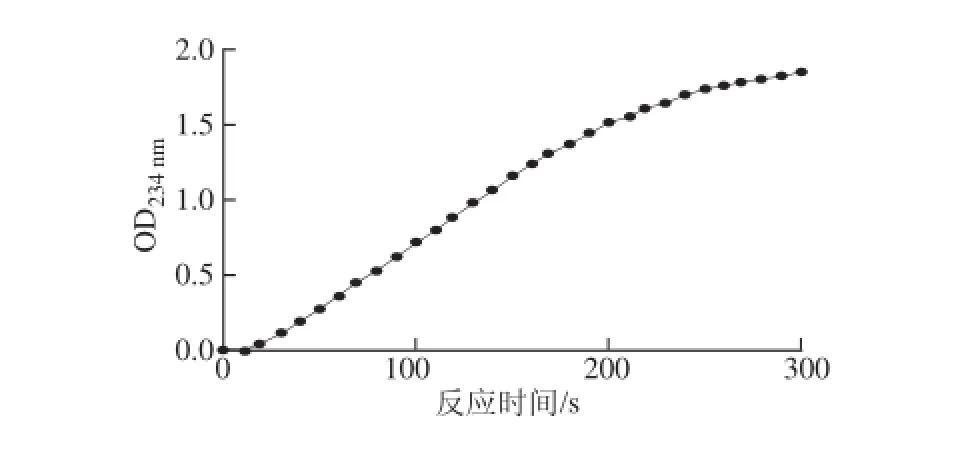
图1 OD 1 OD234nm34nm随时间的变化Fig.1 Curve showing absorbance at 234 nm as a function of reaction time
由图1可知,花生LOX促反应曲线属于典型的“S”型曲线,前20 s是酶促反应启动阶段,OD234nm在此时间段内略有波动,20 s后酶液与底物充分接触后开始呈直线上升,反应开始150 s后酶促反应趋于平缓直至停止,因其在60~120 s期间OD234nm上升速率最大,在此时间范围内OD234nm上升幅度均可以准确代表酶活力大小。因此,本实验确定60~120 s为花生LOX活力的测定时间。

图2 温度对LOX活力的影响Fig.2 Effect of temperature on LOX activity
2.1.2温度对LOX活力的影响
由图2可知,花生LOX活力随着反应温度的升高,整体呈先升高后下降的趋势。在未达到酶的反应最适温度前,随着温度的升高,反应体系中酶的活化分子数增多,酶活力增加。在26~36℃酶活力较高,中间略有波动,在26℃和32℃时出现两个峰顶,酶活力显著高于其他温度下的酶活力,这可能是因为花生中不同同工酶的最适温度不同所致。其后LOX活力随着温度的升高而降低,可能是因为在较高的温度下,酶的二级结构发生改变,酶分子内部的有序排列受到破坏,导致酶活性降低[26]。王辉等[27]指出,大豆的LOX在体外的耐热性不高,在40℃保温30 min的酶活力只有在30℃保温30 min酶活力的50%。在32℃条件下LOX活性最高,因此酶活力测定体系中温度选择32℃。
2.1.3磷酸盐缓冲液pH值对LOX活力的影响
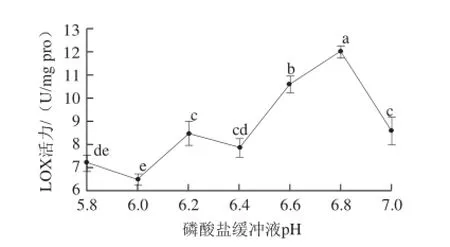
图3 磷酸盐缓冲液pH值对LOX活力的影响Fig.3 Effect of buffer solution pH on LOX activity
前期实验中发现当磷酸盐缓冲液的pH值在6.0~8.0范围内,LOX在pH 6.5处酶活力最高。为进一步确定LOX的最适pH值,在pH 5.8~7.0之间重新设置了6个梯度进行实验。pH值的变化会引起酶分子中活性必需基团解离状态的变化,影响酶分子与底物的结合。由图3可知,LOX活力随磷酸盐缓冲液pH值升高呈现整体先上升后下降的趋势,在pH 6.8处酶活力最高,所以酶活力测定体系中选择磷酸盐缓冲液pH值为6.8。
2.1.4磷酸盐缓冲液浓度对LOX活力的影响
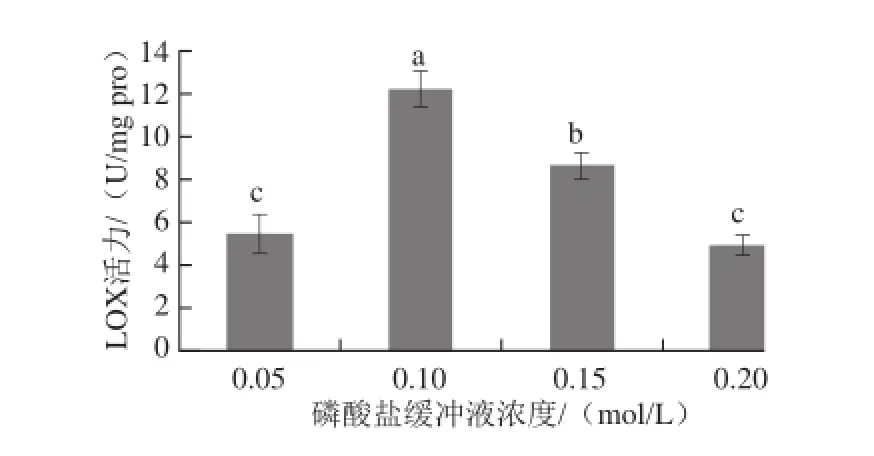
图4 磷酸盐缓冲液浓度对LOX活力的影响Fig.4 Effect of phosphate buffer solution concentration on LOX activity
缓冲液的浓度是影响酶催化活性的因素之一,由图4可知,当磷酸盐缓冲液浓度太高或太低时都会影响酶的催化效率,磷酸盐缓冲液浓度在0.10 mol/L时LOX活力显著高于其他浓度下的酶活力,所以酶活力测定体系中选择磷酸盐缓冲液浓度为0.10 mol/L。
由上述实验结果可以得出花生中LOX活力测定体系的条件:反应温度32℃,磷酸盐缓冲液pH 6.8,磷酸盐缓冲液浓度0.10 mol/L,此条件下LOX酶活力达12.23U/mg pro。侯美玲等[24]对“花育22号”中提取的LOX最适反应条件进行了优化,认为在pH 5.7、32℃、缓冲液浓度为0.10 mol/L的条件下显示出最佳酶活力。
2.2发芽过程中花生LOX活力的变化
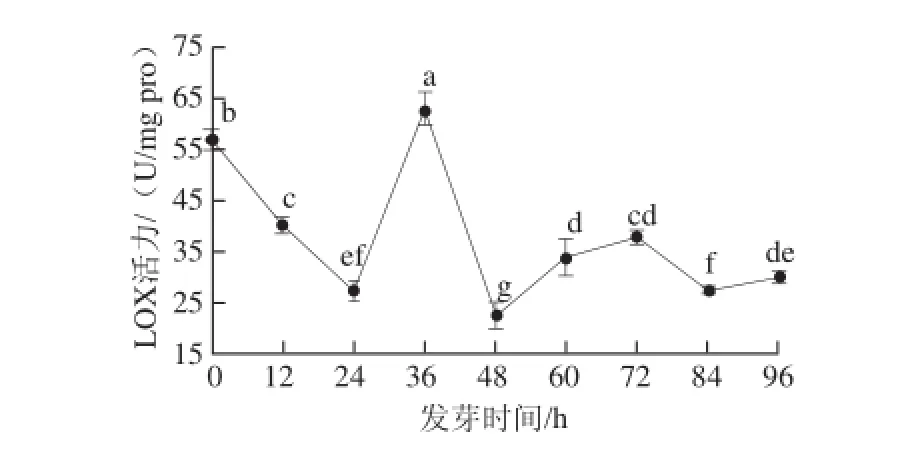
图5 全粒花生LOX活力随发芽时间的变化Fig.5 Curve showing LOX activity in peanut as a function of germination time
由图5可知,花生LOX活性随发芽时间的延长呈先下降后上升再下降又缓慢上升的变化趋势。发芽36 h时,酶活力达到最大,约为初始种子中酶活力的1.11倍。在发芽过程中,脂类物质在LOX和脂肪酶的作用下不断发生降解,为种子萌发和幼苗生长提供能量来源。花生种子在发芽24~36 h时处于旺盛期,LOX活力上升,可能是因为在种子萌发的早期阶段种子体内各种酶被启动,参与调节或触发细胞内各种化学反应过程,酶反应开始变得剧烈[28]。此后酶活力降低;中间60~72 h期间略有上升趋势,可能是因为花生LOX几种同工酶在不同发育阶段表达的结果。有研究发现在大豆某些发育阶段中会产生新的LOX同工酶[29]。
2.3发芽过程花生胚芽中LOX活力的变化
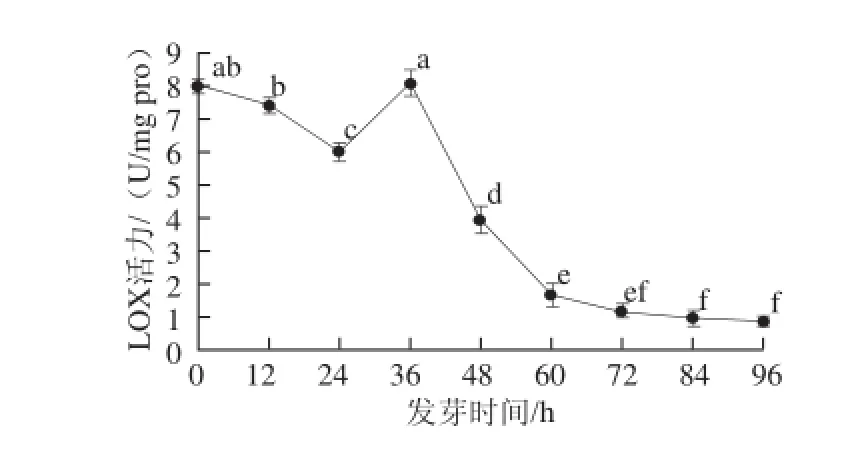
图6 花生胚芽中LOX活力随发芽时间的变化Fig.6 Change in LOX activity in peanut embryo during germination
如图6所示,花生胚芽中LOX活性变化同全粒花生在发芽初期相似,在12~24 h范围内显著下降,发芽36 h时,胚芽中LOX活力达到最大为8.1 U/mg pro,此趋势和全粒花生中酶活力变化趋势亦相同。发芽后期酶活力也迅速下降,并在随后的发芽过程中维持较低的水平,约为初始酶活力的10%。
2.4发芽过程花生子叶中LOX活力的变化
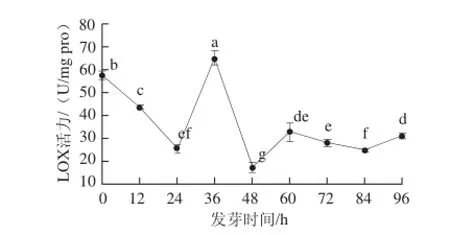
图7 花生子叶LOX活力随发芽时间的变化Fig.7 Change in LOX activity in peanut cotyledon during germination
如图7所示,在发芽初始至24 h期间,花生子叶中的LOX活力呈下降趋势。随着发芽的进行(24~36 h),种子吸胀完成,LOX的活力上升,子叶中LOX在发芽36 h时酶活力最大为63.10 U/mg pro,比未发芽种子(0 h)增加了约13%。花生子叶中含有大量油脂,主要是油酸和亚油酸,在花生萌发过程中,油脂作为主要的储能物质,在LOX和脂肪酶的作用下,分解为小分子物质并提供能量[30]。子叶部位中的LOX活力略高于全粒种子,这可能与此期间子叶中的LOX被激活和脂肪反应提供种胚发育所需的能量和营养有关;在水稻研究中也有类似报道[31]。已有的研究表明,大豆LOX同工酶随植株发育而产生较大变化,吸胀结束后在幼嫩快速生长的组织中通常都表现出很高的酶活性[32-33]。
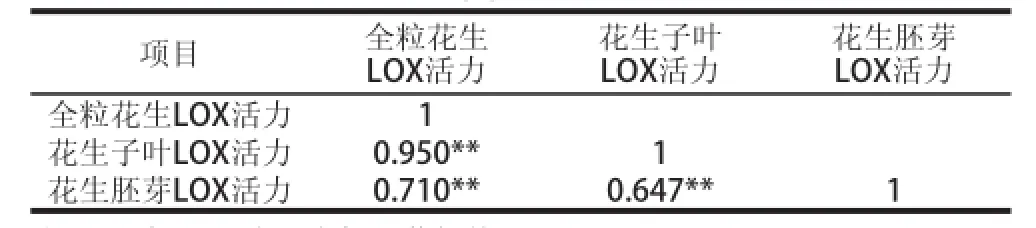
表1 花生发芽过程中全粒、子叶和胚芽中LOX活力的相关性分析Table 1 Correlation of LOX activity in different parts of peanut during germination
变量之间显著性值小于0.001,表示其相应的两个变量极显著相关。由表1可知,全粒花生LOX活力和花生子叶LOX活力以及花生胚芽LOX活力均极显著相关,全粒花生LOX活力与花生子叶LOX活力的相关系数高于全粒花生LOX活力与花生胚芽LOX活力的相关系数。花生子叶LOX活力和花生胚芽LOX活力极显著相关,但相关系数最小。LOX主要存在花生子叶中,在花生发芽过程中,子叶中的LOX起主要作用。
3 结 论
花生中LOX活力测定的最佳反应体系是:磷酸盐缓冲液浓度0.10 mol/L,pH 6.8,温度32℃,此条件下LOX酶活力达12.23 U/mg pro。花生发芽过程中无论在子叶还是胚芽中,LOX活力均在36 h达到最大值,分别为63.10 U/mg pro和8.1 U/mg pro,且均显著高于其他发芽时期。LOX活力在36 h后呈下降趋势,胚芽中LOX酶活力比全粒LOX酶活力下降速率更快。根据花生发芽过程中全粒、子叶以及胚芽中LOX活力的相关性分析,显示全粒花生酶活力与子叶和胚芽中酶活力极显著相关,并且全粒与子叶中LOX活力相关性大于其与胚芽中LOX活力的相关性。
[1]廖伯寿.中国花生油脂产业竞争力浅析[J].花生学报, 2003, 32(增刊1): 11-15.
[2]周瑞宝,周兵,姜元荣.花生加工技术[M].北京:化学工业出版社, 2012: 11-12.
[3]张敏.花生制油工艺的现状与发展趋势[J].农机化研究, 2002(4): 19-21.
[4] ZIMMERMAN D C, VICK G A. Lipoxygenase inChlorella pyrenoidosa[J]. Lipids, 1973, 8(5): 264-266.
[5] HANBERG M. Isolation and structure of lipoxygenase productsfromSaprolegnia parasitica[J]. Biochimica et Biophysica Acta: Lipids and Lipid Metabolism, 1986, 876(3): 688-692.
[6] BENEYTOUT J L, ANDRIANANISON R H, RAKOTOARISOA Z, et al. Properties of a lipoxygenase in green algae (Oscillatoriasp.)[J]. Plant Physiology, 1989, 91(1): 367-372.
[7] YASUMATSU K, MORITAKA S. Fatty acid compositions of rice lipid and their changes during storage[J]. Agricultural and Biological Chemistry, 1964, 28(5): 257-264.
[8] YAMAMOTO A, FUJII Y, YASUMOTO K, et al. Partial purification and study of some properties of rice germ lipoxygenase[J]. Agricultural and Biological Chemistry, 1980, 44(2): 443-445.
[9] ARAKI T, KITAOKA H. Antioxidative properties of probucol estimated by the reactivity with superoxide and by electrochemical xidation[J]. Chemical & Pharmaceutical Bulletin, 2001, 49(8): 943-947.
[10] ARDA S, VURAL G. Effects ofβ-carotene on soybean lipoxygenase activity: kinetic studies[J]. European Food Research and Technology, 2007, 224(6): 743-748.
[11]姜启兴,许艳顺,曹颖,等.小球藻脂肪氧合酶酶学性质研究[J].食品工业科技, 2009, 30(6): 102-104.
[12] FRAZIER P J, LEIGH-DUGMORE F A, DANIELS N W R, et al. The effect of lipoxygenase action on the mechanical development of wheatflour doughs[J]. Journal of the Science of Food and Agriculture, 1973, 24(4): 421-436.
[13] ADDO K, BURTON D, STUART M R, et al. Soybean flour lipoxygenase lsozyme mutant effects on bread dough volatiles[J]. Journal of Food Science, 1993, 58(3): 583-585.
[14] IDA S, MASAKI Y, MORITA Y. The isolation of multiple forms and product specificity of rice lipoxygenase[J]. Agricultural and Biological Chemistry, 1983, 47(3): 637-641.
[15] KANGSADAN B, MATSUI K, AKAKABE Y, et al. Hydroperoxyarachidonic acid mediatedn-hexanal and (Z)-3-and (E)-2-nonenal formation inLaminaria angustata[J]. Phytochemistry, 2003, 63(6): 669-678.
[16]蒋和体,今泉滕己,佐藤匡央.大豆脂肪氧化酶酶活性变化研究[J].中国粮油学报, 2006, 21(3): 6-11.
[17]赵甲慧.发芽大豆成分变化对其加工性能的影响[D].南京:南京财经大学, 2012: 43-44.
[18]张浩,张雅君,丁艳,等.花生发芽过程中主要生理指标及蛋白质代谢变化的初步研究[J].食品科学, 2013, 34(19): 311-316. doi: 10.7506/spkx1002-6630-201319064.
[19]李淑艳.萌发过程大豆蛋白质动态变化及营养价值的研究[D].北京:北京林业大学, 2009: 24-25.
[20]方文德.花生种子蛋白酶抑制剂及其与脱水耐性及活力的关系研究[D].广州:中山大学, 1997: 49-52.
[21] KANG I H, SRIVZSTAVA P, OZIAS-AKINS P, et al. Temporal and spatial expression of the major allergens in developing and germinating peanut seed[J]. Plant Physiology, 2007, 144(2): 836-845.
[22]李卓杰,刘蓉晖,曾晓东,等.不同品种花生种子萌发中蛋白质的研究[J].中山大学学报论丛, 1992(3): 124-129.
[23] STANDERS T H, PATTEE H E, SINGLETON J A, et al. Lipoxygenase isozymes of peanut[J]. Lipids, 1975, 10(11): 681-685.
[24]侯美玲,苗华荣,陈静,等.花生种子脂肪氧化酶的活性测定研究[J].安徽农业科学, 2008, 36(32): 14033-14035.
[25] UWAEGBUTE A C, IROEGBU C U, EKE O. Chemical and sensory evaluation of germinated cowpeas (Vigna unguiculata) and their products[J]. Food Chemistry, 2000, 68(2): 141-146.
[26]赵晓园.大豆脂肪氧化酶活性影响因素研究及其应用[D].合肥:合肥工业大学, 2007: 30-33.
[27]王辉,周培根.大豆脂肪氧合酶的提取纯化及其特性研究[J].食品科学, 2008, 29(9): 396-398.
[28] BOVE J, JULLIEN M, GRAPPIN P. Functional genomics in the study of seed germination[J/OL]. Genome Biology, 2001, 3(1): 1002.1-1002.5.http://genomebiology.com/2001/3/1/reviews/1002.
[29] KATO T, OHTA H, TANAKA K, et al. Appearance of new lipoxygenases in soybean cotyledons after germination and evidence for expression of a major new lipoxygenase gene[J]. Plant Physiology, 1992, 98(1): 324-330.
[30]马寅斐,何东平,王文亮,等.我国花生产业的现状分析[J].农产品加工, 2011(7): 122-124.
[31] OHTA H, IDA S, MIKAMI B, et al. Changes in lipoxygenase components of rice seedlings during germination[J]. Plant Cell Physiology, 1986, 27(5): 911-918.
[32] HILDEBRAND D, HYMOWITZ T. Lipoxygenase activities in developing and germinating soybean seeds with and without lipoxygenase-1[J]. Botanical Gazette, 1983, 114(2): 212-216.
[33] HILDEBRAND D F, ROBERT T, VERSLUYS, et al. Changes in lipoxygenase isozyme levels during soybean embryo development[J]. Plant Science, 1991, 75(1): 1-8.
Change in Lipoxygenase Activity in Peanut during Germination
ZHANG Yajun, YANG Xuan, YANG Zhen, HAN Yongbin*
(Key Laboratory of Agricultural and Animal Products Processing and Quality Control, Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095, China)
Lipoxygenase has been considered one of the most critical enzymes in lipid degradation, and it has positive or adverse impact on nutrients in foods. In this study, the cultivar “HUAYU 30” was used to establish a lipoxygenase activity assay system for peanuts. The optimal reaction conditions were determined as 32 ℃, pH 6.8 and 0.10 mol/L phosphate buffer by single factor experiments. Under these conditions, the change in lipoxygenase activity during peanut germination was studied. The results showed that lipoxygenase activity was the highest after germination for 36 h, and then decreased with a slight fl uctuation during peanut germination. The lipoxygenase activity in embryo was lower than in cotyledon, but they both showed the same trend as the whole peanut.
peanut; germination; lipoxygenase
S565.2
1002-6630(2015)09-0182-05
10.7506/spkx1002-6630-201511035
2014-08-04
张雅君(1990—),女,硕士研究生,研究方向为食品科学。E-mail:2012108024@njau.edu.cn
*通信作者:韩永斌(1963—),男,教授,博士,研究方向为农产品加工与综合利用。E-mail:hanyongbin@njau.edu.cn

