谷胱甘肽亲和层析介质的制备条件及其层析特性研究
易秋分,张翠英,蒋永吉,唐昭娜,陈文成,朱显明,刘俊伟,董 辉
(1.天津科技大学生物工程学院,天津 300457;2.天津国际生物医药联合研究院,天津 300457)
谷胱甘肽亲和层析介质的制备条件及其层析特性研究
易秋分1,2,张翠英1,蒋永吉1,2,唐昭娜1,2,陈文成1,2,朱显明1,2,刘俊伟2,董 辉2
(1.天津科技大学生物工程学院,天津 300457;2.天津国际生物医药联合研究院,天津 300457)
以琼脂糖凝胶4FF(Sepharose 4 Fast Flow)为基质,1,4-丁二醇二缩水甘油醚(BDGE)为活化剂,通过活化、偶联谷胱甘肽(GSH),得到GSH亲和层析介质.实验结果表明:活化及偶联的优化条件为10,mL基质加入0.42,g NaOH、15,mL 二甲基亚砜(DMSO)、15,mL BDGE,反应温度为40,℃,反应时间为6,h;偶联溶液pH 6.5,反应温度为37,℃,反应时间为24,h.在此条件下,环氧基修饰密度可达60~65,µmol/mL;所制备的介质载量为(14.19± 0.98)mg/mL.以此介质对谷胱甘肽S–转移酶(GST)、融合蛋白GST-Bcl-2、GST-Ald、GST-PTPN12进行纯化,结果表明,该介质纯化效果较好、载量高、稳定性能较好,可重复使用.
谷胱甘肽亲和层析;活化;环氧基修饰密度;载量
在外源基因的表达中,为了更好地获得人们所需要的重组蛋白产物,需要通过分离纯化获得高纯度、高活性的产物.为了简化分离纯化手续和降低成本等,专家学者已作了大量研究,其中融合表达载体的使用使上述问题得到一定程度的改善,标签技术的应用,为提供高纯度、高活性的基因工程产品创造了更有利的条件[1].亲和层析技术具有分离效率高、特异性强、活性损失率低和操作简便等优点,在分离纯化蛋白质药物、抗体等生物活性大分子中的应用十分广泛[2].谷胱甘肽–S–转移酶融合表达系统是通过大肠杆菌进行蛋白表达、纯化和检测的重要系统.通过这一系统表达的蛋白一般在N末端融合上可溶性谷胱甘肽–S–转移酶作为标签.由于谷胱甘肽–S–转移酶与谷胱甘肽(GSH)能够特异性的结合,因此可以通过固定化谷胱甘肽层析介质对谷胱甘肽–S–转移酶融合蛋白进行分离、富集和纯化[3].
GSH琼脂糖凝胶4FF(Sepharose 4 Fast Flow)亲和层析填料是一种常用的固定化谷胱甘肽层析介质,主要由基质、连接臂和配基组成.目前,GSH亲和层析介质的生产主要依赖进口(如GE Healthcare的Glutathione Sepharose系列,以下简称GE介质),该填料在国内处于垄断地位,价格较为昂贵,这样不利于实验室大规模使用,因此开发一种适用的国产替代产品将非常有意义[4].
亲和层析介质的制备过程涉及到空白介质的活化、配基的偶联、封闭介质上未偶联配基的环氧基团、清洗保存等步骤.其中介质活化及配基偶联过程是影响介质载量的关键因素,终止偶联反应、封闭未发生偶联反应的环氧基团能避免在亲和层析中引入非特性吸附.介质的中间活化可使用环氧氯丙烷(ECH)、1,4–丁二醇二缩水甘油醚(BDGE)、N–羟基丁二酰亚胺、溴化氰、戊二醛、烯丙基溴等活化试剂,不同的活化方法引入不同长度和类型的连接臂,连接臂长度过短可加大空间位阻的影响,而过长则不利于GSH偶联以及配基和配体的亲和.陈成等[5]完成了BDGE活化、偶联GSH、乙醇胺溶液终止偶联反应的介质制备过程.研究发现环氧氯丙烷的低水溶性和活化过程中环氧基水解制约了活化效率,史清洪等[6]引入亲水试剂二甲基亚砜(DMSO)可消除琼脂糖凝胶与环氧氯丙烷之间的相界面,促进活化试剂的溶解,提高了琼脂糖色谱介质中环氧基的修饰密度,并通过对ECH浓度、NaOH浓度及反应时间的优化,得出最大环氧基修饰密度下的最佳活化反应条件.金华雄等[7]通过使用ECH和BDGE两种不同长度的连接臂,然后偶联还原型谷胱甘肽,得到两种谷胱甘肽亲和层析介质,认为两种自制介质都能达到纯化要求,但是由于BDGE活化引入的连接臂较长,空间位阻较小,有利于蛋白吸附,回收率是ECH活化的2倍,且纯化效果更佳.冯静等[8]系统考察了活化时间、偶联时间和偶联溶液pH对琼脂糖介质表面上配基偶联位点的影响.蛋白在偶联过程中受环氧基密度影响较大,密度越高,偶联位点多;偶联12,h以后偶联蛋白量不再增加.偶联溶液pH影响偶联蛋白二级结构,一定范围内随着pH增加,偶联蛋白量增多.
为寻求一种经济、简便、高效、稳定的GSH层析介质的制备方法,本文以琼脂糖凝胶4FF为基质,BDGE为连接臂,引入DMSO亲水性试剂,制备GSH亲和层析介质,重点对凝胶颗粒的活化条件、GSH偶联溶液的pH进行了优化,对GST标签蛋白,融合蛋白GST-Bcl-2、GST-Ald、GST-PTPN12进行纯化.
1 材料与方法
1.1 菌株、试剂与仪器
分别含表达质粒pGEX-6P-1、pGEX-Bcl-2、pGEX-Ald、pGEX-PTPN12的宿主菌大肠杆菌(Escherichia coli)BL21(DE3),GST蛋白及GST融合蛋白片段相对分子质量分别为2.6×104、6.0×104、6.5×104、6.8×104,均由本实验室保存.
琼脂糖凝胶4FF、Prescission Protease,GE Healthcare公司;1,4–丁二醇二缩水甘油醚(BDGE),玛雅试剂;二甲基亚砜(DMSO)、三羟甲基氨基甲烷(Tris)、还原型谷胱甘肽、十二水合磷酸钠、碳酸氢钠、碳酸钠、酚酞、硫代硫酸钠、无水氢氧化钠、氯化钠、无水合硫代硫酸钠、磷酸二氢钾,上海生工生物工程有限公司;95%,乙醇,天津市盛迪达贸易有限公司;浓磷酸、浓盐酸,西陇化工股份有限公司.
Elix 3 & Milli–Q型纯水仪,Millpore公司;PB-10型pH计,Sartorous公司;V410型无油真空泵,德国Chemvak公司;SIIZ–Ⅲ型循环水式多用真空泵,上海知信实验仪器技术有限公司;JA5003型精密电子天平,天津天马衡基仪器有限公司;ZHWY–211C型恒温培养振荡器,上海智诚分析仪器制造有限公司;ÄKTA explorer 10,S、ÄKTA HPLC蛋白纯化系统,GE Healthcare公司;蛋白质电泳系统,美国Bio-Rad 公司.
1.2 方法
1.2.1 琼脂糖凝胶4FF颗粒的活化
取10,mL凝胶颗粒混合液,在砂芯漏斗中用双蒸水抽滤清洗、抽干.然后,将洗净抽干的凝胶颗粒加入250,mL锥形瓶中,依次加15,mL DMSO、15,mL BDGE、0.42,g NaOH,用石蜡封口膜封口.再将上述悬浮液置于40,℃恒温振荡器中,200,r/min反应6,h;反应完毕,将反应物倒于砂芯漏斗中,用体积分数为20%,乙醇抽滤洗涤未反应完全的残留试剂,再用双蒸水抽滤清洗至无环氧基检出,得到经活化的琼脂糖凝胶4FF颗粒.
1.2.2 活化的琼脂糖凝胶4FF颗粒与GSH的偶联
将洗净抽干活化后的琼脂糖凝胶4FF颗粒置于硅化过的250,mL锥形瓶中,加入30,mL混合液(0.1,mol/L GSH,0.1,mol/L Na3PO4,1,mmol/L EDTA,pH 6.5),用石蜡封口膜封口,置于37,℃恒温振荡器,180,r/min反应24,h后,将反应物用双蒸水抽滤洗涤,用真空泵抽干得到凝胶颗粒.
1.2.3 终止偶联反应
向洗净抽干的凝胶颗粒中加入30,mL反应终止液(0.2,mol/L NaHCO3,0.5,mol/L NaCl,1,mmol/L EDTA,2,mol/L乙醇胺,pH 10.0),然后置于25,℃恒温振荡器中,180,r/min反应24,h,以终止未反应的基团;反应结束后,将反应物用双蒸水抽滤洗涤,用真空泵抽干后得GSH层析介质.最后将该层析介质于室温下浸泡在体积分数为20%,乙醇溶液中保存备用.
1.2.4 环氧基修饰密度的定量分析
琼脂糖凝胶的环氧基修饰密度的测定采用硫代硫酸钠滴定法[9].准确称取0.5,g抽干活化后的凝胶颗粒置于50,mL锥形瓶中,并加入3,mL 1.3,mol/L硫代硫酸钠和2滴酚酞指示剂;锥形瓶用石蜡封口膜封口后于37,℃、180,r/min反应30,min;反应后的溶液用0.01,mol/L盐酸标准溶液滴定,直至溶液由红色变为无色,0.5,min内保持不变为止.记录初始和滴定终止时0.01,mol/L盐酸溶液体积V0和V1.按照式(1)计算琼脂糖凝胶的环氧基修饰密度.
式中:S为环氧基修饰密度,mol/L;cHCl为盐酸标准溶液的浓度,mol/L;V0为盐酸的初始体积,mL;V1为滴定后盐酸的剩余体积,mL;m为活化介质的质量,g;ρ 为介质密度,取1.02,g/mL.
1.2.5 GST蛋白、GST融合蛋白菌液的制备
具有GST标签的质粒pGEX-6P-1的宿主菌大肠杆菌(Escherichia coli)BL21(DE3),经LB培养基37,℃培养、IPTG诱导等过程,获得表达有GST蛋白的工程菌.经高压破菌、高速离心后得到含GST蛋白的上清液,一部分上清液经0.45,µm微孔滤膜抽滤,4,℃保存备用;另一部分上清液经GE介质纯化,得到GST标签蛋白,–80,℃冻存备用.GST-Bcl-2、GST-Ald、GST-PTPN12菌液的获得采用上述同一方法,并标记为样1、样2、样3.
1.2.6 谷胱甘肽亲和层析介质的层析性能评价

(1)稳定性层析实验方法[10]:稳定性分析样品使用0.45,µm微孔滤膜抽滤过的含GST蛋白上清菌液.结合缓冲液为PBS,洗杂缓冲液为高盐PBS(900,mL PBS,100,mL 5,mol/L NaCl,加双蒸水定容至1,000,mL,pH 8.0),洗脱缓冲液为1×GSH.第1次为空白循环,以结合缓冲液替代测试样品上样.第2~7次操作为平衡层析柱、上样、结合缓冲液冲洗、洗杂缓冲液冲洗、洗脱缓冲液洗脱、洗杂缓冲液冲洗、双蒸水冲洗.重复6次,上样与洗脱的流量均为1,mL/min.
取2,mL自制层析介质和GE层析介质,分别置于两支12,mL亲和层析柱空柱中,分别取10,mL 6,mol/L盐酸胍溶液置于量层析柱中,室温放置1,h,最后用双蒸水、结合缓冲液充分清洗.
(2)动态载量(mg/mL)的测定方法[11]:动态载量分析样品0.45,µm微孔滤膜抽滤过的含GST蛋白上清菌液,1,mL自制GSH Sepharose 4,Fast Flow.结合缓冲液为PBS溶液,洗脱缓冲液为1×GSH (2.6,mmol/L GSH,3.13 mmol/L Tris,pH 8.0)溶液.
层析过程:采用ÄKTA HPLC蛋白纯化系统,通道1条件下,以0.5,mL/min连续上样,并使用收集器收集穿透液,待280,nm下吸光度(A280)升高并稳定,此时目标蛋白充满全部管路,UV检测值稳定,程序由通道1改为通道2,自制GSH亲和层析介质接入管路,以0.5,mL/min继续上样.随着上样体积的增加,逐渐达到柱子的载量,可以在穿透样中检测到GST蛋白UV值,至穿透曲线中目标样品活性达到10%,0ρ时上样完毕,以1,mL/min流量用1×GSH洗脱层析介质上结合的GST目标蛋白.计算Q10%,B,即得到在一定流量、一定缓冲液条件下的动态载量,按式(2)计算.

式中:Q10%,B为目标样品活性达到10%0ρ的动态载量,mg/mL;0ρ为样品中目标蛋白的质量浓度,mg/mL;VA为通道2条件下穿透曲线中目标样品活性达到10%0ρ时上样的总体积,mL;VC为总的柱床体积,mL.
(3)静态最大载量(有效载量mg/mL)的测定方法:取GSH介质0.1,mL置于1.5,mL EP管中,用1,mL PBS(140,mmol/L NaCl,2.7,mmol/L KCl,10,mmol/L Na2HPO4,1.8,mmol/L KH2PO4,pH 8.0)溶液润洗5~10次,充分平衡,离心去除缓冲液;依次加入500,µL PBS溶液、500,µL GST蛋白(用前测定其准确浓度,3次取均值0ρ),加入的溶液总体积(V)为1,mL,37,℃结合30,min.4,000,r/min离心5,min,取上清液12,000,r/min离心5,min,测上清液质量浓度(mg/mL)为1ρ(3次取平均值).按式(3)计算GST载量.

(4)GST蛋白及融合蛋白纯化方法:取2,mL自制层析介质和GE层析介质,分别置于两支12,mL亲和层析柱空柱中,依次用双蒸水、结合缓冲液清洗,将等体积的样品1溶液分别流经两支亲和层析柱,然后用洗杂缓冲液润洗层析柱,流出的液滴经考马斯亮蓝G-250检测不变蓝时停止润洗,取介质,制样.样品2、3制样方法同上;样品3流经层析柱,洗杂缓冲液冲洗制样后,加入适量的Prescission Protease,过夜酶切,洗脱目的蛋白,取样,制样.
(5)蛋白质分析方法:SDS-PAGE电泳法,制板采用Laemmli体系,即12%,的分离胶和5%,的浓缩胶;蛋白质浓度分析采用考马斯亮蓝法.
2 结果与讨论
2.1 琼脂糖凝胶活化条件的优化
关于GSH层析介质的制备条件已多见报道,本文结合金华雄等[7]方法进行优化探索,V基质∶VDMSO∶VBDGE∶VNaOH=1∶1.5∶1.5∶1.5,NaOH溶液浓度为0.6,mol/L,30,℃活化8,h.
2.1.1 无水反应体系对琼脂糖凝胶4FF活化的影响
在通常的水相体系中,反应体系存在明显的相界面,制约了活化反应的速率.将反应液中的0.6,mol/L NaOH水溶液换成等量NaOH固体,使琼脂糖凝胶的活化反应环境处于无水环境中,无水体系消除了反应液的相界面,有效地提高了活化反应的速率,环氧基修饰密度比加入相同浓度NaOH水溶液提高约2倍,结果如图1所示.由图1可以看出:在2~8,h内,随着反应时间的延长,琼脂糖凝胶颗粒的环氧基修饰密度不断升高;其中反应相同时间后,对NaOH固体的无水活化体系和NaOH水溶液的含水反应体系分别测定琼脂糖凝胶的环氧基修饰密度,发现每个时间点的环氧基修饰密度,无水反应体系约为含水反应体系的2倍,由此确定等量的NaOH固体的加入有利于琼脂糖凝胶的活化,为后续优化活化反应奠定了基础.

图1 不同反应体系对环氧基修饰密度的影响Fig.1 Effect of different reaction systems on the densityof epoxy
2.1.2 温度对琼脂糖凝胶4FF活化的影响
BDGE活化温度条件比较温和,在一定范围内温度升高,能够促进活化,但温度超过一定值后,活化受到制约,环氧基修饰密度很难进一步提升.10,mL基质中加入15,mL BDGE、15,mL DMSO、0.36,g NaOH后,在不同温度下活化8,h,结果如图2所示.由图2可以看出:活化温度低于40,℃的情况下,随着温度的升高环氧基修饰密度提高;但温度超过40,℃后,反应液变黏稠,颜色变深,且环氧基修饰密度降低.由此可得最适反应温度为40,℃.

图2 活化温度对环氧基修饰密度的影响Fig.2 Effect of activation temperature on epoxy density
2.1.3 NaOH浓度对琼脂糖凝胶4FF活化的影响
琼脂糖介质可在1.0,mol/L的NaOH溶液中稳定存在2,h以上[11].因此,活化反应的NaOH浓度不会对介质结构产生不利的影响.在活化过程中,NaOH浓度的增加有利于提高琼脂糖凝胶上环氧基的修饰密度,但是随着NaOH浓度增加,环氧基团会通过加剧水解作用而降低.10,mL基质中加入15,mL BDGE、15,mL DMSO,活化温度40,℃,在不同NaOH浓度下反应8,h,结果如图3所示.由图3可知:随着加入NaOH量增加,环氧基修饰密度逐渐变大,当加入NaOH量超过0.42,g时,环氧基团水解作用加剧,环氧基修饰密度开始降低.最终确定NaOH加入量为0.42,g.

图3 NaOH浓度对环氧基修饰密度的影响Fig.3 Effect of NaOH concentration on epoxy density
2.1.4 时间对琼脂糖凝胶4FF活化的影响
琼脂糖介质的环氧基修饰密度随着反应时间的延长而增加,但时间也要严格控制.10,mL基质中加入15,mL BDGE、15,mL DMSO、0.42,g NaOH,反应温度为40,℃,活化不同的时间,结果如图4所示.由图4可以看出:随着时间的推移,环氧基修饰密度逐渐升高,反应6,h时环氧基修饰密度达到最大;超过6,h后,琼脂糖基质上已经活化好的环氧根逐步水解,反应液中环氧基的修饰密度开始降低.为保证环氧基修饰密度达到最大值,确定活化反应时间为6,h.

图4 反应时间对环氧基修饰密度的影响Fig.4 Effect of activation time on epoxy density
总之,较高的介质活化程度对于GSH亲和载量的提高尤为关键.为此,确定活化最佳条件:V基质∶VBDGE∶VDMSO=1∶1.5∶1.5,即10,mL基质加入0.42,g NaOH、15,mL DMSO、15,mL BDGE;反应温度为40,℃;反应时间为6,h.在此条件下,环氧基修饰密度为60~65,µmol/mL,远高于文献[7]报道的15~18,µmol/mL.
2.2 GSH偶联的优化
GSH配基的偶联对层析介质的载量影响较大,GSH上的巯基很活泼,偶联反应能在温和的条件下(37,℃)进行,GSH的添加量只要比体系中环氧基总物质的量超过1倍即可[7].彭方等[12]报道活化后的偶联GSH反应液比例为V活化后的基质∶V偶联液=1∶3.结合实验室已有的偶联条件(0.1,mol/L GSH,0.1,mol/L Na3PO4,1,mmol/L EDTA,37,℃反应24,h),对偶联溶液pH进行单因素实验,并对不同pH下制得的介质的载量进行测定,结果如图5所示.由图5可知:同一批次活化的基质,随着偶联溶液pH变化,载量受到一定程度的影响.pH 6.5时,载量最大,pH高于6.5后,载量逐渐降低,说明不同pH条件可能影响配基的偶联,进而影响载量的大小.所以,最优的偶联溶液pH为6.5.

图5 偶联溶液的pH对GSH亲和层析介质载量的影响Fig.5 Effect of the pH of the coupling solution on the loading capacity of GSH affinity chromatographic adsoebent
2.3 GSH层析介质性能
2.3.1 稳定性测试
为了测试层析介质重复使用后的稳定性,通过ÄKTA explorer 10,S蛋白纯化系统进行稳定性的测试,1次空白对照加6次重复实验,结果如图6所示.由图6(a)错叠和图6(b)重叠的峰型图比较可以看出,在峰型图上保持了一致.这一结果表明层析介质有较好的稳定性,可以重复使用.为证实自制层析介质与GE介质的稳定性差异,参考GE公司Glutathlone Sephrose 4 Fast Flow的填料特性[13],GE产品能在1,mol/L醋酸盐或6,mol/L的盐酸胍水溶液中室温放置1,h.将等量的自制GSH层析介质和GE产品置于6,mol/L盐酸胍溶液中室温放置1,h后,纯化相同的蛋白,结果如图7所示.由图7可以看出:等体积的GST菌液分别经2,mL的自制层析介质纯化,得到SDS-PAGE,处理过后的自制GST亲和层析介质与GE介质仍能纯化蛋白.由此可以表明自制层析介质具有较好的稳定性.

图6 GSH亲和层析介质层析峰形图Fig.6 Peak shape of GSH affinity chromatographic adsoebent

图7 两种GSH亲和层析介质经6,mol/L盐酸胍水溶液室温处理1,h层析稳定性比较Fig.7 Comparison of chromatographic stability of two kinds of GSH affinity chromatographic adsoebents in 6 mol/L guanidine-hydrochloride solution for 1 h at room temperature
2.3.2 载量测试
(1)动态载量:为了测定已制备层析介质的动态载量与商业GE介质的动态载量,本实验使用ÄKTA HPLC蛋白纯化系统对动态载量进行了测定,见图8.在一定流量、一定缓冲液条件下的动态载量,根据峰形图,通道1时上样体积5,mL时管路中充满蛋白液,通道1改为通道2层析柱接入管路,穿透液达到目标蛋白含量10%,时,记录上样体积VA,以及此时穿透液的蛋白质量浓度.如图8,通道2条件下,自制1,mL层析介质穿透液达到目标蛋白含量10%,时,总上样体积VA为10,mL,0ρ为1.25,mg/mL.计算Q10%,B为12.5,mg/mL.根据GSH系列产品说明书,1,mL GSTrap FF column在0.5,mL/min上样速率、1,mL/min流量下,洗脱13.9,mg/mL的目的蛋白,即动态载量为13.9,mg/mL[14].排除自制1,mL GSH层析柱装柱过程中的不可控因素,所以自制层析介质的动态载量接近于GE介质.

图8 自制1,mL GSH介质层析流动载量峰形图Fig.8 The dynamic combination of the load of 1,mLGSH affinity chromatography
(2)静态载量:将1,mL自制和GE层析介质,用GST标签蛋白在室温下进行静态载量的测试,结果见表1.自制介质的载量测定值(14.19±0.98)mg/mL略高于GE介质的载量测定值(13.59±0.80)mg/mL.参照GE公司的GSH系列产品说明书中Glutathlone Sephrose 4,Fast Flow填料在小于3,mL/min流量下,与GST蛋白结合载量约等于或大于10,mg/mL,排除实验中不可控因素,自制GSH层析介质载量等同于或略高于GE介质.
(3)SDS-PAGE结果(图9)更好地证实了自制介质与GE介质载量差异.相同体积的GST融合蛋白上清样1(GST-Bcl-2)、上清样2(GST-Ald)、上清样3(GST-PTPN12)分别流经等体积的自制和GE层析介质,分别取等体积的介质样,SDS-PAGE显示,自制介质结合的融合蛋白量略高于GE介质,证明其载量略高于GE介质.
2.3.3 与GE介质层析效果对比
如图10所示,相同体积GST-Bcl-2融合蛋白菌液分别流经GE和自制GSH亲和层析柱,经菌液挂柱、杂蛋白洗脱、融合蛋白过夜酶切、目的蛋白洗脱等纯化步骤以及纯化结束后层析介质的处理,SDS-PAGE显示自制介质纯化效果较优于GE介质,处理后的介质上无蛋白残留,无非特异性吸附,已制备的层析介质纯化效果佳.
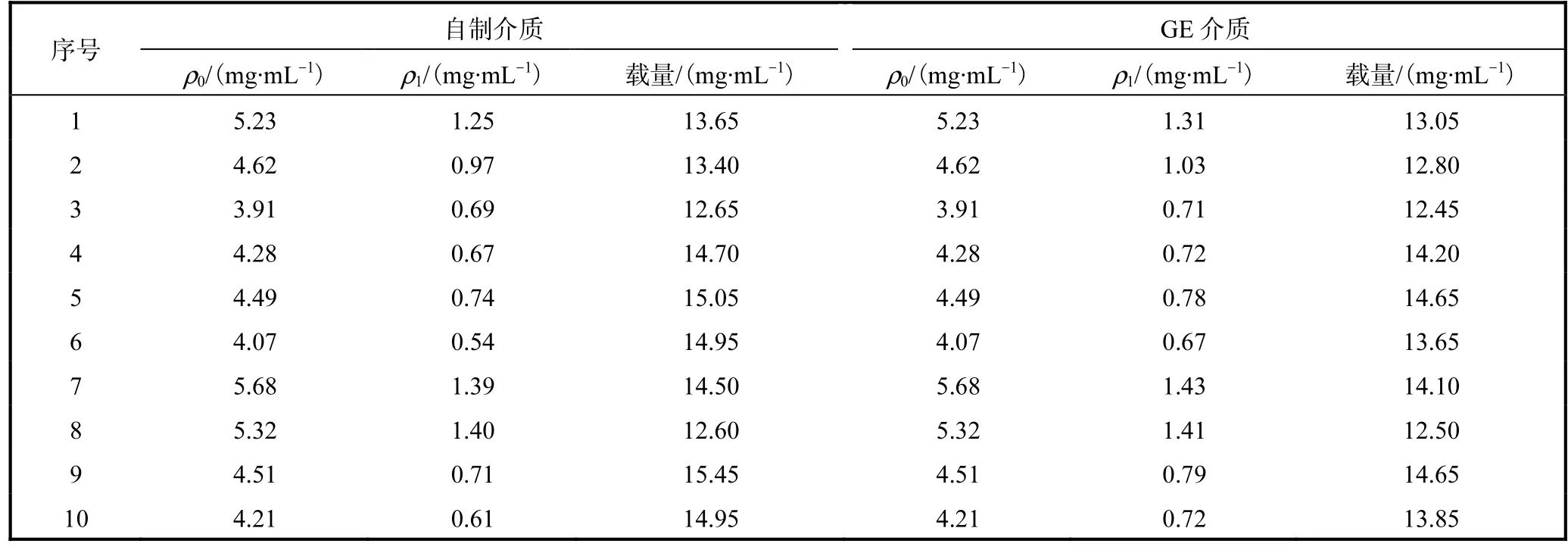
表1 比较两种GSH层析介质载量Tab.1 Comparison of the loading capacity of two kinds of GSH affinity chromatographic adsoebents

图9 两种亲和层析介质载量的SDS-PAGEFig.9 SDS-PAGE detection of the loading capacity of two kinds of GSH affinity chromatographic adsoebents

图10 两种亲和层析介质纯化效果的SDS-PAGEFig.10 SDS-PAGE detection of the purification effect of two kinds of GSH affinity chromatographic adsoebents
3 结 语
本文在琼脂糖的活化过程中以BDGE为连接臂,活化过程中加入NaOH固体从而使反应体系为无水环境,结果显示琼脂糖凝胶介质上环氧基的修饰密度显著提高;同时在无水反应体系的基础上,对活化过程中的温度、时间、NaOH浓度以及偶联GSH反应溶液的pH等进行了单因子条件摸索,最终得到了较优的活化条件,使得环氧基密度达到60~65,µmol/mL;根据制备的层析介质最高载量下对应的偶联反应液条件,得出偶联溶液的最佳pH.最终探索得到GSH亲和层析介质制备的方法.利用GST标签蛋白进行稳定性及载量的测试,在相同的实验条件下对商业GE介质的参数进行对比,根据实验数据证实该GSH亲和层析介质稳定性能好,动静态载量方面等同于或略优于GE介质.对GST-Bcl-2融合蛋白的纯化过程证实自制GSH亲和层析介质纯化效果等同于或优于GE介质.
[1] 丁鸣,余建法,丁仁瑞.融合表达载体的研究进展[J].生物技术,1988,8(4):5-8.
[2] Van Sommeren A P G,Machielsen P A G M,Gribnau T C J.Comparison of three activated agaroses for use in affinity chromatography:Effects on coupling performance and ligand leakage[J].Journal of Chromatography A,1993,639(1):23-31.
[3] Smith D B,Johnson K S.Single-step purification of polypeptides expressed in Escherichia coli as fusions with glutathione S-transferase[J].Gene,1988,67(1):31-40.
[4] 赵彦鼎,杨博,张鹏宇,等.化学改性琼脂糖凝胶的物化性能及其对重组人血白蛋白的纯化应用研究[J].离子交换与吸附,2009,25(3):218-224.
[5] 陈成,庄红芹,郑伟娟,等.谷胱甘肽亲和色谱介质的制备及对谷胱甘肽硫转移酶蛋白的纯化[J].色谱,2004,22(4):456-457.
[6] 史清洪,彭冠英,孙舒,等.环氧氯丙烷活化琼脂糖凝胶过程强化及性能评价[J].过程工程学报,2007,7(4):743-746.
[7] 金华雄,夏海锋,郑兵兵,等.两种谷胱甘肽亲和层析介质的制备及其对谷胱甘肽转移酶融合蛋白的纯化[J].离子交换与吸附,2011,27(4):325-333.
[8] 冯静,黄孟军,张贵峰,等.亲和层析介质上蛋白质偶联位点的控制方法[J].过程工程学报,2012,12(2):277-282.
[9] Scoble J A,Scopes R K.Assay for determining the number of reactive groups on gels used in affinity chromatography and its application to the optimization of the epichlorohydrin and divinylsulfone activation reactions [J].Journal of Chromatography A,1996,752 (1/2):67-76.
[10] Dian C,Eshaghi S,Urbig T,et al.Strategies for the purification and on-column cleavage of glutathione-S-transferase fusion target proteins[J].Journal of Chromatography B,2002,769(1):133-144.
[11] Griffith C M,Morris J,Robichaud M,et al.Fluidization characteristics of and protein adsorption on fluoridemodified porous zirconium oxide particles[J].Journal of Chromatography A,1997,776(2):179-195.
[12] 彭方,杨锐,李文鑫.一种制备GST融合蛋白亲和层析胶方法[J].生物化学与生物物理进展,2002,29(3):362-363.
[13] GE Healthcare.Technical Information/Sepharose CL-6B [EB/OL].[2005-02-01].http://www6.amershambiosciences.om/ptrix/upp01077.nsf/Content/Products?Open Docu-ment&parentid=17016001&moduleid=166180.
[14] GE Healthcare.Protocol/Glutathione Sepharose 4,Fast Flow[EB/OL].[2003-08-13].https://www.gelifesciences.com/gehcls_images/GELS/Related%,20 Content/Files/1314716762536/litdoc71501697AH_ 20110830182604.pdf.
责任编辑:郎婧
The Preparation of GSH Affinity Chromatographic Adsorbent and the Research of its Chromatographic Characteristics
YI Qiufen1,2,ZHANG Cuiying1,JIANG Yongji1,2,TANG Zhaona1,2,CHEN Wencheng1,2,ZHU Xianming1,2,LIU Junwei2,DONG Hui2
(1.College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China;2.Tianjin International Joint Academy of Biomedicine,Tianjin 300457,China)
The glutathione(GSH)affinity adsoebent was prepared with Sepharose 4,Fast Flow and 1,4-butanediol diglycidyl ether(BDGE),and then coupled with GSH based on the activated agarose particles.The results showed that the activating and coupling optimization conditions were adding into 10,mL of Sepharose 4,Fast Flow 0.42 g of NaOH,15,mL of dimethyl sulfoxide(DMSO) and 15,mL of BDGE.The incubation was at 40,℃ for 6,h.The activated agarosed particles were coupled with GSH,at 37,℃ for 24 h.The pH of the coupling reaction solution was 6.5.Under these conditions,the density of the epoxy group of the agarosed particles was 60-65 µmol/mL and the loading capacity was optimized to be (14.19±0.98) mg/mL.The adsorbents were used to purify the gultathione S transferase(GST),the recombinant GST-Bcl-2,GST-Ald and GST-PTPN12 proteins.The result shows that the GSH affinity adsorbent has good purification effect and a high loading capacity,and its good stability in performance can make the adsorbent be used repeatedly.
GSH affinity chromatography;activation;density of epoxy group;loading capacity
Q81
A
1672-6510(2015)05-0007-08
10.13364/j.issn.1672-6510.20140143
2014-11-04;
2015-02-03
国家自然科学基金青年科学基金资助项目(31300601)
易秋分(1989—),女,湖北荆州人,硕士研究生;通信作者:董 辉,副研究员,donghui@irm-cams.ac.cn.

