牛膝对重型颅脑损伤大鼠血清IL-2及神经细胞凋亡的影响*
潘宇政 黄李平 李 凯 彭玲玲 朱翠香
(1.广西医科大学第一附属医院,广西 南宁 530021;2.广西医科大学第一临床学院,广西 南宁 530021)
·研究报告·
牛膝对重型颅脑损伤大鼠血清IL-2及神经细胞凋亡的影响*
潘宇政1△黄李平1李 凯1彭玲玲1朱翠香2
(1.广西医科大学第一附属医院,广西 南宁 530021;2.广西医科大学第一临床学院,广西 南宁 530021)
目的观察牛膝水提取物对重型颅脑损伤大鼠血清IL-2及神经细胞凋亡的影响,并探讨血清IL-2含量与神经细胞凋亡关系。方法将SD大鼠随机分成对照组、模型组、牛膝高剂量组、牛膝中剂量组和牛膝低剂量组。于伤后6 h给牛膝各用药组灌食牛膝水提取物,其余两组灌食等量0.9%氯化钠注射液。每日1次,连续7 d,伤后第7日分别采集血标本及脑组织。采用ELISA及TUNEL原位法分别检测血清IL-2含量和损伤区神经细胞的凋亡。结果(1)重型颅脑损伤大鼠血清IL-2含量明显降低,牛膝水提取物可以提高重型颅脑损伤大鼠血清IL-2含量,这一作用与剂量呈正相关关系。(2)重型颅脑损伤大鼠存在明显的神经细胞凋亡,用牛膝水提取物干预后不能改善神经细胞凋亡,高剂量反而加重脑组织的细胞凋亡。这一作用与血清IL-2含量升高相关。结论牛膝水提取物能提高重型颅脑损伤大鼠血清IL-2的含量,血清IL-2含量升高会加重重型颅脑损伤大鼠脑细胞的凋亡。
牛膝 颅脑损伤 IL-2 神经细胞凋亡
研究表明重型颅脑损伤存在免疫抑制和细胞凋亡等继发损害[1-3],这些损害直接影响疾病的进程与预后。改善免疫抑制和细胞凋亡状况对治疗重型颅脑损伤具有重要作用。中药牛膝 (Achyranthes bidentataBlume)为笕科植物牛膝的根,中医认为其具有补肝肾、强筋骨、活血祛瘀等功效,临床常用于治疗肾虚、骨病、外伤等疾病。现代药理研究表明,其水提取物可以增强机体免疫功能[4],而从其中提取出一种神经再生素(NRF)能促进神经细胞再生[5]。牛膝的这一药理作用和中医药用经验提示牛膝可能可以改善重型颅脑损伤存在的免疫抑制和细胞凋亡状况。为此笔者观察了牛膝对重型颅脑损伤大鼠血清IL-2及神经细胞凋亡的影响,并探讨IL-2与神经细胞凋亡之间的关系。
1 材料与方法
1.1 实验动物 健康SPF级雌雄不限SD大鼠78只,体质量210~250 g。购自广西医科大学实验动物中心,许可证号:SYKG(桂)2003-0005。
1.2 主要药品及试剂 牛膝购于广西医科大学一附院中药房,原产地为河南省焦作市,经鉴定规格为8~14根/500 g,由广西医科大学药理实验室制备成水提取物,生药含量浓度为1 g/mL;大鼠IL-2R ELISA检测试剂盒购自烟台赛尔斯生物技术有限公司,批号SER003-96T和SER004-96T。
1.3 主要仪器 改良的Feeney′s自由落体打击装置,酶标仪上海原热电公司生产 (型号354),SIGMA台式高速冷冻离心机德国SIGMA生产(型号3k-15),显微镜日本OLYMPUS生产(型号CX21),石蜡切片机德国Leica公司生产(型号RM2235)。病理图像分析仪德国leica公司生产 (型号DMR+Q550),ipp6.0图像分析系统美国Media Cybernetics公司生产。
1.4 动物分组及给药 大鼠随机分为A、B、C、D、E 5组。A为对照组,B为模型非用药组,C为牛膝高剂量组,D为牛膝中剂量组,E为牛膝低剂量组,每组各13只大鼠。造模6 h后开始给药:A和B按10 mL/kg给0.9%氯化钠注射液灌胃;牛膝取临床常用量范围[6]的中等量20 g为每日的中等量,按低剂量为中等剂量的0.65倍,中剂量为高剂量的0.65倍计算用量,经人与大鼠用药量等量换算后,大鼠的 C、D、E分别以3.2,2.1,1.4 g/kg灌胃;每日1次,共7次。
1.5 重型颅脑损伤模型和对照组大鼠的制备 改良的Feeney′s自由落体方法[7]制作大鼠重型颅脑损伤模型。大鼠经称重,用10%水合氯醛(0.35 mL/100 g)麻醉,麻醉成功后,将动物俯卧位,头部固定于手术台上。剪去大鼠头顶部毛发,消毒后于矢状正中切开头皮,剥离骨膜,暴露左侧顶骨,在冠状缝后1.5 mm,中线旁左侧2.5 mm处,用牙科钻钻1个小孔,并扩大为直径5 mm的骨窗,保持硬脑膜完整;将一圆形钢板垫(直径约4.5 mm,厚度3.5 mm)置于硬膜外,用50 g击锤从20 cm高处沿套管呈自由落体冲击于致伤垫,造成顶叶局部性脑挫裂伤,打击后,骨蜡封闭骨窗,缝合头皮。对照组大鼠仅切开头皮,保持颅骨完整,然后缝合头皮。至伤动物苏醒后灌胃原笼喂养。致伤动物苏醒后原笼喂养。
1.6 神经功能缺损评分 参照有关文献[8]对各组动物进行神经功能缺损评分,其评分标准参照《现代药理实验方法学》[9]评分方法,采用10分制,单盲法进行评分。造模后6 h评分>2分则表明模型成功,<2分则从本研究中剔除。
1.7 标本采集及指标检测方法 最后一次给药后6 h处死。(1)心脏采血1.5mL,4℃,3000r/min离心10min,取上清液,置-80℃冰箱待测IL-2。参照IL-2试剂盒说明书,用354型全自动酶标仪检测。(2)经升主动脉灌注0.9%氯化钠注射液200 mL,直至右心房流出液清亮为止,再以4%多聚甲醛液200 mL灌注,断头取脑迅速浸入4%多聚甲醛液中固定24 h,修成4 mm块,常规酒精脱水,石蜡包埋,行5 μm冠状切片,脱蜡至水备用,以TUNEL原位法检测损伤区凋亡细胞,按试剂盒说明步骤进行检测,在光学显微镜下观察TUNEL免疫反应的结果,并以ipp6.0图像分析软件计算阳性细胞光密度。
1.8 统计学处理 应用SPSS13.0统计软件处理。实验数据以(±s)表示,多组间采用单因素方差分析(One-Way-ANOVA)进行比较。若方差不齐,则采用秩和检验,进行秩次转换后的方差分析。非双变量正态分布资料的相关分析,选择Pearson相关系数。检验水准:取α=0.05。P<0.05为差异有统计学意义。
2 结 果
2.1 各组神经功能缺损评分值比较 见表1。B组与C、D、E组相比较,神经功能缺损评分差异均无统计学意义(P>0.05)。造模后6 h,B、C、D、E组的神经功能缺损评分均>2分,表明造模成功。
表1 各组神经功能缺损评分值比较(分,±s)
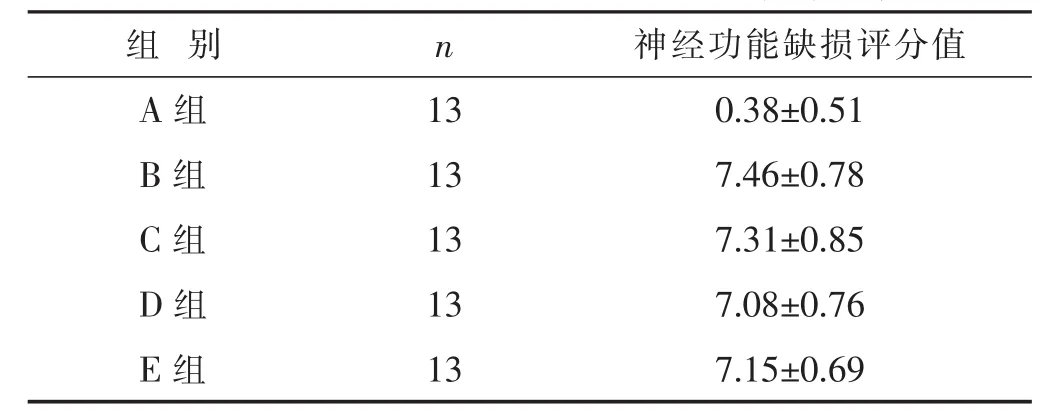
表1 各组神经功能缺损评分值比较(分,±s)
组别 n A组 1 3 B组 1 3 C组 1 3神经功能缺损评分值0 . 3 8 ± 0 . 5 1 7 . 4 6 ± 0 . 7 8 7 . 3 1 ± 0 . 8 5 D组 1 3 7 . 0 8 ± 0 . 7 6 E组 1 3 7 . 1 5 ± 0 . 6 9
2.2 各组血清IL-2含量比较 见表2。B组血清IL-2含量明显低于A组,D组、E组血清IL-2含量则没有下降,明显高于B组。C组与B组一样明显低于A组与D、E组。结果提示,重型颅脑损伤大鼠受伤后血清IL-2含量明显下降。牛膝水提取物可以对抗重型颅脑损伤出现的血清IL-2含量下降。这一对抗作用与剂量有关,低剂量没有作用,中剂量以上才能发挥作用。而且呈现随着剂量增加而增强趋势。
2.3 各组脑组织TUNEL凋亡细胞测定值比较 见表3,图1。B组及各用药组与A组比较,光密度(IOD)明显升高。各用药组与B组相比,C组光密度(IOD)明显高于B组,亦高于D、E两组。D、E两组与B组无差别,D、E两组之间亦无差异(P>0.05)。结果表明重型颅脑损伤大鼠受伤后脑组织出现明显的细胞凋亡。牛膝水提取物没有改善重型颅脑损伤大鼠脑细胞的凋亡,在高剂量时反而加重细胞凋亡。
表2 各组血清IL-2含量比较(pg/mL,±s)

表2 各组血清IL-2含量比较(pg/mL,±s)
与A组比较,*P<0.01;与C组比较,*P<0.01;与D组比较,△P<0.05。
组别 n A组 1 3 B组 1 3 C组 1 3 I L -2 2 7 9 . 8 2 ± 4 0 . 7 3 1 8 9 . 8 1 ± 2 9 . 6 7*△2 7 7 . 2 2 ± 5 3 . 9 5 D组 1 3 2 4 7 . 0 7 ± 4 1 . 5 8 E组 1 3 1 9 2 . 0 8 ± 6 8 . 2 2*△
表3 各组颅脑损伤后凋亡细胞测定值比较(±s)

表3 各组颅脑损伤后凋亡细胞测定值比较(±s)
与A组比较,△P<0.05;与C组比较,*P<0.05。
组别 n A组 1 3 B组 1 3 C组 1 3 I O D 1 4 . 0 7 ± 7 . 8 2 2 7 . 3 9 ± 1 2 . 7 8*△4 4 . 6 9 ± 2 4 . 5 9△D组 1 3 3 6 . 6 5 ± 2 0 . 9 5*△E组 1 3 2 6 . 7 5 ± 1 1 . 6 8*△

图1 各组大鼠脑损伤后7 d镜下观察损伤区周边额皮质细胞凋亡情况(×400)
2.4 血清IL-2水平与神经细胞凋亡之间的关系 用双变量相关分析法,分别检测血清IL-2水平与神经细胞凋亡的相关关系。(1)C组血清IL-2水平与光密度(IOD)相关关系Pearson的系数r=0.620,P=0.024(双侧),见图2。(2)D组血清IL-2水平与光密度(IOD)相关关系Pearson的系数r=0.602,P=0.03(双侧),见图3。(3)其他各组血清IL-2水平与神经细胞凋亡无相关关系。结果显示C、D组血清IL-2水平与神经细胞凋亡的数量有正相关关系。
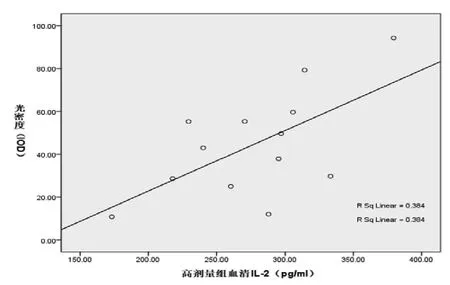
图2
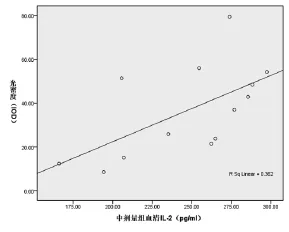
图3
3 讨 论
3.1 牛膝对重型颅脑损伤血清IL-2水平的影响IL-2主要由辅助性T淋巴细胞产生,可以促进T细胞增殖和分化,促进B细胞增殖和分泌抗体,增强NK的杀伤活性,激活单核-吞噬细胞,还能促进多种淋巴因子表达,其水平的高低能反映机体免疫功能状况。本研究显示,B组血清IL-2水平较A组明显降低,说明重型颅脑损伤大鼠早期免疫功能处于抑制状态。这与我们既往相关研究结果和其他文献报道基本一致[10-11]。牛膝药用历史悠久,神农本草经已有记载,具有补益肝肾、活血化瘀等功效,常用于肝肾不足、跌打损伤等病的治疗。现代药理研究发现牛膝具有改善机体免疫功能作用。本研究观察到牛膝可以提高重型颅脑损伤大鼠血清IL-2水平。这一作用与剂量呈正相关关系,低剂量作用不明显,中剂量才发挥显著作用,并且呈现随着剂量增加而加强的趋势。
3.2 牛膝对重型颅脑损伤神经细胞凋亡的影响及与血清IL-2水平的关系 重型颅脑损伤对脑组织造成的损害,传统观点曾认为细胞坏死是细胞死亡的唯一途径。1995年Rink[12]在大鼠液压冲击脑损模型上在电镜下首次观察到细胞凋亡。随后不断有许多学者也证明了大脑创伤后神经细胞凋亡现象[13-14]。并且发现在创伤的动物模型中不仅神经元可出现凋亡,星形胶质细胞、少数胶质细胞等胶质细胞等也可出现凋亡现象[15]。脑损伤后存在脑细胞凋亡已基本达成共识,但凋亡的程度在伤后的不同时间会有所差别。本研究观察到重型颅脑损伤大鼠受伤7 d后脑组织存在明显的神经细胞凋亡。曾有报道,从牛膝提取出的一种神经再生素(NRF)能促进神经细胞再生[4]。实验中当用牛膝水提取物干预后,重型颅脑损伤大鼠神经细胞凋亡并没有得到改善,在高剂量时反而加重神经细胞的凋亡。牛膝这一加重神经细胞凋亡的现象,考虑与其提高血清IL-2水平有关。用双变量相关分析法分析重型颅脑损伤大鼠神经细胞凋亡与血清IL-2之间的关系,发现C、D组血清IL-2水平与神经细胞凋亡的数量有正相关关系。表明血清IL-2含量升高可以加剧神经细胞凋亡。
血清IL-2含量升高导致神经细胞凋亡的机制,主要与机体免疫功能增强有关。李卫等[16-17]认为颅脑损伤后,脑组织损伤灶局部CD4+、CD8+T细胞免疫应答显著增强,其中CD8+T细胞可介导靶细胞凋亡,加重脑组织的继发性损伤。同时脑组织急性损伤后,平时由于血脑屏障的阻隔,脑组织与免疫系统相对隔离而形成的隐蔽性抗原大量释放,可能刺激机体产生自身免疫反应。其在临床研究也发现,患者脑脊液的免疫球蛋白(Ig)含量与早期的Lasgow评分及恢复期的残疾评分密切相关,提示体液免疫反应加重继发性脑损伤[18]。而一些研究则发现应用免疫抑制剂对脑组织损伤具有保护作用[11]。这些研究结果提示免疫反应在一定条件下会加重重型颅脑损伤的脑组织损伤。
[1] 冯海龙,高立达,黄光富,等.大鼠创伤性脑损伤后神经细胞凋亡的实验研究[J].中华创伤杂志,2000,16(2):97-99.
[2] Savitz SI,Rosenbaum Drn.Apoptosis in neurologicl disease[J].Neurosurgery,1998,42(11):555-572.
[3] 梅杰,张光辉.颅脑损伤对机体免疫功能的影响[J].中国临床神经外科杂志,2005,10(3):237-239.
[4] 宋义平,刘彩,玉周刚,等.牛膝多糖对小鼠细胞免疫功能的影响[J].中药新药与临床药理,1998,9(3):158-159.
[5] 汤欣,陈益人,周松林,等.神经再生素促大鼠海马神经元生长的研究[J].解剖学报,2008,39(1):7-11.
[6] 雷武权,张延模.中华临床中药学[M].北京:人民卫生出社,1998:1126.
[7] 江基尧,朱诚,罗其中.现代颅脑损伤学[M].上海:第二军医大学出版社,2004:417-418.
[8] 仁增,张跃康,马潞,等.川芎嗪对大鼠重型颅脑损伤后神经细胞凋亡及Bcl-2、Bax表达的影响[J].中国临床神经外科杂志,2009,14(1):37-39.
[9] 张均田.现代药理实验方法[M].北京:北京医科大学中国协和医科大学联合出版社,1998:1241.
[10]陈锡群,龚孝淑,江基尧,等.低温对实验型颅脑损伤大鼠免疫功能的影响[J].中华神经外科杂志,2001,17(3):168-170.
[11]李卫,徐如祥,陈善成,等.大鼠脑组织损伤后局部及血液中细胞免疫状况的改变[J].中华神经医学杂志,2006,5(6):556-558.
[12]Rink A,Fungkar M,Trojanouski JQ,et al.Evidence of opotosis cell death after experience traumatic brain injurey in the rat[J].Am J Pathol,1995,147(6):1575.
[13]Colicos MA,Dash PK.Apoptotic morphology of dentate gyanule cells following experimental cortical impact injury in rats:Possible role in spatial menory deficits[J].Brain Res,1996,739(2):120-131.
[14]Clark RS,Cheng J,Watkins SL,et al.Apoptosis-suppressor gene Bcl-2 expression after traumatic brain injurey in the rats[J].J neurosci,1997,17(6):9172-9182.
[15]Newcomb JK,Zhao X,Pike BR,et al.Temporal profile of apptoic-like changs in neurons and astrocytes following controlled cortical impact injury in the rat[J].Exp Neurol,1999,158(5):76-78.
[16]金丽琴,许艳,芳金晶,等.牛膝多糖对老龄大鼠非特异性免疫功能的影响[J].中国病理生理杂志,2007,23(7):1408-1411.
[17]陈克家,李卫,汪志刚.大鼠脑组织损伤后局部细胞免疫与神经元凋亡的关系[J].南方医科大学学报,2009,29(3):497-499.
[18]李卫,徐如祥,张建,等.颅脑损伤患者血液及脑脊液中IgG含量的变化与病情之间的关系[J].南方医科大学学报,2006,26(5):703-704.
The Effect of Achyranthes Bidentata on Serum IL-2 and Neuronal Apoptosis in Severe Traumatic Brain Injury Rats
PAN Yuzheng,HUANG Liping,LI Kai,et al. The First Affiliated Hospital of Guangxi Medical U-niversity,Guangxi,Nanning 530021,China
Objective:To observe the effects of water extract from Achyranthes bidentata on serum IL-2 and neuronal apoptosis in a rat model with severe traumatic brain injury and to discuss the correlationship of serum IL-2 and neuronal apoptosis.Methods:SD rats were randomly divided into sham-operated group,model group,achyranthes bidentata high dose group,achyranthes bidentata middle dose group and achyranthes bidentata low dose group.6 hours after injury,the three treatment groups were force-fed with achyranthes bidentata water extract,and the rest of other two groups were force-fed with amount of saline solution,once per day for 7 days.7 days after injury,blood and brain tissue samples were collected.Serum IL-2 and apoptosis of damaged neuronal area were detected by ELISA and TUNEL respectively.Results:Serum IL-2 decreased obviously in severe traumatic brain injury rats.Achyranthes bidentata water extract could increase the content of serum IL-2 in severe traumatic brain injury rats and this effect was positively related to dose.Obvious neuronal apoptosis exists in severe traumatic brain injury rats.The intervention of achyranthes bidentata water extract did not improve the nerve cell apoptosis.On the contrary,High-dose achyranthes bidentata aggravated neuronal apoptosis,and this effect was related to the increased serum IL-2.Conclusion:Achyranthes bidentata water extract can increase the serum IL-2 levels of severe traumatic brain injury rats,and the increase of serum IL-2 can aggravate neuronal apoptosis.
Achyranthes bidentata;Traumatic brain injury;IL-2;Neuronal apoptosis
R285.5
A
1004-745X(2015)02-0197-04
10.3969/j.issn.1004-745X.2015.02.004
2014-10-18)
广西壮族自治区卫生厅重点科研课题(No.200847)
△通信作者(电子邮箱:pyz79298@sina.com)

