外源H2O2对沙打旺抗黄矮根腐病的影响
黄贝梅,南志标,张志新
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州730020)
沙打旺(Astragalusadsurgens)为多年生豆科牧草,主要分布于我国北方,其产量高、营养丰富、适应性广、抗逆性强,在畜牧业生产中具有重要地位[1]。病害是造成沙打旺衰退的主要原因之一,其引致牧草产量减少、品质下降,草地寿命与利用年限缩短[2-3]。Li和Nan[4]首次报道了沙打旺黄矮根腐病,其病原物为埃里砖格孢(Embellisiaastragalisp.),该病菌可以引起植物矮化,茎秆变黄,根部腐烂,极大地降低了沙打旺的产量、缩短了其利用年限。俞斌华[5]以采集于6个省市的10个沙打旺品种为研究对象,研究了其对黄矮根腐病的抗性评价,并将陕西榆林、中沙一号划分为抗病品种,内蒙早熟、宁夏彭阳划分为感病品种。
H2O2是生物体内重要的活性氧分子和信号分子,通过超氧化物在电子传递过程中产生或在外界因素激发下产生,参与植物的基因表达、防御反应和细胞凋亡等生理过程[6-9]。有研究表明,植物受到逆境胁迫时会通过信号转导过程促进自身防卫基因的表达,形成防御酶系,从而提高植物的抗性[10-15]。目前,关于H2O2是否能够提高沙打旺抵抗黄矮根腐病的能力,其作用机理如何等问题尚未见报道。Patykowski和Urbanek[10]发现2个抗病性不同的番茄(Lycopersiconesculentum)品种在受到灰霉病菌(Botrytiscinerea)侵染后均能检测到 H2O2含量升高,并且抗病品种较感病品种出现的早、生成量更高。外源H2O2处理能够诱导抗病和防御相关基因的表达,提高植物的抗病性[11]。外源H2O2能降低葡萄霜霉病造成的危害,而H2O2清除剂AsA(抗坏血酸)增加了其危害[16]。
目前,关于H2O2是否能够提高沙打旺抵抗黄矮根腐病的能力,其作用机理如何等问题尚未见报道。因此,本试验以抗病品种陕西榆林和感病品种宁夏彭阳为研究材料,接种埃里砖格孢,检测受到病原菌侵染后沙打旺叶片H2O2含量的变化,并测定外源H2O2对发病率、病情指数和病程相关蛋白酶活性影响。以期阐明H2O2对沙打旺黄矮根腐病的作用机理,为外源H2O2应用于提高植物抗病性研究提供科学依据。
1 材料与方法
1.1 供试材料
供试的沙打旺为抗病品种陕西榆林和感病品种宁夏彭阳,种子由俞斌华提供,保存在兰州大学草地农业科技学院种子库中(4℃)。供试菌株为黄矮根腐病菌(Embellisiaastragali),采自甘肃省环县草地畜牧业综合试验场沙打旺发病茎秆。盆栽于兰州大学榆中智能温室。供试土壤为营养土与黄绵土1∶1混合,经169℃灭菌6h[17]后装入经0.2%高锰酸钾消毒塑料盆内,每盆2kg,塑料盆规格为15cm×15cm(直径×高)。
1.2 试验处理
2012年4月20日播种,出苗后选择长势一致的壮苗,每盆定苗4株,每处理6盆。于定苗后90d,用喷雾法将埃里砖格孢悬浮液(1×105个/mL)接种在沙打旺植株上,以无菌水为对照,然后用经实验室中测定对孢子萌发没有影响的 H2O2(0.1%)和 AsA(0.2mmol/L)处理,每个处理重复4次。分别于处理后0,1,3,5,7,9d取植株中间部位叶片带回实验室以检测酶活性,1个月后统计发病率,计算病情指数。
其他试验条件保持一致(温度白天25℃,夜间20℃,14h光照10h黑暗交替、光照8000~10000lx,相对湿度65%)。每隔1周重新排列各试验盆的位置,以消除不同位置光照条件、通风条件存在的差异。
1.3 试验方法
1.3.1 孢子悬浮液的制备 将采自甘肃省庆阳感有黄矮根腐病的沙打旺带菌茎秆用70%酒精表面消毒30 s,再用1%的次氯酸钠消毒3min,无菌水冲洗4次,接种在PDA培养基中,25℃下黑暗培养1~3个月,获得埃里砖格孢纯培养病原菌,制成1×105个/mL的孢子悬浮液备用。
1.3.2 H2O2含量测定 用喷雾法将埃里砖格孢悬浮液接种在沙打旺全株上,未接种沙打旺植株为对照,取沙打旺叶片组织0.3g,加入丙酮研磨成浆;3000r/min离心10min,取上清液,依次加入硫酸钛和浓氨水;5000 r/min离心10min后弃上清,洗涤5次,用硫酸溶解沉淀在450nm波长下测定吸光度值,计算组织中H2O2含量[18]。
1.3.3 发病率和病情指数 沙打旺黄矮根腐病发病率和病情指数统计采用李彦忠[19]的方法。病情指数分级标准:每株选择5个枝条(不足5个枝条以实有枝条统计),每个枝条从基部向上选择5个复叶,根据复叶上发病小叶(叶片基部或边缘变黄,有病斑)占小叶总数的比例设定病情指数,0级:无小叶发病;1级:0%~25%;2级:25%~50%;3级:50%~75%;4级:>75%的小叶有病斑。

1.3.4 酶活性测定 过氧化物酶(POD)活性采用李合生[20]的愈创木酚法,超氧化物歧化酶(SOD)采用氮蓝四唑(NBT)光还原法[20],过氧化氢酶(CAT)采用紫外吸收法[21],多酚氧化酶(PPO)采用 Anderson和 Morris[22]的方法,β-1,3-葡聚糖酶(Glu)采用 Dygert等[23]的方法,几丁质酶(Cht)参照Boller等[24]的方法。
POD活性测定,用愈创木酚法测定[20]。取酶液0.1mL,加入0.5mL愈创木酚、100mL 0.1mol/L(pH 8.0)磷酸缓冲液、50μL H2O2,在470nm波长下每隔30s记录(共3min)吸光度的变化值。
SOD活性测定,取0.1mL酶液,加入反应液(1.5mL浓度为0.05mmol/L的磷酸缓冲液,0.5mL蒸馏水,以及130mmol/L甲硫氨酸、750μmol/L氮蓝四唑、100μmol/L EDTA-Na2和20μmol/L核黄素各0.3mL)。20min后以不照光对照为空白,560nm波长下测定吸光值。以抑制NBT光化还原50%作为1个酶活力单位[20]。
CAT活性测定,取10mL试管4支,其中1支为对照管,另外3支各加入0.1mL粗酶液,1.5mL磷酸缓冲液(pH 7.8),4mL蒸馏水,于30℃保温10min,随后加入0.1mol/L的 H2O20.2mL,记录240nm波长下每隔1min吸光值,1个酶活力单位为每min吸光值减少0.1[21]。
PPO活性测定,取0.2mL酶液,加入1mL儿茶酚(0.1mol/L),3.9mL磷酸缓冲液(pH 6.0),在波长410 nm下共记录3min(每隔30s记录1次)吸光值变化。1个酶活力单位定义每min每g组织吸光值变化0.01[22]。
Glu活性测定,取沙打旺叶片组织0.3g,加入5倍量乙酸钠缓冲液(0.05mol/L,pH 5.0)研磨为匀浆,离心15min(15000r/min),4℃下透析,上清液为粗酶液,测定Glu活性,反应底物为昆布多糖,1个酶活力单位定义为每g样品每min产生1μg还原糖的酶量[23]。
Cht活性测定,-15℃下将沙打旺叶片组织0.5g冷冻加固,并加入3.0mL磷酸缓冲液(pH 6.4),研磨为匀浆,冷提2h,离心10min(10000r/min),得粗酶液,量取0.5mL粗酶液,加入0.1mL缓冲液,0.5mL胶状几丁质(5mg/mL),40℃下保湿1h,冷却后继续离心,取0.5mL上清液,加0.1mL四硼酸钾(0.8mol/L),沸水浴3min,待冷却后加对二甲氨基苯甲醛试剂3mL,混匀,37℃下保湿20min,冷却后在585nm波长下测定吸光值。根据标准曲线计算Cht含量,1个酶活性单位定义为每h每g样品从胶状几丁质中释放1μg N-乙酰葡萄糖胺[24]。
1.4 数据统计分析
用Microsoft Excel 2003整理试验数据、作图,用SPSS 17.0进行显著性分析,平均值用Duncan新复极差分析进行多重比较。
2 结果与分析
2.1 接种埃里砖格孢后沙打旺叶片中内源H2O2含量
接种埃里砖格孢后抗病与感病沙打旺品种H2O2含量变化不同。宁夏感病沙打旺接种病菌后H2O2含量随着时间的延长呈现先增大后减小的趋势,且在整个处理期间均高于未接种,最高值出现在36h,H2O2含量为929 μmol/g,对照H2O2含量比较稳定。陕西抗病沙打旺接菌后H2O2含量变化趋势与感病品种相似,而最高值出现时间较早,为24h,达到986μmol/g,对照含量变化不大(图1)。
2.2 发病率与病情指数
感病品种宁夏沙打旺在AsA处理下发病率最高,达43%,且与对照相比,H2O2处理下感病沙打旺发病率与病情指数分别降低了13%和12%。而抗病品种陕西沙打旺发病率最高值同样为AsA处理,仅达到33%,与对照相比,H2O2处理下抗病沙打旺发病率与病情指数分别降低了8%和9%(图2,图3)。
2.3 施加H2O2与AsA处理对沙打旺叶片酶活性影响
2.3.1 过氧化物酶(POD)活性变化 由图4可知,接种埃里砖格孢后感病沙打旺植株POD活性总体呈双峰曲线,分别于第3天和第7天出现峰值,且H2O2处理下POD活性最高,与对照和AsA差异显著。抗病沙打旺植株各处理POD活性随时间变化呈先增加后降低,随后又升高趋势,接种埃里砖格孢1d后达到峰值,且H2O2处理下最高,相比对照和AsA差异显著。整体上看,未接种各处理POD活性低于接种,且变幅较小。
2.3.2 多酚氧化酶(PPO)活性变化 感病与抗病沙打旺植株在埃里砖格孢侵染后各处理PPO活性均呈先增加后降低的趋势,且明显高于未接菌处理,H2O2处理显著高于对照和AsA处理,感病品种PPO活性在7d后达到最大,抗病品种在则在第5天出现峰值,且抗病沙打旺PPO活性高于感病品种。未接种各处理在整个处理期间变化较小,处理间差异不大(图5)。
2.3.3 β-1,3-葡聚糖酶(Glu)活性变化 感病品种接种后各处理Glu活性呈逐渐上升趋势,在第9天达最高值,抗病品种接种后最高值出现在第5天,H2O2处理下活性最高(图6),显著高于感病品种。接种各处理Glu活性高于未接种,且H2O2处理要高于对照和AsA处理,AsA处理较对照低,抑制了接种沙打旺叶片Glu活性的升高。未接种沙打旺Glu活性比较稳定,处理间差异不大。
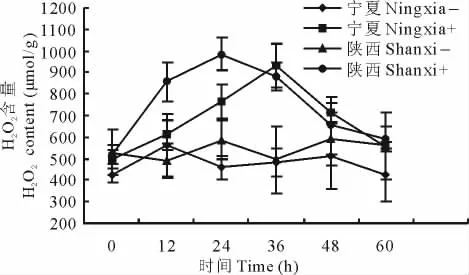
图1 接种埃里砖格孢后抗病与感病沙打旺叶片H2O2含量变化Fig.1 Leaf H2O2content change of disease-resistant and susceptible varieties of A.adsurgens inoculated with E.astragali
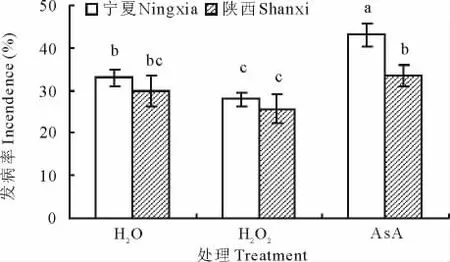
图2 H2O2与AsA处理对沙打旺黄矮根腐病发病率的影响Fig.2 Effect of H2O2and AsA on incedence of yellow stunt and root rot disease of A.adsurgens

图3 H2O2与AsA处理对沙打旺黄矮根腐病病情指数的影响Fig.3 Effect of H2O2and AsA on disease index of yellow stunt and root rot disease of A.adsurgens
2.3.4 几丁质酶(Cht)活性变化 埃里砖格孢侵染沙打旺后,Cht活性变化在测定时间内呈单峰曲线,并高于未接种处理。其中,施加外源H2O2后提高了Cht活性,高于对照和AsA处理。AsA处理较对照低,对接种沙打旺叶片Glu活性的升高有抑制作用。感病品种最高值出现在第7天,为H2O2处理,抗病品种在第5天出现最高值。未接种处理Cht活性变化幅度较小,处理间差异不大(图7)。
2.3.5 超氧化物歧化酶(SOD)活性变化 H2O2和AsA处理后,接种的感病与抗病沙打旺SOD活性均有不同程度的升高,呈先增高后降低的趋势,且接种后各处理高于未接种处理,H2O2处理显著高于对照和AsA处理。感病沙打旺SOD峰值出现在第7天,H2O2处理最高。抗病沙打旺SOD活性最高值在第5天,H2O2处理最高。未接种沙打旺各处理间无明显差异(图8)。

图4 H2O2与AsA处理对接种埃里砖格孢沙打旺POD的影响Fig.4 Effect of H2O2and AsA on POD activity of A.adsurgensinoculated with E.astragal

图5 H2O2与AsA处理对接种埃里砖格孢沙打旺PPO的影响Fig.5 Effect of H2O2and AsA on PPO activity of A.adsurgensinoculated with E.astragal
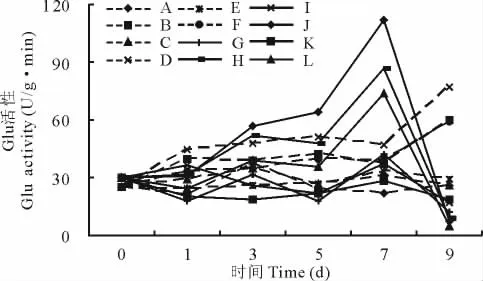
图6 H2O2与AsA处理对接种埃里砖格孢沙打旺Glu的影响Fig.6 Effect of H2O2and AsA on Glu activity of A.adsurgensinoculated with E.astragal
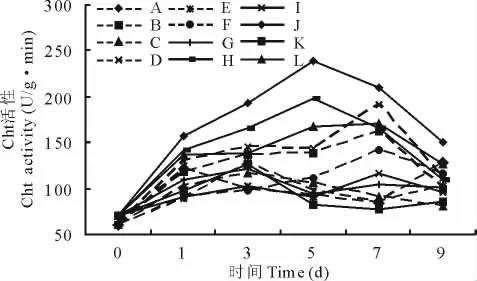
图7 H2O2与AsA处理对接种埃里砖格孢沙打旺Cht的影响Fig.7 Effect of H2O2and AsA on Cht activity of A.adsurgensinoculated with E.astragal

图8 H2O2与AsA处理对接种埃里砖格孢沙打旺SOD的影响Fig.8 Effect of H2O2and AsA on SOD activity of A.adsurgensinoculated with E.astragal
2.3.6 过氧化氢酶(CAT)活性变化 从图9可以看出,接种的感病和抗病沙打旺品种在H2O2和AsA处理后,CAT活性均呈先增高后降低的趋势,H2O2处理均不同程度提高了CAT活性,并高于对照和AsA处理,AsA处理较对照低,且抗病品种差异较大。感病品种CAT活性最高值出现在第7天,为接种H2O2处理。抗病品种接种各处理CAT活性最高值出现在第5天,H2O2处理最高。未接种沙打旺各处理间变化幅度较小。
3 讨论
通过对接菌后沙打旺H2O2含量的动态变化研究,发现无论抗病还是感病沙打旺植株,其H2O2含量均高于未被埃里砖格孢侵染的植株,而未被埃里砖格孢侵染的植株H2O2含量相对稳定。表明H2O2与植物抗病性紧密相关,在受到病原菌侵染时参与了植物体自身的防御反应[25-26]。抗病植株H2O2含量最大值出现较早,说明其在受到病原菌入侵时比感病品种能在更短的时间内进行调节对病害做出反应。
施加外源H2O2后,感病沙打旺发病率和病情指数低于对照,并达到显著差异(P<0.05),H2O2清除剂AsA处理相对于对照显著增加了发病率和病情指数。林志强等[16]的研究发现施加外源H2O2能减缓葡萄霜霉病菌侵染过程,降低发病率和病情指数。根据本研究的结果,推测其可能原因是埃里砖格孢的侵染一定程度上破坏植物体内活性氧代谢平衡,而外源H2O2的加入补偿并缓解了这种失衡,所以有外源H2O2加入时,植物自身保护系统得以加强,使其病情指数和发病率降低,同时,表明H2O2在埃里砖格孢侵染过程中作为信号分子可以调节酶系统代谢,增强植株抗病性。而抗病植株的发病率和病情指数均与对照无显著差异,但AsA处理时,其发病率和病情指数均显著高于施加外源H2O2处理,可以看出,当清除抗病沙打旺体内H2O2时,即使抗病品种,其发病率与有外源H2O2补偿时相比,差异显著(P<0.05),表明H2O2在抵御黄矮根腐病发生方面具有重要作用,虽然植物体内本身具有H2O2,但当植物受到病原菌入侵时,外源H2O2的施加可以显著改善其抗病性。
抗氧化酶在寄主植物抵抗病原菌方面扮演着不同的角色,主要通过破坏病原菌结构或强化寄主植物细胞结构来抵御病害的发生和发展[27]。酶活性的分析,发现在外源施加H2O2时接种埃里砖格孢的感病与抗病植株的各种酶活性高于对照,而AsA处理低于对照。林志强等[16]的研究也得出施加H2O2时能不同程度的提高酶活性。邱宗波等[28]研究表明,外源H2O2能够缓解水分胁迫对小麦(Triticumaestivum)幼苗生长的抑制效应,并提高受旱小麦叶片SOD、POD和CAT的活性及谷胱甘肽的含量。表明病原菌入侵植物后,自身酶反应体系调控能力在一定程度上增强,而外源H2O2处理下,进一步诱导并产生更多的抗氧化酶,强化了寄主的病害防御体系,从而增加了对埃里砖格孢的抗性;当用AsA处理时,其调控体系因缺乏H2O2,破坏了体内信号通路的动态平衡,从而无法发挥有效作用。袁庆华等[29]对苜蓿褐斑病POD、SOD、PPO等酶活性研究后得出接种病原菌后,抗病与感病苜蓿(Medicagosativa)酶活性升高,且抗病苜蓿品种酶活性高于感病品种。俞斌华[5]对沙打旺抗病机理的研究中检测到接种后酶活性升高,且抗病品种酶活性高于感病品种。本研究中我们发现,抗病和感病沙打旺植株在埃里砖格孢侵染后其各种酶活性均高于各处理下未接种的植株,而未接种沙打旺各种酶活性变化较小,说明外源H2O2及其清除剂不会对沙打旺酶调节体系产生影响,而在病原菌入侵时能够有效得提高酶体系的抗病性。以上酶活性变化情况表明,感病与抗病沙打旺植株在受到埃里砖格孢侵染时,Cht、POD、PPO、CAT、SOD和Glu均不同程度的参与了抗病调节过程,且施加外源H2O2可以有效提高其调节作用。
综上所述,外源H2O2一定程度上可以降低埃里砖格孢对感病和抗病沙打旺品种的侵染,降低发病率和病情指数,提高其酶调控体系,从而缓解沙打旺黄矮根腐病的危害,而关于被侵染时沙打旺的具体调控路径和信号通道仍需进一步研究。
Reference:
[1]Nan Z B,Liu R.Detection of seed-borne fungi ofAstragalusadsurgens.Acta Prataculturae Sinica,1997,6(4):11-16.
[2]Nan Z B.Seed-borne Fungi ofAstragalusadsurgens——environment,virulence and prevention.Acta Prataculturae Sinica,1998,7(1):12-18.
[3]Yin Y L,Nan Z B,Li C J,etal.Studies on the root-invading fungi ofAstragalusadsurgens.Grassland and Turf,2006,(1):45-48.
[4]Li Y Z,Nan Z B.A new species of Embellisia causing a disease of standing milk-vetch in China.Mycologia,2007,9(2):406-411.
[5]Yu B H.Evaluation of Resistance of Standing Milk-vetch(Astragalusadsurgens)Varieties toEmbellisiaastragali[D].Lanzhou:Lanzhou U-niversity,2011.
[6]Neill S J,Desikan R,Clarke A,etal.Hydrogen peroxide and nitric oxide as signaling molecules in plants.Journal of Experimental Botany,2002,53:1237-1247.
[7]Desikan R,Burnett E C,Hancock J T,etal.Harpin and hydrogen peroxide induce the expression of a homologue of gp91-phoxinArabidopsis Thalianasuspension cultures.Journal of Experimental Botany,1998,49:1767-1771.
[8]Grant J J,Loake G J.Role of reactive oxygen intermediates and cognate redox signaling in disease resistance.Plant Physiology,2000,124:21-29.
[9]McCabe P F,Leaver C J.Programmed cell death in cell cultures.Plant Molecular Biology,2000,44:359-368.
[10]Patykowski J,Urbanek H.Activity of enzymes related to H2O2generation and metabolism in leaf apoplastic-fraction of tomato leaves infected withBotrytiscinerea.Journal of Phytopathology,2003,151(3):153-161.
[11]Gonzalez-Teuber M,Pozo M J,Muck A,etal.Glu-canases and chitinases as causal agents in the protection of Acacia extrafloral nectar from infestation by phyto-pathogens.Plant Physiology,2010,152:1705-1715.
[12]Lu Y,Li X R,He M Z,etal.Effects of Ni and Cu on antioxidative enzymes inPeganumharmala.Acta Prataculturae Sinica,2012,21(3):147-155.
[13]Song J Z,Li P P,Fu W G.Effect of water stress and rewatering on thephysiological and biochemical characteristis ofPhalarisarundinacea.Acta Prataculturae Sinica,2012,21(2):62-69.
[14]Li Y,Li J J,Wei X H.Responses of antioxidative capability in horsebean seedling to NO and H2O2under Cd stress.Acta Prataculturae Sinica,2009,18(6):186-191.
[15]Du R F,Hao W F,Wang L F.Dynamic responses on anti-oxidative defense system and lipid peroxidation ofLespedezadavuricato drought stress and re-watering.Acta Prataculturae Sinica,2012,21(2):51-61.
[16]Lin Z Q,Guo X P,Che Y M,etal.The physiological mechanisms of NO and H2O2in increasing resistances of grape-vine toPlasmoparaviticola.Acta Phytopathologica Sinca,2011,41(6):576-586.
[17]Fang Z D.Plant Pathology Research Methods(third edition)[M].Beijing:China Agriculture Press,1998.
[18]Karkonen A,Warinowski T,Teeri T H,etal.On the mechanism of apoplastic H2O2production during lignin formation and elicitation in cultured spruce cells-peroxidases after elicitation.Planta,2009,230(3):553-567.
[19]Li Y Z.Studies of Yellow Stunt and Root Rot of Standing Milk-vetch(Astragalusadsurgens)[D].Lanzhou:Lanzhou University,2007.
[20]Li H S.Plant Physiology and Biochemistry Experimental Principles and Techniques[M].Beijing:Higher Education Press,2000.
[21]Larrigaudiere C,Vilaplana R,Soria Y,etal.Oxidative behavior of Blanquilla pears treated with 1-methylcyclopropene during cold storage.Journal of the Science of Food and Agriculture,2004,84:1871-1877.
[22]Anderson J V,Morris C F.An improved whole-seed assay for screening wheat germplasm for poly phenol oxides activity.Crop Science,2001,41:1697-1705.
[23]Dygert S,Li L H,Florida D,etal.Determination of reducing sugar with improved precision.Analytical Biochemistry,1965,13:18-23.
[24]Boller T,Gehri A,Mauch F,etal.Chitinase in bean leaves:Induction by ethylene purification properties and possible functions.Planta,1983,157:22-31.
[25]Fan B,Shen L,Liu K L,etal.Interaction between nitric oxide and hydrogen peroxide in postharvest tomato resistance response toRhizopus nigricans.Journal of the Science of Food and Agriculture,2008,88:1238-1244.
[26]Borden S,higgins V J.Hydrogen peroxide plays critical role in the defence response of tomato toCladosporiumfulvum.Physiological and Molecular Plant Pathology,2002,61:227-236.
[27]Shang H S.Plant Immunology(second edition)[M].Beijing:China Agriculture Press,2010.
[28]Qiu Z B,Sun L,Li J T,etal.Protecting effect of exogenous hydrogen peroxide on wheat seedlings damage by water stress.Bulletin of Botanical Research,2010,30(3):294-298.
[29]Yuan Q H,Gui Z,Zhang W S.Comparison of the activities of SOD,POD and PPO within alfalfa cultivars resistant and susceptible to alfalfa common leaf.Acta Prataculturae Sinica,2002,11(2):100-104.
[1]南志标,刘若.沙打旺种带真菌检测.草业学报,1997,6(4):11-16.
[2]南志标.沙打旺种带真菌——环境,致病力及防治.草业学报,1998,7(1):12-18.
[3]尹亚丽,南志标,李春杰,等.沙打旺根部入侵真菌的研究.草原与草坪,2006,(1):45-48.
[5]俞斌华.沙打旺(Astragalusadsurgens)品种对黄矮根腐病(Embellisiaastragali)的抗性评价[D].兰州:兰州大学,2011.
[12]鲁艳,李新荣,何明珠,等.Ni和Cu胁迫对骆驼蓬抗氧化酶活性的影响.草业学报,2012,21(3):147-155.
[13]宋家壮,李萍萍,付为国.水分胁迫及复水对虉草生理生化特性的影响.草业学报,2012,21(2):62-69.
[14]李源,李金娟,魏小红.镉胁迫下蚕豆幼苗抗氧化能力对外源no和H2O2的响应.草业学报,2009,18(6):186-191.
[15]杜润峰,郝文芳,王龙飞.达乌里胡枝子抗氧化保护系统及膜脂过氧化对干旱胁迫及复水的动态响应.草业学报,2012,21(2):51-61.
[16]林志强,郭秀萍,车永梅,等.NO和H2O2提高葡萄抗霜霉病的生理作用机制.植物病理学报,2011,41(6):576-586.
[17]方中达.植病研究方法(第三版)[M].北京:中国农业出版社,1998.
[19]李彦忠.沙打旺(Astragalusadsurgens)黄矮根腐病(Embellisiaastragali)的研究[D].兰州:兰州大学,2007.
[20]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[27]商鸿生.植物免疫学(第二版)[M].北京:中国农业出版社,2010.
[28]邱宗波,孙立,李金亭,等.外源过氧化氢对小麦水分胁迫伤害的防护作用研究.植物研究,2010,30(3):294-298.
[29]袁庆华,桂枝,张文淑.苜蓿抗感褐斑病品种内超氧化物歧化酶、过氧化物酶和多酚氧化酶活性的比较.草业学报,2002,11(2):100-104.

