外源钙和赤霉素对干旱胁迫下苜蓿幼苗生理特性的影响
郭郁频,任永霞*,刘贵河,曹春梅,闫利军
(1.河北北方学院动物科技学院,河北 张家口075000;2.四川省草原科学研究院,四川 成都611743)
紫花苜蓿(Medicagosativa)是世界上栽培面积最广的一种优良豆科牧草,素有“牧草之王”的美称。同时,苜蓿又是改良土壤、防止水土流失、保护生态环境的草种之一。我国北方苜蓿种植面积已达280万hm2[1],在农业产业结构调整、生态环境建设、养殖业发展中均发挥了重要作用。目前,北方苜蓿主栽区干旱缺水,水资源匮乏日益严重,干旱胁迫成为了北方旱区成功建植苜蓿的主要限制因素之一。而幼苗期又是植物生长发育过程中的一个非常重要时期,幼苗期抗旱性能的强弱将直接影响到植物是否能顺利完成整个生育期,故在实际生产中常说“保苗是关键”。
钙(Ca2+)被称为“植物代谢和发育的主要调控者”[2],它不仅是植物所需要的大量营养元素,而且是偶联胞外刺激和胞内反应的第二信使[3]。尤其在环境胁迫下,钙还与细胞内Ca2+受体-钙调蛋白(CaM)结合起作用,参与胁迫信号的感受、传递、响应和表达,能减轻环境胁迫对植物细胞膜的伤害,从而提高植物的抗逆性。赤霉素(GA3)是一类重要的植物生长调节激素,能促进多种作物种子萌发与幼芽生长,在农业生产上得到广泛的应用[4]。已有研究表明,外源钙Ca2+、GA3及Ca-GA的施用能减缓干旱胁迫的伤害,提高植物的抗旱性,已在小麦(Triticumaestivum)、水稻(Oryzasativa)、棉花(Gossypiumhirsutum)、谷子(Setariaitalica)、大豆(Glycine max)、番茄(Lycopersiconesculentum)等农作物[5-10]及药用、花卉、油料等植物应用上取得了很好的效果[11-13]。目前,干旱胁迫下钙对苜蓿抗旱性的缓解效应报道较少[3],更鲜见GA3以及Ca2++GA3复合缓解干旱胁迫对苜蓿的影响报道。
因此,本试验针对我国北方旱区苜蓿建植过程中存在缺苗、幼苗生长不良等问题,以苜蓿幼苗为试验材料,采用营养钵沙培1/2Hoagland营养液法,研究PEG-6000胁迫下外源CaCl2、GA3及CaCl2+GA3复合液处理对苜蓿苗期生理特性的影响,并应用隶属函数法探究最佳的处理浓度和复合液比例,为合理使用外源物质减轻苜蓿苗期干旱胁迫危害提供理论依据,并为北方旱区苜蓿的成功建植提供参考。
1 材料与方法
1.1 试验材料
供试的苜蓿品种为中苜一号紫花苜蓿,种子来自中国农业科学院畜牧研究所。采用1/2Hoagland营养液(不含Ca2+)[14]沙培苜蓿幼苗,于2013年3-7月在河北北方学院温室大棚与植物生理实验室内进行。播种前细沙反复冲洗并在90℃高温下灭菌5h,每个营养钵(规格:口径为14cm,高为11cm,底部不透水)放细沙100g,苜蓿种子用0.1%HgCl2浸泡10min,蒸馏水冲洗干净,晾干备用。每个营养钵均匀撒播15粒种子,再覆盖1 cm厚的细沙,用手轻轻压实,第一次每个营养钵浇灌1/2Hoagland营养液50mL。以后每天于18:00补充1/2 Hoagland营养液,以使幼苗正常生长。出苗后每个营养钵间苗留苗10株,共180个营养钵。
1.2 试验设计
待幼苗长至三叶期时,以不同处理溶液分别浇灌幼苗。
1.2.1 CaCl2处理 CK1(对照1):1/2Hoagland营养液(不进行干旱胁迫);CK2(对照2):20%PEG+1/2 Hoagland营养液(干旱胁迫);Ca5:5mmol/L CaCl2+20%PEG+1/2Hoagland营养液;Ca10:10mmol/L CaCl2+20%PEG+1/2Hoagland营养液;Ca20:20mmol/L CaCl2+20%PEG+1/2Hoagland营养液。
1.2.2 GA3处理 CK1:同上;CK2:同上;GA50:50mg/L GA3+20%PEG+1/2Hoagland营养液;GA100:100mg/L GA3+20%PEG+1/2Hoagland营养液;GA150:150mg/L GA3+20%PEG+1/2Hoagland营养液。
1.2.3 CaCl2+GA3复合液处理 用1.2.2、1.2.3 各自筛选出的最佳处理(10mmol/L CaCl2,100mg/L GA3)设计CaCl2与 GA3体积比1∶1,1∶2,2∶1和质量比1∶1四种复合液(以T1∶1,T1∶2,T2∶1和Z1∶1表示)。
10mmol/L CaCl2+20%PEG+1/2Hoagland与100mg/L GA3+20%PEG+1/2Hoagland两者分别以体积比1∶1,1∶2和2∶1混合,混合液即分别为 T1∶1、T1∶2、T2∶1,Z1∶1(质量比)为10mmol/L CaCl2+100 mg/L GA3+20%PEG+1/2Hoagland营养液。CK1、CK2同上,以Ca10、GA100为另外两个对照。
以上每处理各15个营养钵。每个营养钵浇灌50mL处理液,分两次完成。幼苗处理3d后,先在9:00-11:30进行叶绿素相对含量的测定,再剪取叶片进行叶片质膜透性的测定及酶液的制备,酶液及其余叶片0~4℃冷藏,1~2d内用于其他生理生化指标测定。
1.3 生理生化指标的测定及方法
叶绿素相对含量(SPAD值)使用SPAD-502型叶绿素含量测定仪测定。叶片质膜透性采用电导率法[15],用相对电导率表示。丙二醛(malondialdehyde,MDA)含量采用硫代巴比妥酸(TBA)比色法[15]。脯氨酸(proline,Pro)含量采用酸性茚三酮法[15]。超氧化物歧化酶(superoxide dismutase,SOD)活性的测定采用南京建成生物公司的试剂盒进行。过氧化物酶(peroxidase,POD)活性采用愈创木酚法[15]。以上指标除相对叶绿素含量6次重复(每重复在幼苗顶端小叶叶片上测定3个固定部位,测10个叶片)外,其他指标均各3次重复。
1.4 数据统计分析
用Excel软件处理数据,SPSS 17.0软件进行单因子方差分析,差异显著时用LSD法进行多重比较。百分率数据方差分析前进行反正弦转换。
利用隶属函数法[16]对CaCl2、GA3及CaCl2+GA3复合液处理对干旱胁迫下苜蓿幼苗缓减的生理效应进行综合评价。每个样品各项指标的具体隶属函数值计算公式为:

式中,X为参试样品某一抗旱指标的测定值,Xmax、Xmin分别为所有试样中该指标的最大值和最小值,若所测指标与植物的抗旱性呈正相关,则采用(1)式计算隶属值,负相关则用(2)式。最后把每个试样各项指标隶属函数值累加,取其平均值。平均值越大,抗旱性越强,反之,抗旱性越弱。
2 结果与分析
2.1 CaCl2、GA3及其复合液对干旱胁迫下苜蓿幼苗叶绿素相对含量的影响
为了探讨CaCl2、GA3及复合液对叶绿素相对含量的影响,进行了方差分析,结果表明,各处理间叶绿素相对含量的差异达到显著水平(F值为2.416,P=0.015<0.05)。由表1可知,干旱胁迫下CK2的叶绿素相对含量比正常幼苗 CK1的低;Ca5、Ca10、GA50、T1∶1、T1∶2、T2∶1处理叶绿素相对含量都高于 CK2,且 Ca10、T2∶1处理与CK2差异显著,Ca10、T2∶1间差异不显著;Ca10、GA50间差异显著,GA50、T2∶1间差异不显著。可见,经适宜的CaCl2、GA3及复合液处理能提高干旱胁迫下苜蓿幼苗叶片叶绿素相对含量。
2.2 CaCl2、GA3及其复合液对干旱胁迫下苜蓿幼苗相对电导率的影响
从表1中相对电导率数据可以看出,干旱胁迫下CK2幼苗叶片的相对电导率显著高于正常幼苗CK1,是正常幼苗CK1的1.3倍,说明质膜受到伤害,幼苗受到了伤害。经CaCl2、GA3及复合液处理的相对电导率均低于或显著低于CK2,并且Ca10与CK2差异显著,Ca10与CK1间差异不显著;GA50与CK1差异显著,GA100、GA150与CK1差异不显著;4个复合液处理的相对电导率与CK1均无显著性差异,说明复合液处理都有保护细胞膜的作用。因此,就相对电导率而言,CaCl2以10mmol/L为好,GA3以50和100mg/L较好,复合液以 T1∶1、T2∶1为好。
2.3 CaCl2、GA3及其复合液对干旱胁迫下苜蓿幼苗MDA含量的影响
不同处理MDA含量变化见表1。干旱胁迫下CK2幼苗叶片MDA含量比CK1显著升高,是CK1的1.7倍。经CaCl2、GA3及复合液处理后,除GA150和Z1∶1外,其他各处理MDA含量均降低,说明适宜的外源物质能减少膜脂过氧化产物 MDA的生成。其中,Ca5、Ca10、GA50、T1∶1、T1∶2处理与CK1差异不显著,与CK2差异显著,且T1∶1处理MDA含量最低。因此,就MDA含量而言,干旱胁迫下,CaCl2以5~10mmol/L、GA3以50mg/L、复合液以T1∶1处理效果较好。
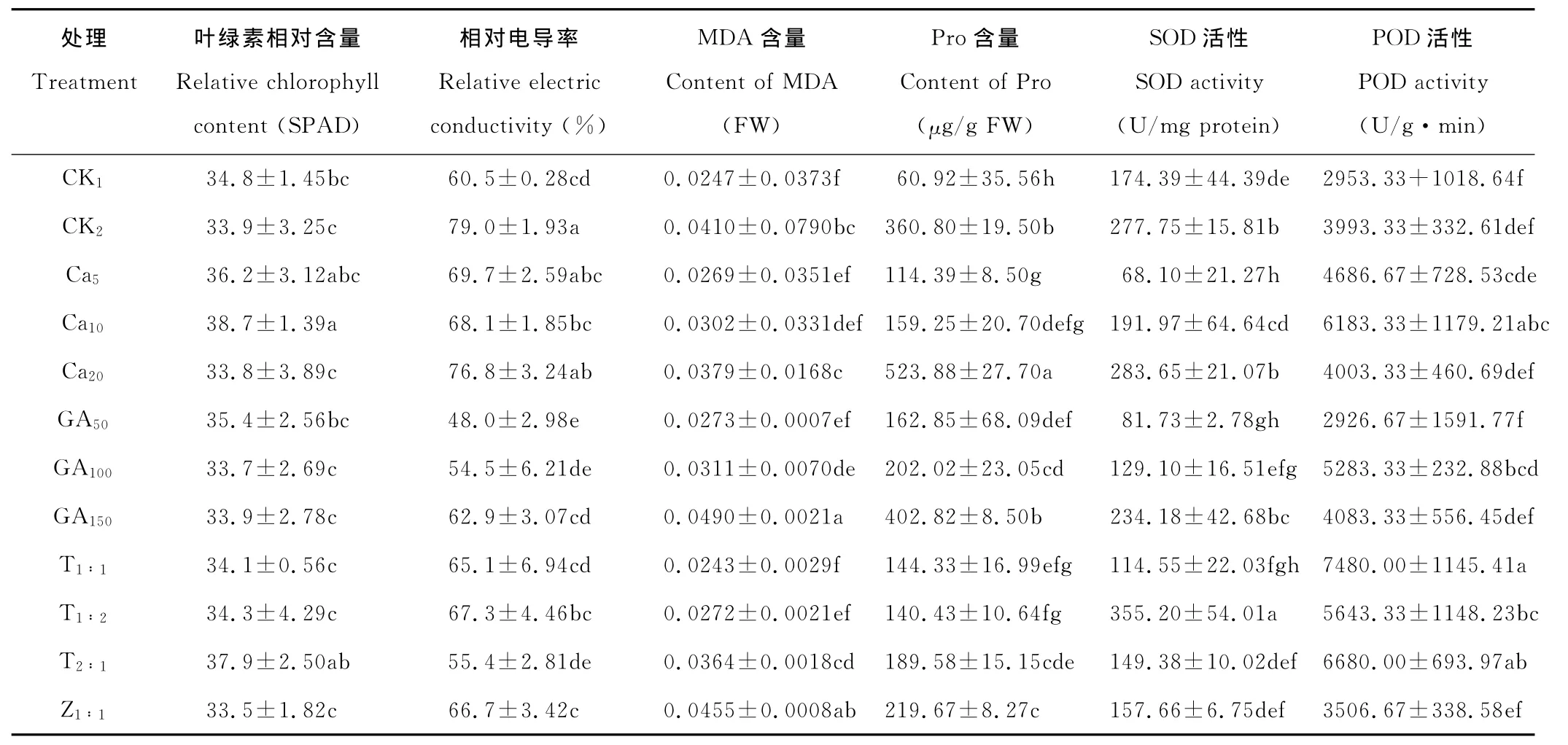
表1 CaCl2和GA3及复合液处理对干旱胁迫下苜蓿幼苗生理生化指标的影响Table 1 Effect of CaCl2,GA3and complex liquid on physiological and biochemical indicators of the seedlings of alfalfa under drought stress
2.4 CaCl2、GA3及其复合液对干旱胁迫下苜蓿幼苗脯氨酸含量的影响
由表1可知,干旱胁迫下CK2幼苗叶片脯氨酸含量显著上升,为CK1的5.9倍,其他各处理脯氨酸含量也均高于CK1,Ca5、Ca10、Ca20脯氨酸含量分别为CK1的1.9,2.6和8.6倍;GA50、GA100、GA150分别为 CK1的2.7,3.3和6.6倍;复合液T1∶1、T1∶2、T2∶1与Z1∶1分别为CK1的2.4,2.3,3.1和3.6倍。方差分析结果表明,脯氨酸含量在各处理间(F值为74.718)的差异达显著水平。与CK2相比,脯氨酸含量随着CaCl2、GA3浓度的升高呈先下降后上升的趋势,Ca20、GA150处理显著高于CK2,Ca5、Ca10、GA50和GA100处理显著低于CK2;各复合液处理脯氨酸含量均显著低于CK2,并且T1∶1、T1∶2处理低于Ca10、GA50处理,显著低于GA100、Z1∶1处理,T1∶1与T1∶2间差异不显著。
2.5 CaCl2、GA3及其复合液对干旱胁迫下苜蓿幼苗SOD活性的影响
由表1可知,苜蓿幼苗在干旱胁迫下,其SOD活性明显升高,CK2是CK1的1.6倍,CK2与CK1间差异显著,提示细胞中抗氧化酶体系动态平衡被打破。当外源施用不同浓度的CaCl2、GA3后,SOD活性呈现随CaCl2、GA3浓度的升高而增加的趋势,CaCl2、GA3分别以Ca20、GA150处理的SOD活性最高,清除活性氧能力最强,且Ca20、GA150间差异不显著;复合液处理中,T1∶2的SOD活性最高,并且T1∶2处理显著高于Ca20、GA150处理。
2.6 CaCl2、GA3及其复合液对干旱胁迫下苜蓿幼苗POD活性的影响
方差分析结果显示,CaCl2、GA3及复合液处理对POD活性的影响达显著水平(F值为7.695)。由表1可知,CK2的POD活性高于CK1,是CK1的1.4倍。CaCl2处理中,Ca10处理的POD活性最高,其次为Ca5、Ca20;GA3处理中,GA100的POD活性最高,其次为GA150、GA50;复合液处理中,T1∶1的POD活性最高,其次为T2∶1、T1∶2、Z1∶1。并且Ca10、T1∶1、T2∶1、T1∶2与CK2差异显著,GA100与CK2差异不显著。可见,不同处理可以促进干旱胁迫下苜蓿幼苗叶片POD活性的增加,并且各以10mmol/L CaCl2、50mg/L GA3及复合液T1∶1的效果较好。
2.7 CaCl2、GA3及其复合液对干旱胁迫下苜蓿幼苗缓减的生理效应综合评价
采用隶属函数法分别对干旱胁迫下不同处理对苜蓿幼苗6个生理生化指标的影响进行全面、综合的评价,比较不同处理对苜蓿幼苗抗旱性影响的大小。隶属函数分析结果表明(表2),在CaCl2处理中,Ca10即10mmol/L CaCl2效果最好,在GA3处理中,GA100即100mg/L GA3效果最好,在CaCl2+GA3两种外源物质复合液处理中,T1∶1处理效果最好,且优于单独的Ca10、GA100处理。各个处理对苜蓿幼苗干旱下的缓解效应从强到弱依次为:T1∶1>10mmol/L CaCl2>T2∶1>CK1>T1∶2>100mg/L GA3>Z1∶1>CK2。
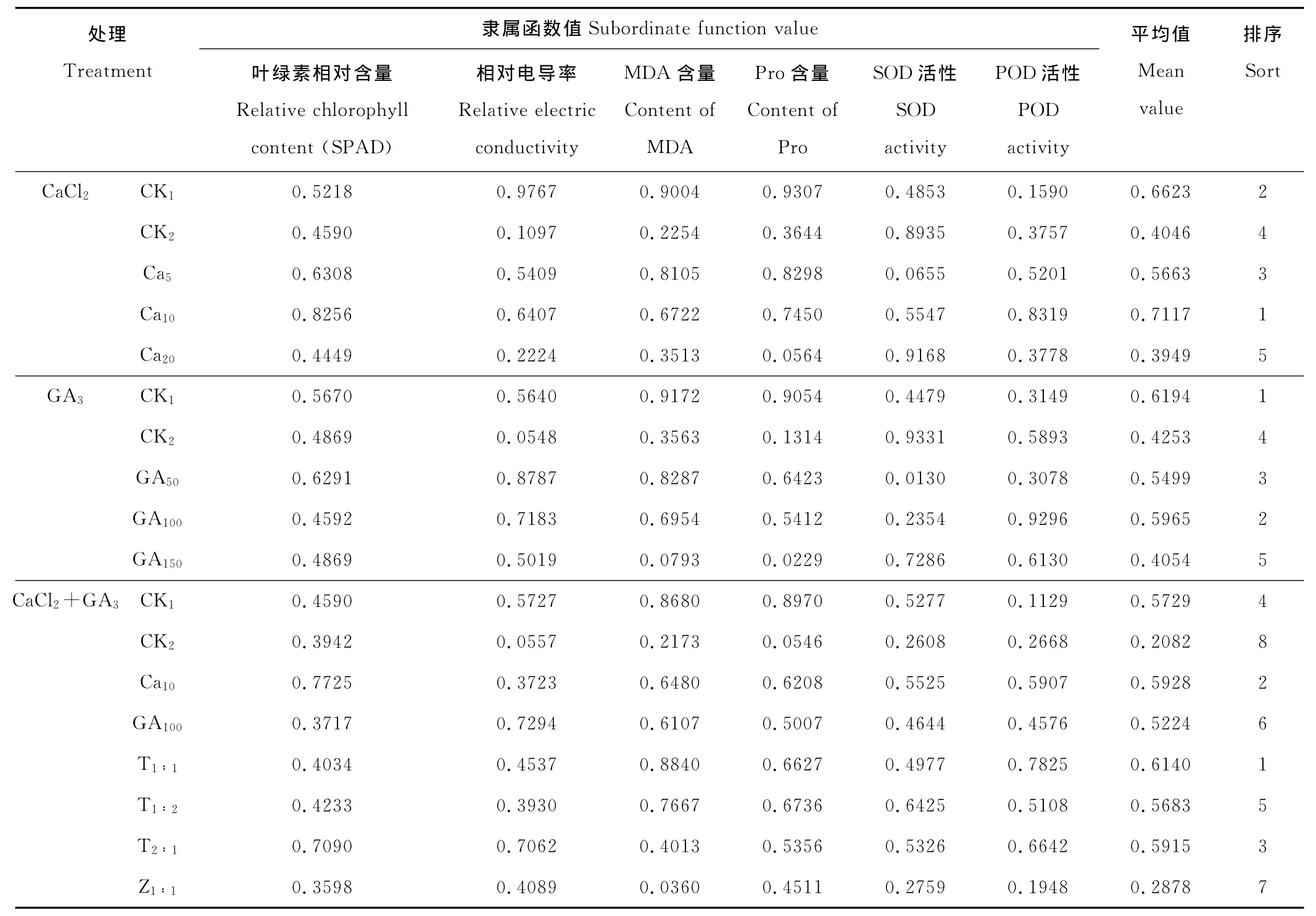
表2 CaCl2和GA3及复合液处理对干旱胁迫下苜蓿幼苗抗旱性影响的综合评价Table 2 Comprehensive evaluation of the effect of CaCl2,GA3and complex liquid on the drought tolerance of the seedlings of alfalfa
3 讨论
叶绿素是植物进行光合作用的主要物质,反映了牧草生长的内在动力。受到干旱胁迫时,植物气孔发生关闭使得净光合作用降低。当叶绿素含量升高时,植物的光合速率就相应地加快,植物的生长状况就越好[17]。本研究中,干旱胁迫下叶绿素相对含量下降,而经 Ca5、Ca10、GA50、GA150及复合液 T1∶1、T1∶2、T2∶1处理后,叶绿素含量都有所提升,表明CaCl2、GA3及复合液在一定程度上能提升苜蓿幼苗的光合速率,有利于增强抗旱性。其中,CaCl2以10mmol/L的处理效果最好,GA3以50mg/L处理效果最好,复合液以T2∶1处理效果最好。
MDA和电导率是植物受伤害的两个重要的生理指标。MDA是植物细胞膜脂过氧化最主要的产物之一,其含量通常用于评价膜脂过氧化的程度;电导率是判定植物细胞膜稳定性的一个重要指标[18]。MDA含量越多,电导率越大,说明植物受伤害的程度越严重[19]。本研究中,干旱胁迫下苜蓿幼苗叶片相对电导率、MDA含量均显著增加,表明胁迫下细胞膜脂过氧化程度加剧,质膜遭到破坏。外源施用10mmol/L CaCl2、100mg/L GA3及T1∶1、T2∶1复合液后,相对电导率下降、MDA含量显著降低,说明外源物质可以缓解干旱胁迫造成的苜蓿幼苗叶片的膜脂过氧化,对细胞膜具有保护和修复作用,可减轻或防止膜系统的过氧化伤害。这与姜义宝等[3]的研究结果一致。
正常条件下,植物细胞内的活性氧处于动态平衡,逆境时,植物体内产生大量活性氧,对植物造成伤害。SOD和POD为植物体内重要的活性氧清除酶,与其他保护酶类协同清除逆境胁迫下过量的活性氧,维持活性氧的代谢平衡[20]。多数研究表明,植物在遭受逆境胁迫时,其体内SOD、POD活性均会上升[21]。本研究也表明,在干旱胁迫下,苜蓿幼苗的SOD活性、POD活性均显著上升,这与姜义宝等[22]的研究一致,说明抗氧化酶系统遭到破坏,幼苗生长受到抑制。当加入不同处理的外源物质后,其活性氧清除能力表现出差异。外源CaCl2浓度为10 mmol/L、GA3浓度为100mg/L时,POD活性最高;外源CaCl2浓度为20mmol/L、GA3浓度为150mg/L时,SOD活性最高;复合液以T1∶2处理的SOD活性最高,以T1∶1处理的POD活性最高。研究结果表明,在上述外源物质适宜浓度及复合液处理下,可使干旱胁迫下苜蓿幼苗体内的保护酶活性得到改善和增强,从而清除植物在逆境中产生的过量活性氧,在一定程度上忍耐、减缓或抵御逆境胁迫伤害,保护植株正常生长。
植物受到干旱胁迫时,植物体内的Pro含量会积累。目前,Pro含量的增加与植物耐旱性之间的关系存在不同的看法,有研究表明Pro的积累可对质膜起保护作用,降低电解质外渗,从而维护细胞正常的代谢活动,也有研究认为逆境下Pro积累是受到伤害的征兆[23]。在本试验中,干旱胁迫下Pro含量显著升高,低浓度CaCl2、GA3及4个复合液处理后Pro含量均降低,而高浓度CaCl2、GA3处理Pro含量积累量更高。表明干旱胁迫抑制了脯氨酸Pro的代谢,低浓度CaCl2、GA3及4个复合液处理使干旱胁迫有所缓解。这与玉米(Zeamays)、小麦的研究结果一致[24-25]。但与姜义宝等[3]的研究结果不一致。
4 结论
干旱胁迫下,苜蓿幼苗经一定浓度的外源CaCl2、GA3及复合液处理时,外源物质的施用可显著降低干旱胁迫对苜蓿幼苗的伤害,减轻、缓解干旱胁迫并提高了苜蓿幼苗的抗旱性。外源CaCl2、GA3的最佳处理浓度分别为10mmol/L、100mg/L,CaCl2+GA3复合液处理以体积比1∶1最好。隶属函数综合评价不同处理对苜蓿幼苗干旱下的缓解效应从强到弱依次为:T1∶1>10mmol/L CaCl2>T2∶1>CK1>T1∶2>100mg/L GA3>Z1∶1>CK2。
[1]Mu H B,Fu B Z,De Y.Drought tolerance of alfalfa seedlings of 10varieties under PEG-6000stress.Pratacultural Science,2011,28(10):1809-1814.
[2]Zhou S Y,Jiang J,Gao L Y,etal.Effects of CaCl2concentration on physiology of Brazil banana seedling under NaCl stress.Chinese Journal of Applied & Environmental Biology,2014,20(3):449-454.
[3]Jiang Y B,Li J H,Fang L Y,etal.Effect of calcium on drought resisting of alfalfa seedlings.Chinese Journal of Grassland,2008,30(1):117-119.
[4]Zhao P,Bai X L,Han H X,etal.Effect of GA3on the germination andα-amylase activity ofPugioniumcornutum(L.)Gaertn.seeds at different temperatures.Acta Agriculturae Boreali-Sinica,2011,26(1):127-130.
[5]Yang J X,Zhang T,Wang L.Effects of Ca-GA mixture and phosphorus on chlorophyll fluorescence parameters.Journal of Anhui Agricultural Sciences,2005,33(2):210-212,222.
[6]Xu X,He J,Li S H,etal.Effect of calcium and gibberellin mixture on drought resistance of soaked rice seed during germination and young seedlings.Acta Botanica Boreali-Occidentalia Sinica,2003,23(1):44-48.
[7]Tang J X,Li G L.Effects of GA-Ca2+mixture solution on drought hardiness of cotton seeds.Seed,2004,23(4):26-27,34.
[8]Gao X Y,Yang G P,Xu Z Q,etal.Effect of calcium on anti-oxidant enzymes of lipid peroxidation of soybean leaves under water stress.Journal of South China Agricultural University,1999,20(2):7-12.
[9]Pei S S,Wang Y G,Yin M Q,etal.Effect of compound seed soaking on seed germination and seedling growth in mille(Setariaitalica)under drought stress.Journal of Shanxi Agricultural Sciences,2013,41(7):676-679.
[10]Lv B,Xu Y Z,Wang Z J,etal.Effect of polyethylene glyco stress on seedling growth and seed germination of tomato with gibberellin soaking.Agricultural Research in the Arid Areas,2009,27(4):136-139.
[11]He M,Yang X R,Liu X D.Effects of Ca2+on the physiological response and mesophyll ultrastructure in leaves ofHemerocallismiddendorfiiunder osmotic stress.Chinese Journal of Grassland,2012,34(1):84-88.
[12]Mao J J,Ni T,Wang S H,etal.Effects of exogenous calcium on some hysiological characteristics ofJatrophacurcasL.under drought stress.Journal of Sichuan University(Natural Science Edition),2008,45(3):669-673.
[13]Li Q,Cao J H,Yu L J,etal.Effect of exogenous calcium on the photosynthetic characteristics ofLonicerajaponicaThunb under drought stress.Ecology and Environmental Sciences,2010,19(10):2291-2296.
[14]Yang X G,Fu H,Niu D C.Response of physiology ofZygophyllumxanthoxylumseedlings under drought stress.Acta Prataculturae Sinica,2007,16(5):107-112.
[15]Wang X K.Experimental Principle and Technology of Plant Physiology and Biochemistry(Second edition)[M].Beijing:Higher Education Press,2006.
[16]Jia X J,Dong L H,Ding C B,etal.Effects of drought stress on reactive oxygen species and their scavenging systems inChlorophytumcapensevar.medio-pictumleaf.Acta Prataculturae Sinica,2013,22(5):248-255.
[17]Wang J H,Duo D.Effect of paclobutrazol on drought resistance of six turfgrass cultivars during the seedling stage.Acta Prataculturae Sinica,2014,23(6):253-258.
[18]Li Z,Peng Y,Su X Y.Physiological responses of white clover from different leaf types associated with anti-oxidative enzyme protection and osmotic adjustment under drought stress.Acta Prataculturae Sinica,2013,22(2):257-263.
[19]Yi X L,Yang B X,Zong X F,etal.Signal chemical salicylic acid mitigates the negative effects of drought on photosynthesis and membrance lipid peroxidation of purple majesty.Acta Ecologica Sinica,2011,31(1):0067-0074.
[20]Shi Z Z,Li S,Yang K,etal.Physiological and biochemical response of pea seedlings to endogenous and exogenous NO under salt stress.Acta Prataculturae Sinica,2014,23(5):193-200.
[21]Wang B,Li C D,Ma Z Z,etal.Study on drought resistance at seedling stage of 4varieties of tall fescue.Journal of Agricultural Sciences,2011,32(3):22-26.
[22]Jiang Y B,Cui G W,Li H.Effect of coatingMedicagosativaseeds in calcium on drought resistance and interrelated physiological indexes under drought conditions.Acta Prataculturae Sinica,2005,14(5):32-36.
[23]Zhang C S,Liu G B,Xue S,etal.Photosynthetic characteristics ofBothriochloaischaemumunder drought stress and elevated CO2concentration.Chinese Journal of Applied Ecology,2012,23(11):3009-3015.
[24]Wang Y F,Wang Q X,Shang L W.Effects of calcium on root activity and the content of osmotic adjustable organic substances of maize seedlings under NaCl stress.Journal of Maize Sciences,2008,16(2):66-70.
[25]Wang Z Q,Wang F F,Lin T B.Effects of calcium on proline content and related enzymes activities in wheat seedlings under salinity.Journal of Henan Agricultural University,2009,43(5):475-479.
参考文献:
[1]穆怀彬,伏兵哲,德英.PEG-6000胁迫下10个苜蓿品种幼苗期抗旱性比较.草业科学,2011,28(10):1809-1814.
[2]周双云,蒋晶,高龙燕,等.不同浓度CaCl2对盐胁迫下巴西蕉幼苗生理的影响.应用与环境生物学报,2014,20(3):449-454.
[3]姜义宝,李建华,方丽云,等.钙处理对苜蓿幼苗抗旱性的影响.中国草地学报,2008,30(1):117-119.
[4]赵鹏,白晓雷,韩海霞,等.赤霉素对不同温度下沙芥种子萌发特性及α-淀粉酶活性的影响.华北农学报,2011,26(1):127-130.
[5]杨俊兴,张彤,王磊.Ca-GA合剂和磷浸种对水分胁迫条件下冬小麦萌发及幼苗叶绿素荧光参数的影响.安徽农业科学,2005,33(2):210-212,222.
[6]许兴,何军,李树华,等.Ca-GA合剂浸种对水稻萌发及幼苗期抗旱性的影响.西北植物学报,2003,23(1):44-48.
[7]汤菊香,李广领.赤霉素与Ca2+对水分胁迫下棉花种子发芽的影响.种子,2004,23(4):26-27,34.
[8]高向阳,杨根平,许志强,等.水分胁迫下钙对大豆膜脂过氧化保护酶系统的影响.华南农业大学学报,1999,20(2):7-12.
[9]裴帅帅,王玉国,尹美强,等.复配浸种对干旱胁迫下谷子萌发及幼苗生长的影响.山西农业科学,2013,41(7):676-679.
[10]吕彪,许耀照,王治江,等.聚乙二醇胁迫下赤霉素浸种对番茄种子萌发和幼苗生长的影响.干旱地区农业研究,2009,27(4):136-139.
[11]何淼,杨絮茹,刘晓东.钙对渗透胁迫下大花萱草幼苗生理响应及叶肉组织超微结构的影响.中国草地学报,2012,34(1):84-88.
[12]毛俊娟,倪婷,王胜华,等.干旱胁迫下外源钙对麻疯树相关生理指标的影响.四川大学学报(自然科学版),2008,45(3):669-673.
[13]李强,曹建华,余龙江,等.干旱胁迫过程中外源钙对忍冬光合生理的影响.生态环境学报,2010,19(10):2291-2296.
[14]杨鑫光,傅华,牛得草.干旱胁迫下幼苗期霸王的生理响应.草业学报,2007,16(5):107-112.
[15]王学奎.植物生理生化实验原理和技术(第2版)[M].北京:高等教育出版社,2006.
[16]贾学静,董立花,丁春邦,等.干旱胁迫对金心吊兰叶片活性氧及其清除系统的影响.草业学报,2013,22(5):248-255.
[17]王竞红,多多.多效唑对6种草坪草苗期抗旱性影响的研究.草业学报,2014,23(6):253-258.
[18]李州,彭燕,苏星源.不同叶型白三叶抗氧化保护及渗透调节生理对干旱胁迫的响应.草业学报,2013,22(2):257-263.
[19]易小林,杨丙贤,宗学凤,等.信号分子水杨酸减缓干旱胁迫对紫御谷光合和膜脂过氧化的副效应.生态学报,2011,31(1):0067-0074.
[20]时振振,李胜,杨柯,等.盐胁迫下豌豆幼苗对内外源NO的生理生化响应.草业学报,2014,23(5):193-200.
[21]王彬,李长鼎,马仲泽,等.4个高羊茅品种幼苗期抗旱性比较研究.农业科学研究,2011,32(3):22-26.
[22]姜义宝,崔国文,李红.干旱胁迫下外源钙对苜蓿抗旱相关生理指标的影响.草业学报,2005,14(5):32-36.
[23]张昌胜,刘国彬,薛萐,等.干旱胁迫和CO2浓度升高条件下白羊草的光合特征.应用生态学报,2012,23(11):3009-3015.
[24]王玉凤,王庆祥,商丽威.钙对NaCl胁迫下玉米幼苗根系活力和有机渗透调节物质含量的影响.玉米科学,2008,16(2):66-70.
[25]王志强,王丰峰,林同保.钙离子对盐胁迫小麦幼苗脯氨酸含量及其相关酶活性的影响.河南农业大学学报,2009,43(5):475-479.

