苜蓿根瘤菌对不同形态磷利用效率的研究
刘卢生,玉永雄*,郭蕾,胡艳,周磊,王荣
(1.西南大学动物科技学院,重庆市高校草食动物工程中心,重庆400715;2.农民日报社,北京100089)
紫花苜蓿(Medicagosativa)作为一种优质牧草,在世界草食畜牧业中起着不可替代的作用,我国畜牧业对苜蓿的需求量也逐年攀升,但我国的供应远不能满足需求,因此近年来,我国苜蓿的种植面积不断扩大,甚至在南方的四川、云南、贵州、江苏等地也开始种植[1]。紫花苜蓿是豆科植物,苜蓿-根瘤菌这一共生固氮体系的稳定高效是栽培苜蓿获得高产的关键因素,而在实际生产中有效磷的缺乏常常是限制苜蓿-根瘤菌体系高效运转的重要原因。在我国,不管是北方还是南方,种植苜蓿的地块多数为较贫瘠、土层薄的边缘地带,这些地区在北方通常为盐碱地,在南方则多数为酸性土,这些土壤中的磷多数为难溶性的磷酸钙、磷酸铝和磷酸铁[2],可溶性的有效磷含量很少,因此,土壤有效磷缺乏是限制苜蓿在这类土壤中产量提高的主要因素。
已有的研究表明,在有效磷缺乏的土壤上,豆科植物接种根瘤菌可以促进植株对磷的吸收利用,增加植株磷含量[3-7]。近年来,研究已发现部分豆科根瘤菌存在多种解磷机制[4,8-9],正是这些解磷机制使根瘤菌-豆科植物能利用难溶性磷,保证了这些豆科植物在低有效磷土壤上的正常生长。
虽然苜蓿是一种重要的豆科植物,但苜蓿根瘤菌对难溶性磷利用的研究较少,仅有的少数研究也是针对碱性土壤中普遍存在的钙-磷进行[10-11],而酸性土壤中主要的难溶性磷为铝-磷和铁-磷,目前尚未见苜蓿根瘤菌对它们利用性的报道。因此,本研究利用多种土壤中常见的难溶性磷替代普通培养基中的磷,研究耐酸的根瘤菌对不同难溶性磷的利用和根瘤菌生长对磷可利用性的影响,为根瘤菌的选育、改造和生产实际提供依据。
1 材料与方法
1.1 供试菌种
供试菌种是菌株S01和S02,为西南大学重庆市牧草与草食家畜重点实验室筛选出的耐酸苜蓿根瘤菌,2个菌株都能在紫花苜蓿植株上正常结瘤。
1.2 培养基
预培养的培养基:采用酵母琼脂培养基(yeast morphology agar medium,YMA培养基):甘露醇10g/L、酵母膏1.5g/L、K2HPO4·3H2O 681mg/L、MgSO4·7H2O 0.2g/L、NaCl 0.1g/L,Rh微量2mL(Rh微量:H3BO35g/L,Na2MoO45g/L),固体培养基加8g/L的琼脂。
试验处理的培养基:
1)无磷培养基:作为无磷对照(CK),为无磷低酵母含量的YMA培养基,因酵母膏含大量有机氮、磷、多种未知营养和生长因子,为降低有机磷和未知营养因子对实验的影响,将酵母膏添加量减少到0.1g/L(根瘤菌生长必需酵母膏提供生长因子,否则难以正常生长),同时为补充根瘤菌生长必需的氮源,添加(NH4)2SO40.2g/L;为补充 K,添加 KCl 0.2g/L。
2)酵母膏有机磷培养基:作为对照CKYE-P,为添加正常含量酵母膏的YMA培养基,即:对照培养基[不添加(NH4)2SO4]+酵母膏1.5g/L。
3)可溶性无机磷培养基:作为对照CKP,为添加正常含量K2HPO4的培养基,即对照培养基(不加KCl)+K2HPO4·3H2O 0.681g/L。
4)植酸钙镁培养基(TPhy-P):对照培养基+植酸钙镁3g/L。
5)磷酸钙培养基(TCa-P):对照培养基+Ca3(PO4)23g/L。
6)磷酸铝培养基(TAl-P):对照培养基+AlPO43g/L。
7)磷酸铁培养基(TFe-P):对照培养基+FePO4·4H2O 3g/L。
固体培养基添加15g/L的琼脂粉和25mg/L的刚果红。
1.3 试验方法
试验在2014年3-5月进行,分固体培养和液体培养两类处理。
1.3.1 固体平板培养基上不同磷源对苜蓿根瘤菌菌落生长的影响 试验设计:采用三因素完全随机试验设计,试验包括3个pH 条件(pH 4.1,7.0和9.0)、7个不同磷源(CK、CKYE-P、CKP、TPhy-P、TCa-P、TAl-P和 TFe-P),2个耐酸苜蓿根瘤菌菌株(S01和S02),共3×7×2=42个处理,每个处理2个重复(平板),每个平板接种6个点。
固体培养基的配制:Ca3(PO4)2、AlPO4、FePO4·4H2O和植酸钙镁121℃各自单独灭菌17min,随后与灭菌后的其他成分混合,用1mol/L的盐酸或者NaOH调节至所需的pH,随后培养基放置24h后再次用盐酸或NaOH调节至所需pH,再与灭菌后的琼脂刚果红混合,持续搅拌摇匀,使固体沉淀平均分布于培养基中,待温度降低到40℃时倒入直径9cm培养皿中。因CK、CKYE-P和CKp3个对照培养基的pH变化较小,故直接将所有成分混合灭菌倒培养皿。
根瘤菌的接种和培养:2014年3月,将2个保存菌株经正常培养30h后的培养液12000r/min离心2min,弃上清(弃去有磷培养液),将菌体用无菌蒸馏水稀释,调整吸光度至0.2,吸取6μL接种一个点,每个平板接种6个点,每个处理接种两个平板,随后置于28℃静置培养96h后记录菌落形态并利用直尺测定菌落直径。
1.3.2 液体培养条件下不同磷源对苜蓿根瘤菌生长、培养液pH和有效磷含量的影响 试验设计:采用三因素完全随机试验设计,试验包括3个pH 条件(pH 4.1,7.0和9.0)、7个不同磷源(CK、CKYE-P、CKP、TPhy-P、TCa-P、TAl-P和 TFe-P),2个耐酸根瘤菌菌株(S01和S02)和未接种对照,共3×7×3=63个处理,每个处理2个重复。
液体培养基的配制:Ca3(PO4)2、AlPO4、FePO4·4H2O和植酸钙镁121℃各自单独灭菌17min,随后与灭菌后的其他成分混合,用1mol/L的盐酸或者NaOH调节至所需的pH,随后培养基放置24h后再次用盐酸或NaOH调节至所需pH。因CK、CKYE和CKp培养基的pH变化较小,故直接将所有成分混合灭菌倒培养皿。
根瘤菌的接种和培养:菌液的预培养和稀释同1.3.1,吸取蒸馏水稀释后的菌液20μL接入各三角瓶,28℃120r/min培养72h后测定菌液吸光度、培养液pH和有效磷含量(未接种对照一起培养,一起测定)。吸光度使用的是HITACHI U-1800分光光度计在600nm处进行测定,比色皿为1.0cm×0.5cm的玻璃比色皿,为减小不溶沉淀对吸光度测定的影响,所有处理的吸光度测定都以相应未接种对照作为空白进行调0;培养后培养液的pH使用雷磁PHS-3CpH计进行测定;液体培养结束后,吸取2mL培养液12000r/min 4℃离心20min,然后吸取上清液测定溶液中的有效磷,磷测定采用钼锑抗比色法[8]。
1.4 数据处理
采用SPSS进行试验数据的方差分析和多重比较。
2 结果与分析
2.1 固体平板上不同磷源对苜蓿根瘤菌菌落生长的影响
酸性、中性和碱性条件下,苜蓿根瘤菌菌株S01和S02在不同磷培养基平板上生长96h后的菌落直径见表1。比较3个对照的菌落直径发现,无磷CK的菌落直径最小,显著低于酵母膏对照CKYE-P和无机可溶性磷对照CKP,且其菌落中根瘤菌生长量很小,显著小于CKYE-P和CKP菌落,说明磷是影响根瘤菌生长和菌落直径的关键因素,缺磷使根瘤菌生长受到显著的抑制。
4个不同磷源处理中,植酸钙镁处理(TPhy-P)菌落直径最大,磷酸钙处理(TCa-P)次之,而磷酸铝处理(TAl-P)和磷酸铁处理(TFe-P)在各条件下的菌落直径都较小,说明在固体培养条件下植酸钙镁和磷酸钙是根瘤菌生长的较有效的磷源,而磷酸铝和磷酸铁则较难被根瘤菌利用。
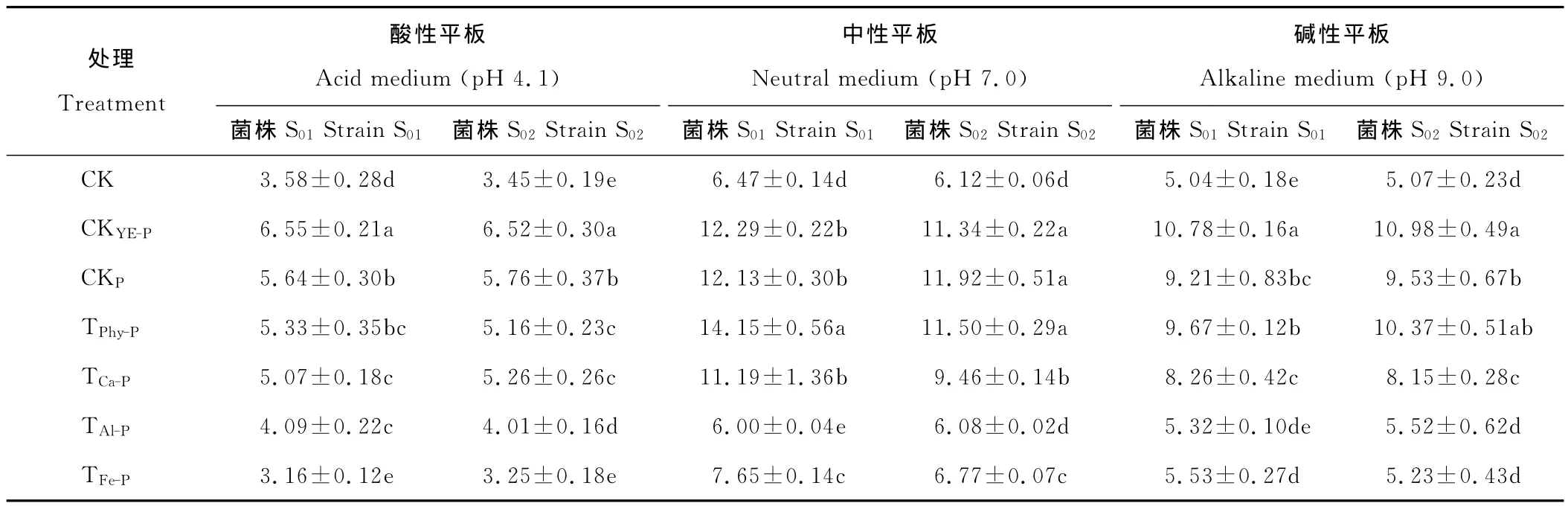
表1 不同磷源固体平板上的根瘤菌菌落直径Table 1 The rhizobia’s colony diameter in solid medium with different form phosphorus mm
2.2 液体培养基中不同磷源对苜蓿根瘤菌生长、培养液pH和有效磷含量的影响
2.2.1 不同pH条件下不同磷源对苜蓿根瘤菌生长的影响 在中性和碱性条件下,添加到液体培养基中的不溶性磷以沉淀形态存在,在调节pH前后、灭菌前后无明显变化,培养后仍见明显沉淀。但在酸性条件下(pH 4.1),添加植酸钙镁的培养基在调节pH过程中,植酸钙镁溶解,高压灭菌和接种培养后也一直保持澄清。其原因在于植酸钙镁在酸性条件下转变为可溶性的植酸[9],故沉淀消失。
苜蓿根瘤菌在添加不同形态磷的酸性、中性和碱性培养液中培养72h后的吸光度见表2。在3种pH条件下,无磷对照CK的吸光度皆很小,而添加正常量酵母膏的对照CKYE-P和可溶性无机磷对照CKP的吸光度皆显著高于无磷对照CK,说明有效磷(不管是有机磷还是无机磷)是影响根瘤菌生长的关键因素。
比较不同难溶性磷处理中苜蓿根瘤菌吸光度发现,不管是在酸性、中性还是碱性条件下,TPhy-P和TCa-P的根瘤菌吸光度皆高于相同pH 条件的 TAl-P和 TFe-P,如中性条件下,TPhy-P和 TCa-P的吸光度在1.2以上,而 TAl-P和 TFe-P的吸光度皆小于1;碱性条件下,TPhy-P和TCa-P的吸光度在0.6以上,而TAl-P和TFe-P的吸光度不到0.1,这说明植酸钙镁和磷酸钙是有效的根瘤菌生长所需磷源,而磷酸铝和磷酸铁则较难被利用。
较为特殊的是酸性条件下的植酸钙镁处理(TPhy-P),因植酸钙镁在酸性条件下转变为植酸而完全溶解,但其根瘤菌吸光度却很低,其原因在于植酸钙镁生成的植酸是防腐剂,能抑制多种细菌生长,故根瘤菌的生长也受到抑制。
2.2.2 不同磷源培养基中根瘤菌生长对培养液pH的影响 各处理培养72h后培养液的pH测定结果(表3)显示,除酸性条件下的TCa-P外,所有对照和处理的培养液pH都呈下降趋势,说明根瘤菌生长中分泌酸性物质。
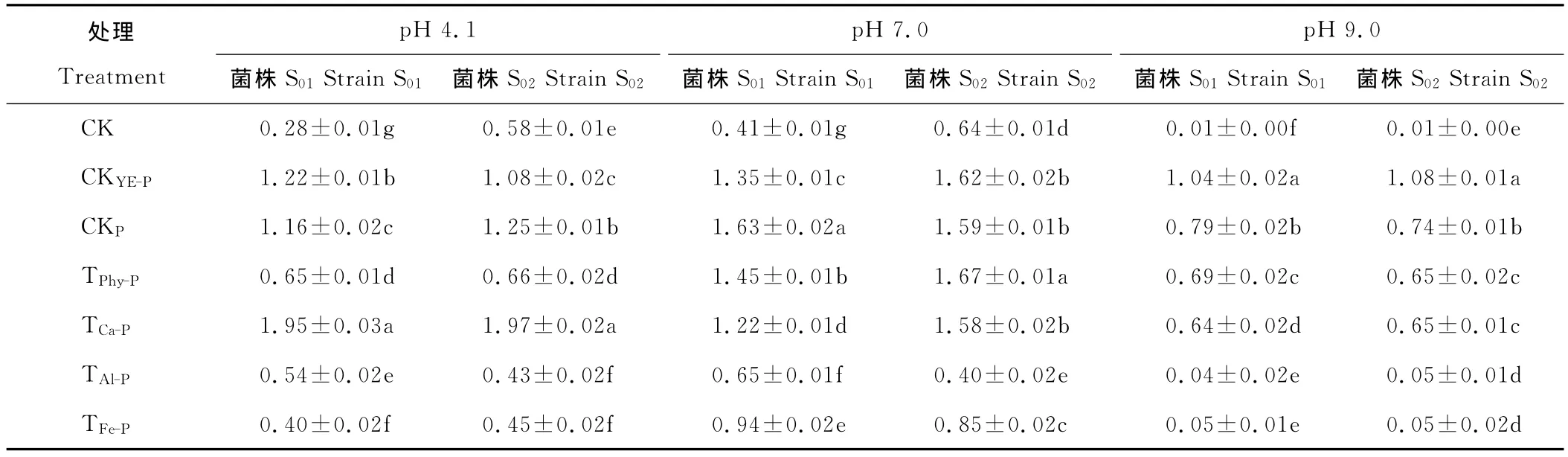
表2 根瘤菌在不同形态磷的培养液中培养72h后的吸光度Table 2 The rhizobia’s absorbance in medium with different form phosphorus after 72hculture
酸性处理组中,3个对照、TPhy-P、TAl-P和 TFe-P的pH 降低程度较大(都在pH 3.5以下),而 TCa-P却略有上升,原因在于磷酸钙在酸性条件下能部分溶解,中和了培养基中的H+,由此导致pH未下降。
中性处理组中,除 TPhy-P和 TCa-P外,其他对照和处理的pH 大幅度降低(最终pH<3.7),而 TPhy-P和 TCa-P的pH降低程度较小,原因同样是因为植酸钙镁和磷酸钙在酸性条件下可部分溶解,能中和培养液中的H+,即植酸钙镁和磷酸钙具有缓冲性,故2个处理pH下降幅度不大。
碱性处理组中,CK的pH 最高(分别为8.85和8.87),其次为 TAl-P(pH 分别为7.29和7.28),这与二者根瘤菌生长较弱(吸光度见表2),H+分泌少,所以培养液pH降低程度小。
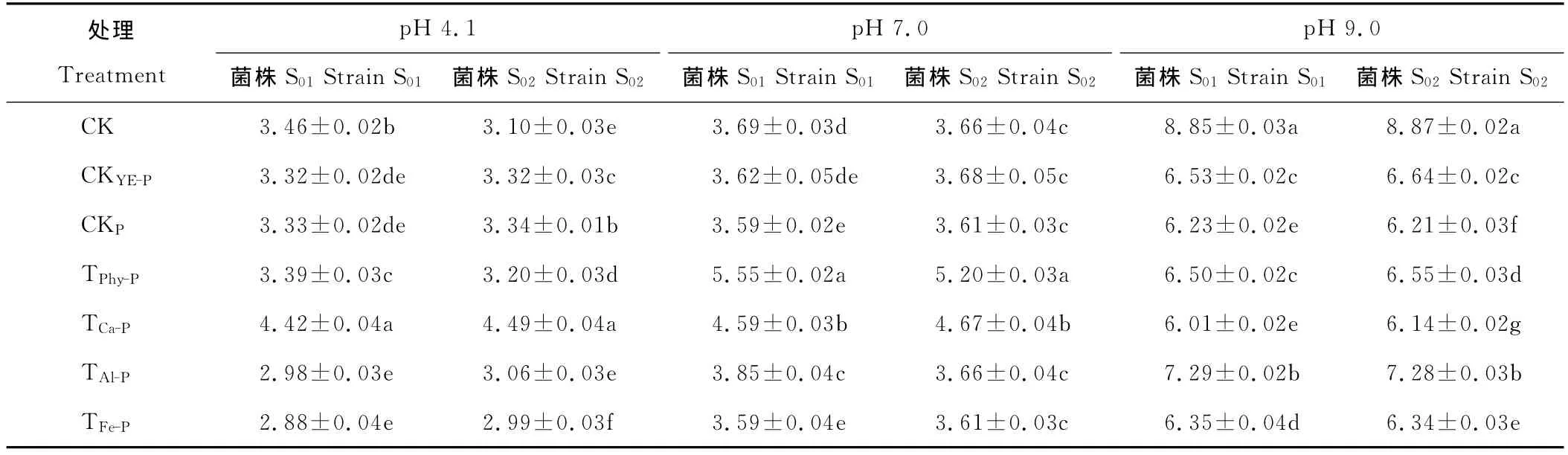
表3 根瘤菌在不同形态磷培养基中培养72h后的pHTable 3 The medium pH after 72hculturing in medium with different form phosphorus
2.2.3 不同pH培养条件下苜蓿根瘤菌对难溶性磷转化的影响 各处理培养72h后培养液中有效磷的含量见表4。比较不同处理的有效磷含量发现,酸性和中性条件下TPhy-P和TCa-P的有效磷含量(接种与未接种处理皆在100mg/L以上)远高于 TAl-P和 TFe-P(接种与未接种处理皆在21mg/L以下),碱性条件下仅 TPhy-P有效磷含量较高(未接种处理为54.53mg/L,接种处理为129.95和122.25mg/L),其余处理未接种对照仍较低,接种处理虽有上升但皆在50mg/L以下。说明对根瘤菌而言,磷酸钙在各pH条件下皆为有效的磷源,植酸钙镁在中性和酸性条件下是较有效的磷源,而磷酸铝和磷酸铁在任何pH条件下都很难成为根瘤菌的有效磷源。
与未接种对照相比,TAl-P和TFe-P接种根瘤菌后的有效磷在各pH条件下都有明显的上升,特别是在碱性条件下的上升幅度最大,如 TAl-P的有效磷含量从未接种的3.18mg/L上升到49.98和45.38mg/L,分别增加了14.70和13.27倍。对TPhy-P和TCa-P而言,接种根瘤菌仅使中性和碱性处理的有效磷含量上升,特别是碱性条件下 的上升幅度最大(如与未接种对照比,碱性条件下TPhy-P的有效磷含量从2.27mg/L分别增加到40.44和35.22mg/L),说明根瘤菌的生长可以促进难溶性磷的释放,但在酸性条件下对植酸钙镁和磷酸钙中磷的释放作用较弱。
比较不同pH条件下的有效磷含量发现,随pH的升高,TPhy-P和 TCa-P的有效磷含量呈明显的降低趋势,如酸性条件下未接种 TPhy-P和 TCa-P对照的有效磷分别为612.01和310.06mg/L,中性条件下分别降低到195.12和119.14mg/L,碱性条件下则降低到2.27和54.53mg/L,而 TAl-P和 TFe-P的有效磷含量在不同pH条件下变化不明显(表4的未接种对照)。说明环境pH对植酸钙镁和磷酸钙中磷的有效性有较大影响,而对磷酸铝和磷酸铁则影响较小。
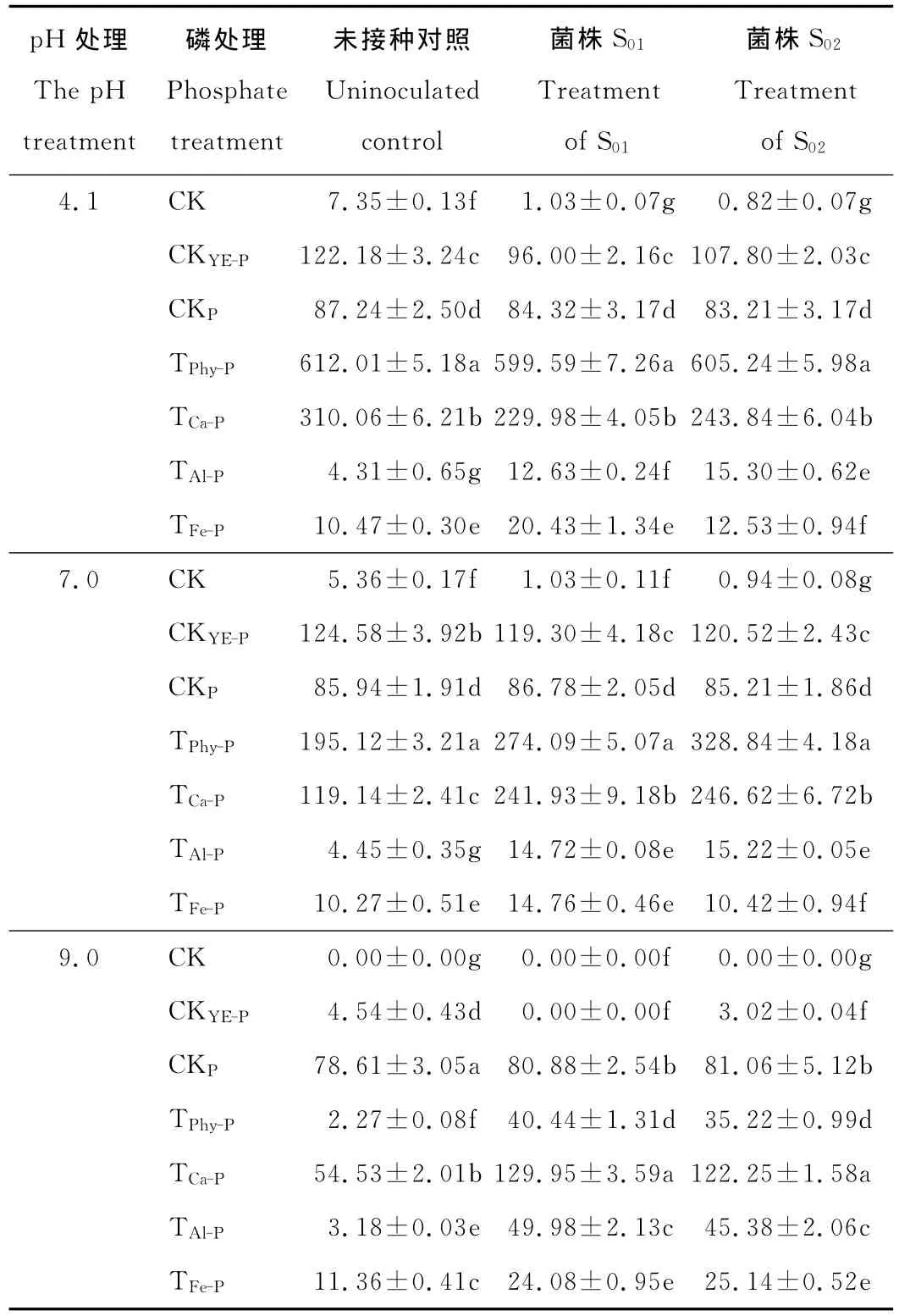
表4 根瘤菌培养后培养基有效磷含量Table 4 The available phosphate content at the end of culturing mg/L
3 讨论
3.1 pH与磷有效性的关系
土壤中的磷包括无机磷和有机磷。无机磷主要包括Ca-P、Al-P和 Fe-P,其中 Ca-P主要存在于中性和碱性土壤中,酸性土壤中含量很少;Al-P和Fe-P占酸性土壤中无机磷的绝大多数[12],在中性和碱性土壤中也有分布。土壤中的有机磷主要来源于植物残体,其中超过50%以上为植酸及其盐类[13]。各种磷在土壤中的溶解性与pH密切相关,酸性和中性条件下仅Ca-P和植酸盐类可部分溶解,碱性条件下各种磷皆难溶于水[5]。本研究测定的各处理有效磷含量也印证了这一点。酸性和中性条件下,TCa-P和TPhy-P中有效磷含量远高于碱性条件,而TFe-P和TAl-P在各pH条件下的有效磷含量皆较低(表4和表5)。因此在酸性土壤中,无机有效磷含量很低(Ca-P少,Al-P和Fe-P难溶),碱性土壤中同样容易缺乏有效磷(磷酸钙含量不到酸性条件的1/10,考虑到本研究的磷酸钙经过高温高压灭菌,碱性土壤中实际的有效磷含量应远低于试验值,此外植酸盐、Al-P和Fe-P溶解度都很低),因此对于酸性土壤和碱性土壤而言,苜蓿和苜蓿根瘤菌都容易缺磷,苜蓿在这类土壤上的栽培必须特别注意磷肥的施入。
3.2 根瘤菌生长与磷有效性的关系
本研究发现根瘤菌能提高各种难溶性磷的有效性,以供自身生长利用,如在初始pH 7.0和pH 9.0的接种处理中有效磷含量较未接种处理都有不同程度的升高,最高的超过未接种对照的10倍(pH 9.0条件下的TAl-P)。这种升高一方面是泌酸的细菌,它的生长会导致环境pH的降低(表3),而环境pH降低将增加Ca-P和有机磷的有效性,但pH降低对磷酸铝和磷酸铁中磷的释放作用并不明显(表4),这与前人的研究结果一致[2,14-15],即磷酸钙和有机磷的有效性对pH较为敏感,而磷酸铝和磷酸铁则不敏感。
根瘤菌泌酸(H+)导致有效磷的上升并不能完全解释一些处理中的有效磷在接种根瘤菌后大幅度增加的现象。如pH 9.0条件下的接种根瘤菌处理TAl-P,其培养后培养液有效磷含量达49.48mg/L(表4),而其培养后培养液pH 为7.29,与pH 7.0条件下的未接种处理TAl-P的pH(6.81)相差不大,若接种处理中仅存在酸(H+)的溶磷作用,那么二者的有效磷含量应差异不大,但实际上前者含量却是后者的10倍以上。这说明根瘤菌培养中存在另外一些导致有效磷含量增加的机理,如这种机理可能是有机酸的分泌[4,8-9],磷饥饿条件下与溶磷相关的酶分泌和相关基因的表达,进而促进磷的溶解和吸收[13-14],而中性和酸性条件培养时因根瘤菌的泌酸作用导致培养液pH下降过低(各处理最终pH皆<4.0),由此导致溶磷相关基因的表达受阻,故接种根瘤菌后有效磷含量未见明显上升,但这还需进一步试验的验证。
3.3 有机质与根瘤菌在土壤中的生存和生长
有机磷(如YMA培养基中的酵母膏)是根瘤菌生长的最有效的磷源之一,土壤中含量最多的有机磷是植酸盐类。本研究发现虽然植酸盐与磷酸钙、磷酸铝和磷酸铁等无机磷一样在水中的溶解度很低,但在中性条件下,它可以作为根瘤菌的有效磷源,其培养后的根瘤菌吸光度与正常培养基中基本一样,其原因可能在于一方面根瘤菌生长中泌酸降低了环境pH,增加了植酸钙镁的溶解度,另一方面,苜蓿根瘤菌可能与其他根瘤菌一样在低磷条件下能分泌植酸酶[5,16],将植酸钙镁分解以供自身生长所需。实验发现初始pH 4.1的酸性条件下,植酸钙镁则因转变为植酸,而植酸是防腐剂,能抑制多种细菌的生长[17-20],故虽然有效磷含量很高,根瘤菌生长却很差。不过,田间生产的条件不同于本试验的室内培养条件,土壤中含有多种能分解植酸的微生物,植酸被这些微生物分解后抑菌作用消失,同时释放出磷[21],因此酸性条件下土壤中的植酸磷也应该是根瘤菌生长的良好磷源。
虽然在本研究中,碱性条件下含有机磷处理(酵母膏CKYE和植酸钙镁TPhy-P)的有效磷很低,根瘤菌生长较差,但这是在单一接种根瘤菌条件下获得的。实际生产中,若向盐碱土壤中添加有机质后,会促进多种微生物,如纤维菌、放线菌、各种真菌和多种其他细菌的生长,在它们的共同作用下,土壤会累积有机酸,pH降低,有效磷含量增加[22-24],因此在富含有机质的土壤中根瘤菌的存活和生长所需磷源应该是足够的。
综上所述,不管在哪种土壤中,要促进低磷土壤中根瘤菌的生长,提高存活率和结瘤,一个间接有效的方法是采取措施提高土壤的有机质含量。
[1]Zhang Y J,Shen Y X.The Development Potential and Direction of Alfalfa in Southern Farming Areas[C].Beijing:The Third China National Alfalfa Industry Development Conference,2010.
[2]Lu R K.General status of nutrients(N,P,K)in soils of China.Acta Pedologica Sinica,1989,26(3):280-286.
[3]Neila A,Adnane B,Mustapha F,etal.Phaseolusvulgaris-Rhizobia symbiosis increases the phosphorus uptake and symbiotic N-2fixation under insoluble phosphorus.Journal of Plant Nutrition,2014,37(5):643-657.
[4]Tajini F,Trabelsi M,Drevon J J,etal.Combined inoculation withGlomusintraradicesandRhizobiumtropiciCIAT899increases phosphorus use efficiency for symbiotic nitrogen fixation in common bean(PhaseolusvulgarisL.).Saudi Journal of Biological Sciences,2012,19(2):157-163.
[5]Mandri B,Drevon J J,Bargaz A,etal.Interactions between common bean genotypes and rhizobia strains isolated from Moroccan soils for growth,phosphatase and phytase activities under phosphorus deficiency conditions.Journal of Plant Nutrition,2012,35(10):1477-1490.
[6]Jia Y,Gray V M,Straker C J.The influence ofRhizobiumand arbuscular mycorrhizal fungi on nitrogen and phosphorus accumulation byViciafaba.Annals of Botany,2004,94(2):251-258.
[7]Lzaguirre-Mayoral M L,Carballo O,Egea R,etal.Responses ofRhizobium-inoculated and nitrogen-supplied cowpea plants to increasing phosphorus concentrations in solution culture.Journal of Plant Nutrition,2002,25(11):2373-2387.
[8]Atemkeng M F,Remans R,Michiels J,etal.Inoculation withRhizobiumetlienhances organic acid exudation in common bean(PhaseolusvulgarisL.)subjected to phosphorus deficiency.African Journal of Agricultural Research,2011,6(10):2235-2242.
[9]Zhang X T,Kang L H,Ma H B,etal.Selection of AcaciaRhizobiumwhich have the ability to dissolve phosphorus.Forest Research,2008,21(5):619-624.
[10]Carmen B,Roberto D.Improvement of phosphate solubilization andMedicagoplant yield by an indole-3-acetic acid-overproducing strain ofSinorhizobiummelitoti.Applied and Environmental Microbiology,2010,76(14):4626-4632.
[11]Li J F,Zhang S Q,Shi S L,etal.Screening of dissolve phosphorusRhizobiummelilotiantibiotic-resistant strain using microwave mutagenesis.Atomic Energy Science and Technology,2009,43(12):1071-1076.
[12]Jang B P,Lu R K,Yan Y C,etal.The content of iron phosphates in the paddy soils of southern China and their significance to the phosphorus nutrition of rice plant.Acta Pedologica Sinica,1963,11(4):361-368.
[13]Yan Y P,Wan B,Liu F,etal.Distribution,species and interfacial reactions of phytic acid in environment.Chinese Journal of Applied and Environmental Biology,2012,18(3):494-501.
[14]Liu L S,Yu Y X,Hu Y,etal.Effect of acid environment and aluminium on the growth ofRhizobiummeliloti.Journal of Anhui Agricultural Science,2012,40(36):17615-17618.
[15]Liu W G,He Y Q,Zhang K,etal.Isolation,identification and characterization of a strain of phosphate-solubilizing bacteria from red soil.Acta Microbiologica Sinica,2012,52(3):326-333.
[16]Lazali M,Zaman-Allah M,Amenc L,etal.A phytase gene is overexpressed in root nodules cortex ofPhaseolusvulgarisrhizobia symbiosis under phosphorus deficiency.Planta,2013,238(2):317-324.
[17]Xie Y Q,Fang B S.Study on the antimicrobial preservation effect of phytic acid.Fujian Chemical Industry,2002,(4):39-41.
[18]Hou W F,Xie J,Lan W Q,etal.Antimicrobial mechanisms of phytic acid againstEscherichiacoli.Jiangsu Journal of Agricultural Science,2012,28(2):443-447.
[19]Xie J,Hou W F,Tang Y,etal.Antimicrobial mechanisms of phytic acid againstShewanellaputrefacens.Science and Technology of Food Industry,2011,32(10):85-88.
[20]Bari M L,Ukuku D O,Kawasaki T,etal.Combined efficacy of nisin and pediocin with sodium lactate,citric acid,phytic acid,and potassium sorbate and EDTA in reducing theListeriamonocytogenespopulation of inoculated fresh-cut produce.Journal of Food Protection,2005,68(7):1381-1387.
[21]Tong L N,Li S M,Meng L B.Effect of inoculating arbuscular mycorrhizal fungi and rhizobium on soybean by utilizating organic phosphorus source.Journal of Northeast Agricultural University,2009,40(10):37-42.
[22]Wu Y P,Li Y F,Zheng C Y.Organic amendment application influence soil organism abundance in saline alkali soil.European Journal of Soil Biology,2013,54:32-40.
[23]Xu N N,Xie Y H,Feng X.Effect of adding fermented straw powder on the fertility condition of saline alkali soil.Journal of Tianjin University of Technology,2013,29(4):57-59.
[24]Rong L Y,Yao T,Ma W B,etal.The inoculant potential of plant growth promoting rhizobacteria strains to improve the yield and quality ofTrifoliumpretensecv.Minshan.Acta Prataculturae Sinica,2014,23(5):231-240.
参考文献:
[1]张艳娟,沈益新.南方农区的紫花苜蓿发展潜力与方向[C].北京:第三届中国苜蓿发展大会,2010.
[2]鲁如坤.我国土壤氮、磷、钾的基本状况.土壤学报,1989,26(3):280-286.
[11]李剑峰,张淑卿,师尚礼,等.微薄诱变选育耐药高效溶磷苜蓿根瘤菌.原子能科学技术,2009,43(12):1071-1076.
[12]蒋柏藩,鲁如坤,颜益初,等.南方水稻土中磷酸铁对水稻磷素营养的意义.土壤学报,1963,11(4):361-368.
[13]严玉鹏,万彪,刘凡,等.环境中植酸的分布、形态及界面反应行为.应用与环境生物学报,2012,18(3):494-501.
[14]刘卢生,玉永雄,胡艳,等.酸铝对耐酸苜蓿根瘤菌生长的影响.安徽农业科学,2012,40(36):17615-17618.
[15]刘文干,何园球,张坤,等.一株红壤溶磷菌的分离、鉴定及溶磷特性.微生物学报,2012,52(3):326-333.
[17]谢益强,方柏山.植酸抑菌保鲜作用的研究.福建化工,2002,(4):39-41.
[18]侯伟锋,谢晶,蓝蔚青,等.植酸对大肠杆菌抑菌机理的研究.江苏农业学报,2012,28(2):443-447.
[19]谢晶,侯伟锋,汤毅,等.植酸对腐败希瓦菌的抑菌机理.食品工业科技,2011,32(10):85-88.
[21]佟丽娜,李淑敏,孟令波.双接种对大豆利用不同有机磷源的影响.东北农业大学学报,2009,40(10):37-42.
[23]徐娜娜,解玉红,冯忻.添加发酵秸秆粉对盐碱土壤肥力的影响.天津理工大学学报,2013,29(4):57-59.
[24]荣良燕,姚拓,马文彬,等.岷山红三叶根际优良促生菌对其宿主生长和品质的影响.草业学报,2014,23(5):231-240.

