绵羊肺炎支原体P109蛋白质分子特征、原核表达及其免疫反应性
谢珊珊, 黄 金, 杨发龙
(西南民族大学生命科学与技术学院/动物医学四川省高等学校重点实验室,四川 成都 610041)
绵羊肺炎支原体(Mycoplasma ovipneumoniae)可感染绵羊、山羊以及其他野生小反刍动物,是引起非典型肺炎的病原,其在全球范围内流行,危害严重[1-4]。系统进化分析结果表明绵羊肺炎支原体和引起猪地方流行性肺炎的病原——猪肺炎支原体(Mycoplasma hyopneumoniae)的亲缘关系最近[5-6]。在猪肺炎支原体中,黏附素P97及其旁系同源蛋白质是重要的毒力因子,在介导支原体对宿主细胞的黏附过程中发挥着重要作用,而且也是重要的免疫原,可诱导机体产生抗体[7-8],从而在研制亚单位疫苗及建立血清学诊断技术时具有重要的意义。对绵羊肺炎支原体SC01株的全基因组进行分析时发现,在绵羊肺炎支原体基因组中存在一组与P97及其旁系同源基因高度同源的基因家族[9]。其中,绵羊肺炎支原体p109基因与猪肺炎支原体mhp843高度相似,而后者的编码产物已被证明是重要的黏附素和免疫原[7,10]。因此,有理由推测绵羊肺炎支原体P109也极有可能是重要的功能蛋白质之一。
本研究对p109基因的分子特征进行了分析,并对其进行了原核表达和免疫反应性分析,为进一步研究其结构与功能,以及为其在亚单位疫苗及血清学诊断中作为抗原的可能性提供依据。
1 材料与方法
1.1 菌株、载体及血清
绵羊肺炎支原体SC01株由西南民族大学动物医学四川省高校重点实验室分离鉴定和保存,E.coli DH5α、Rosetta(DE3)感受态细胞均购自大连宝生物工程有限公司,pET-32(a+)载体为Novagen公司产品,山羊抗绵羊肺炎支原体SC01株阳性血清由西南民族大学动物医学四川省高校重点实验室制备,HRP标记兔抗山羊IgG为Bio-Rad公司产品。
1.2 主要试剂
限制性内切酶Bam H I、Xho I为NEB公司产品,Taq DNA聚合酶、T4 DNA连接酶为TaKaRa公司产品,AxyPrepTMDNA Gel Extraction Kit、AxyPrepTMPlasmid Miniprep Kit均为Axygen公司产品,Immun-Star WesternC Chemiluminescence Kit为 Bio-Rad公司产品,HistrapTMHP重组蛋白质纯化柱为 GE Healthcare公司产品。
1.3 p109基因序列分析
采用NCBI的BLAST工具及DNAstar软件包中MegAlign、EditSeq和Protean工具对核苷酸及氨基酸序列分子量大小及与其他基因的相似性进行比较分析;蛋白质信号肽、跨膜区以及脂蛋白质预测分别利用在线工具SigalP4.0(http://www.cbs.dtu.dk/services/SignalP/)、TMHMM(www.cbs.dtu.dk/services/TMHMM/)以及 LipoP 1.0(http://www.cbs.dtu.dk/services/LipoP/)进行;抗原表位分析采用在线分析站点(http://imed.med.ucm.es/Tools/antigenic.pl)进行。
1.4 引物设计
由于在p109基因中近3'端含有2个TGA(在支原体中编码色氨酸)密码子,故依据抗原表位分析结果和引物设计原则,在其5'端设计1对引物。引物序列如下:P109F:5'-CGCGGATCCCAGATTGGTTATTCCTAGGAGC-3'(下划线部分为Bam H I酶切位点),P109R:5'-CCGCTCGAGATTACCATCAAGATTTAGCC(下划线部分为Xho I酶切位点),该引物扩增片段大小852 bp(其编码P109蛋白质第119至第402位氨基酸),引物由上海生工生物工程有限公司合成。
1.5 目的片段的PCR扩增
采用常规酚/氯仿法提取绵羊肺炎支原体SC01株基因组DNA作为模板,利用上述引物对P109F/P109R进行PCR扩增。PCR反应总体系为25.000 μl,包含 dNTP(各 2.5 mmol/L)2.000 μl、MgCl2(25 mmol/L)2.000 μl、上 下 游 引 物 (10 μmol/L) 各1.000 μl、Taq DNA 聚合酶(5 U/μl)0.125 μl、10 ×PCR buffer 2.500 μl、DNA 模板 2.000 μl以及去离子水14.375 μl。反应条件为:95℃预变性5 min;94 ℃ 30 s,51 ℃ 45 s,72 ℃ 1 min,35个循环;72 ℃延伸10 min,16℃结束反应。PCR产物经10 g/L琼脂糖凝胶电泳进行检测。
1.6 原核表达载体的构建
采用DNA Gel Extraction Kit对PCR产物进行纯化回收。用Bam H I和Xoh I分别对纯化的PCR产物和pET-32(a+)进行双酶切,并经纯化回收后,采用T4连接酶进行连接反应。连接产物转化到E.coli DH5α感受态细胞,随后涂布至含有100 μg/ml氨苄青霉素的LB琼脂平板培养基上,37℃培养24 h。挑取阳性菌落,接种至含有100 μg/ml氨苄青霉素的LB肉汤中培养过夜,采用AxyPrepTMPlasmid Miniprep Kit提取质粒。通过PCR扩增对质粒进行鉴定,并交由上海生工生物工程有限公司进行测序确认。重组表达载体命名为pET-32(a+)-P109,由其编码表达的重组蛋白质命名为rP109。
1.7 重组蛋白质的诱导表达、可溶性分析和纯化
将上述鉴定正确的重组阳性质粒pET-32(a+)-P109和空载体pET-32(a+)分别转化E.coli Rosetta(DE3)感受态细胞,挑取单个菌落接种到含有 100 μg/ml氨苄青霉素和 34 μg/ml氯霉素的 LB肉汤中,37℃、160 r/min振荡培养过夜。取500 μl培养菌液接种到50 ml含有100 μg/ml氨苄青霉素和34 μg/ml氯霉素的LB肉汤中,37℃振荡培养至OD600为0.6后,加入0.5 mmol/L的IPTG进行诱导表达,收集诱导前及诱导后不同时间点的菌液2 ml,离心收集菌体,PBS重悬后采用SDS-PAGE电泳检测重组蛋白质的表达情况。
选择上述得到的最佳表达条件对目的蛋白质进行大量表达,12 000 r/min离心10 min,弃去上清液,沉淀采用10 ml裂解液进行重悬,并采用超声破碎仪在冰浴中进行超声裂解。在4℃条件下,以12 000 r/min离心20 min,收集上清液,对沉淀采用5 ml PBS液(0.01 mol/L,pH 7.4)进行重悬。用SDS-PAGE电泳对沉淀和上清液中的重组蛋白质进行检测,以鉴定其可溶性。随后,利用GE Healthcare公司生产的HistrapTMHP重组蛋白质纯化柱,按照说明书对重组蛋白质rP109进行纯化。
1.8 Western-blot分析
用纯化的rP109蛋白质制样,进行SDS-PAGE电泳,用半干转印仪转移至硝酸纤维素膜上。50 g/L脱脂奶粉封闭过夜,TBST洗涤3次(每次10 min)后以1∶600倍稀释的山羊抗绵羊肺炎支原体SC01株阳性血清为一抗孵育2 h;同法洗涤后孵育二抗2 h,二抗为1∶6 000稀释的HRP标记的兔抗山羊IgG;最后洗涤后加Immun-Star WesternC Chemiluminescence Kit发光剂,于VersaDoc成像系统中成像,读取结果。以绵羊肺炎支原体抗体阴性的山羊血清作为对照。
2 结果
2.1 p109基因的生物信息学分析
p109基因CDS全长为2 904 bp,G+C含量为28.44%,编码的蛋白质分子量为108 900,等电点为4.91。该基因包含2个用于编码色氨酸的TGA密码子,分别位于第1 996 bp和2 692 bp处。经BLAST比较分析,p109基因与猪肺炎支原体黏附相关基因mhp843相似性最高,两者间核苷酸序列相似性为47.00%,编码氨基酸序列相似性为45.30%,表明p109为mhp843的直系同源基因。
跨膜结构域及信号肽分析结果显示,P109蛋白质在其N端有1个明显的跨膜区螺旋,位于9~31 aa。抗原表位分析结果显示P109蛋白质包含丰富的抗原表位,通过预测发现其包含33个可能的抗原表位,该蛋白质的平均抗原趋势为1.008 1(图1)。
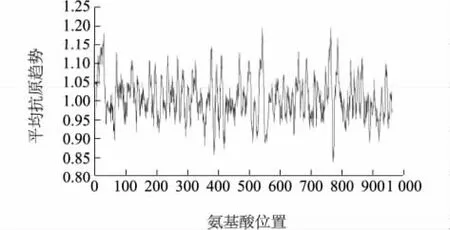
图1 P109抗原表位预测Fig.1 Prediction of antigenic epitope of protein P109
2.2 p109基因片段的PCR扩增
以绵羊肺炎支原体SC01株基因组DNA为模板,用P109F/P109R引物进行PCR扩增,电泳得到与预期大小相符的条带(图2)。
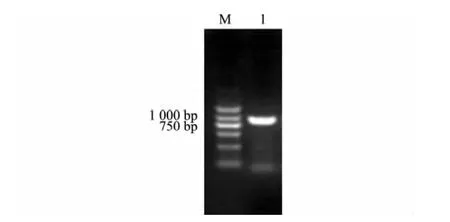
图2 p109基因片段的PCR扩增结果Fig.2 PCR amplification of p109 fragment
2.3 原核表达载体的构建及鉴定
PCR产物连接至pET-32(a+)载体,转化E.coli DH5α细胞,筛选得到阳性克隆,以提取的重组质粒为模板,采用P109F/P109R进行PCR扩增,所得条带大小与预期相符。对PCR鉴定为阳性质粒进行测序,结果显示目的片段的序列与绵羊肺炎支原体SC01株 p109基因相应区域完全相同,在pET-32(a+)载体中的插入位置正确。
2.4 重组蛋白质的表达、可溶性分析和纯化
重组质粒pET-32(a+)-P109转化E.coli Rosetta(DE3)感受态细胞后进行IPTG诱异表达,在不同时间点收集菌体进行SDS-PAGE电泳检测,结果(图3)显示,重组工程菌经IPTG诱导后,在50 000处出现明显的表达条带,其大小与预期(50 900)相符,表明目的片段以融合蛋白质的形式得到了有效表达。

图3 重组P109蛋白质的诱导表达Fig.3 Prokaryotic expression of recombinant P109 protein
为分析重组蛋白质的可溶性,用全菌裂解物上清液和沉淀制样后进行SDS-PAGE分析,结果显示,表达的重组蛋白质主要存在于沉淀中,说明该蛋白质以包涵体形式进行表达。利用HistrapTMHP纯化柱对重组P109蛋白质进行纯化,经SDS-PAGE电泳,仅在51 000处出现单一条带(图4),说明纯化效果良好。

图4 表达产物的可溶性分析及纯化Fig.4 Solubility analysis and purification of recombinant P109 protein
2.5 重组蛋白质Western-blot分析
将纯化的重组蛋白质进行SDS-PAGE电泳,转至硝酸纤维素后以山羊抗绵羊肺炎支原体高免血清作为一抗,以辣根过氧化物酶标记的兔抗山羊IgG为二抗进行Western-blot分析,结果(图5)显示,重组蛋白质在51 000处出现一条特异条带,表明重组蛋白质与山羊抗绵羊肺炎支原体全菌抗体发生特异性结合,重组P109蛋白质具有良好的免疫反应性。

图5 重组蛋白质的Western-blot分析Fig.5 Western-blot analysis of recombinant P109 protein
3 讨论
与大多数病原性细菌不同,致病性支原体一般不产生毒素及侵袭素等典型的毒力因子,主要是通过位于膜表面的黏附素附着于细胞表面,并通过有毒中间代谢产物对宿主细胞造成损伤。同时,支原体作为一种没有细胞壁的特殊原核微生物,其膜表面蛋白质也是诱导机体产生免疫应答的主要免疫原。因此,深入研究支原体中与黏附相关蛋白质的结构与功能对于阐明其致病机理、开发血清学诊断技术和研发亚单位疫苗均具有十分重要的意义。
绵羊肺炎支原体是引起山羊及绵羊非典型肺炎的病原,随着养羊业从散养向集约化舍养方式的转变,其危害也不断严重。然而,目前对该病原的重要功能蛋白质知之甚少。此前,我们对绵羊肺炎支原体可能的黏附素分子P113的分子特征和免疫反应性进行了研究[11-12],表明其与猪肺炎支原体的黏附素P97高度同源,并且是良好的免疫原。研究结果表明,猪肺炎支原体存在多个p97基因的旁系同源基因,且多数同样参与黏附过程,也是良好的免疫原。其中,由mhp384编码的蛋白质(Mhp384)同样可以结合到猪气管上皮细胞纤毛,参与黏附过程[10]。猪肺炎支原体在感染宿主细胞的过程中,Mhp384可以在体内获得表达,并且诱导机体产生抗体[7]。本研究对绵羊肺炎支原体p109基因的生物信息学分析结果表明,其与mhp384为直系同源基因,在其N端具有一跨膜区,并含有丰富的抗原表位。为研究该蛋白质的功能,本研究对编码绵羊肺炎支原体P109的部分基因片段进行了克隆,并在大肠杆菌中成功进行高效表达。利用山羊抗绵羊肺炎支原体全菌抗体进行免疫印迹分析,结果表明纯化得到的重组蛋白质能与山羊抗绵羊肺炎支原体全菌抗体特异性结合,说明P109是绵羊肺炎支原体的免疫原之一。这同时也说明本研究所表达的重组蛋白质可以作为抗原,在ELISA等绵羊肺炎支原体血清抗体检测试剂盒的研制和亚单位疫苗的开发等方面具有潜在的应用价值。
[1] HANDELAND K,TENGS T,KOKOTOVIC B,et al.Mycoplasma ovipneumoniae-a primary cause of severe pneumonia epizootics in the Norwegian Muskox(Ovibos moschatus)population [J].Plos One,2014,9(9):e106116.
[2] RONG G,ZHAO J M,HOU G Y,et al.Seroprevalence and molecular detection of Mycoplasma ovipneumoniae in goats in tropical China[J].Trop Anim Health Prod,2014,46(8):1491-1495.
[3] RIFATBEGOVIC M,MAKSIMOVIC Z,HULAJ B.Mycoplasma ovipneumoniae associated with severe respiratory disease in goats[J].Vet Rec,2011,168(21):565.
[4] BESSER T E,CASSIRER E F,POTTER K A,et al.Association of Mycoplasma ovipneumoniae infection with population limiting respiratory disease in free-ranging rocky mountain bighorn sheep(Ovis canadensis) [J].Clin Microbiol,2008,46(2):423-430.
[5] PETTERSSON B,UHLÉN M,JOHANSSON K E.Phylogeny of some mycoplasmas from ruminants based on 16S rRNA sequences and definition of a new cluster within the hominis group[J].Int J Syst Bacteriol,1996,46(4):1093-1098.
[6] LI M,Ma C J,LIU X M,et al.Molecular cloning of HSP70 in Mycoplasma ovipneumoniae and comparison with that of other mycoplasmas[J].Genet Mol Res,2011,10(2):834-848.
[7] ADAMS C,PITZER J,MINION F C.In vivo expression analysis of the P97 and P102 paralog families of Mycoplasma hyopneumoniae[J].Infection and Immunity,2005,73(11):7784-7787.
[8] HSU T,ARTIUSHIN S,MINION F C.Cloning and functional analysis of the P97 swine cilium adhesin gene of Mycoplasma hyopneumoniae[J].J Bacteriol,1997,179(4):1317-1323.
[9] YANG F L,TANG C,WANG Y,et al.Genome sequence of Mycoplasma ovipneumoniae strain SC01[J].Journal of Bacteriology,2011,193(18):5018.
[10] DEUTSCHER A T,TACCHI J L,MINION F C,et al.Mycoplasma hyopneumoniae surface proteins Mhp385 and Mhp384 bind host cilia and glycosaminoglycans and are endoproteolytically processed by proteases that recognize different cleavage motifs[J].J Proteome Res,2012,11(3):1924-1936.
[11]张贤宇,杨发龙,冯旭飞,等.绵羊肺炎支原体P113蛋白N端原核表达及其抗原性分析[J].中国兽医杂志,2013,49(7):7-10.
[12]杨发龙,张贤宇,汤 承,等.绵羊肺炎支原体P113蛋白C端重复区的表达及其免疫原性研究[J].中国兽医科学,2013,43(7):733-737.

