液相色谱-串联质谱法同时测定葡萄酒中6种吡唑类杀菌剂
陈祥准,夏碧琪,黄芙珍,程 洁,沈 燕,韩 超*
(1.温州出入境检验检疫局,浙江 温州 325027;2.温州大学 化学与材料工程学院,浙江 温州 325035)
杀菌剂是用于防治由各种病原微生物引起的植物病害的一类低毒农药。吡唑类化合物具有高效、低毒以及吡唑环上取代基可多方位变换等优势和多种生物活性,是新型杀菌剂开发的热点之一[1]。近年来,多种吡唑类杀菌剂被越来越广泛地应用于农业生产中的植物病害控制,如谷物、蔬菜和水果等。许多国家和组织对其在植物源性食品中的限量已出台了相关规定,如欧盟规定葡萄酒中氟唑菌酰胺、吡唑萘菌胺、联苯吡菌胺的最高残留量(MRLs)为0.01 mg·kg-1[2]。因此,建立准确、可靠的测定葡萄酒中吡唑类杀菌剂残留量的方法非常重要。
目前,关于食品和环境中杀菌剂检测的研究[3-16]已有报道,但对葡萄酒中吡唑类杀菌剂的检测方法研究较少,且未见同时测定葡萄酒中戊苯吡菌胺、氟唑菌酰胺、吡唑萘菌胺、吡咪唑、联苯吡菌胺、呋吡菌胺残留量的报道。本文结合固相萃取和液相色谱-串联质谱法进行分析,建立了同时测定葡萄酒中上述6种吡唑类杀菌剂的分析方法,该方法具有前处理简单、灵敏度高、结果准确等优点,可用于实际样品的测定。
1 实验部分
1.1 仪器与试剂
Agilent1200高效液相色谱仪(美国Agilent公司)、API 4000三重四极杆质谱仪(美国AB应用生物系统公司);Milli-Q超纯水器(美国Millipore公司);Elma P300 H超声波清洗器(德国Elma公司),甲醇、乙腈(色谱纯,德国Merck公司);甲酸(纯度≥99%)、乙酸(纯度100%)、甲酸铵(纯度≥99%)、乙酸铵(纯度≥97%)(美国Alfa Aesar公司);MCX SPE强阳离子交换固相萃取柱(Waters公司,60 mg/3 mL);MAX SPE强阴离子交换固相萃取柱(Waters公司,60 mg/3 mL);HLB SPE强阳离子交换固相萃取柱(Waters公司,60 mg/3 mL);ENVI C18交换柱固相萃取柱(Superclean,60 mg/3 mL);其它试剂均为分析纯。实验用葡萄酒为附近超市或企业送检样品。呋吡菌胺(纯度≥99.9%)、吡咪唑(纯度≥99.0%)、氟唑菌酰胺(纯度≥99.7%)、联苯吡菌胺(纯度≥98.5%)均购自Dr.Ehrenstorfer GmbH,戊苯吡菌胺(纯度≥98.4%)、吡唑萘菌胺(纯度≥99.7%)购自Sigma-Aldrich公司;上述6种吡唑类杀菌剂标准品用甲醇配制成质量浓度为500 mg·L-1的储备液;使用时,以甲醇稀释上述标准储备液,配制成1 000 μg·L-1的混合标准工作溶液。基质校准工作溶液制备:分别称取5.0 g空白葡萄酒样品5份,按照“1.3”方法进行样品处理,氮吹至约0.5 mL,依次加入5,10,25,50,250 μL的混合标准工作溶液,再用甲醇定容至5 mL,即得浓度分别为1.0,2.0,5.0,10.0,50.0 μg·L-1的基质校准工作溶液。
1.2 色谱-质谱条件
1.2.1 液相色谱条件 Agilent ZOBRAX C18(2.1 mm×150 mm,5 μm);流动相:A为0.1%乙酸的水溶液,B为乙腈。梯度洗脱程序:0~4 min,50%~90%B,保持11 min;流速:250 μL·min-1;进样量为10 μL,柱温30℃。
1.2.2 质谱条件 电喷雾离子源:负离子扫描;离子源温度500℃;电喷雾电压5 000 V;雾化气(GS1)压力344.5 kPa;辅助气流速(GS2)275.6 kPa;气帘气压力68.9 kPa;碰撞气(CAD)压力137.8 kPa。监测模式:多反应监测(MRM)。
1.3 样品处理与净化
1.3.1 提 取 称取葡萄酒样品5.0 g,加入3 mL超纯水混匀得到待检液。
1.3.2 净 化 HLB SPE柱依次用甲醇和水活化,取全部待检液至SPE柱,待样品溶液全部流出后,再依次用6 mL水和6 mL甲醇-水混合溶液(2∶3)淋洗,真空抽干,用6 mL甲醇洗脱,洗脱液40℃氮气吹干,用2 mL甲醇溶解残渣,过0.22 μm滤膜后,供LC-MS/MS测定。
2 结果与讨论
2.1 净化条件的优化
葡萄酒的成分复杂,含有多种花色素和酚类等干扰物质[17-18],本研究将样品直接加水稀释,考虑到葡萄酒样品中的大量基质杂质可能会影响待测物的定性和定量分析结果,故需要对提取液进行净化处理。实验采用SPE固相萃取柱净化提取液。
2.1.1 SPE柱的选择 分别对葡萄酒加标浓度为1.0 μg·kg-1的6种吡唑类杀菌剂进行回收率实验,考察了不同SPE柱(Waters Oasis HLB、Waters Oasis MCX、Waters Oasis MAX和Superclean ENVI C18)的净化回收率。重复测定3次,计算方法的平均回收率。结果表明,MCX、MAX和C18柱的回收率为65.6%~81.5%,而HLB柱的净化效果相对较好,回收率为72.8%~92.6%,可满足检测要求。因此实验采用Waters Oasis HLB柱进行净化处理。
2.1.2 淋洗液的选择 考察了甲醇-水淋洗液配比(20%,30%,40%,50%)对萃取回收率的影响,结果发现40%甲醇水溶液净化的回收率(82.4%~93.5%)与20%(回收率为81.4%~92.1%)以及30%(回收率为82.0%~92.4%)甲醇水溶液净化的回收率相差不大,且不会将6种吡唑类杀菌剂洗脱下来。而50%甲醇水溶液会将部分吡唑类杀菌剂淋洗下来(回收率为38.5%~57.1%),对回收率有较大影响。考虑到甲醇含量高时,可以淋洗掉更多的杂质,减少对仪器的污染,因此实验采用40%甲醇水溶液为淋洗液。随后采用6 mL纯甲醇作为洗脱液洗脱待测化合物。
2.2 质谱条件的优化
将200 ng·mL-1的6种吡唑类杀菌剂标准溶液在ESI源正离子和负离子模式下进行全扫描,以选择适当的定性、定量离子和电离方式。结果表明:在ESI源的负离子模式下,6种杀菌剂均呈现出最佳响应,准分子离子[M-H]-是响应强度最高的离子。确定母离子后,在MRM模式下通过优化碰撞能量、透镜电压等质谱参数,使各分析化合物的响应最大化。质谱参数及母离子和子离子详见表1。
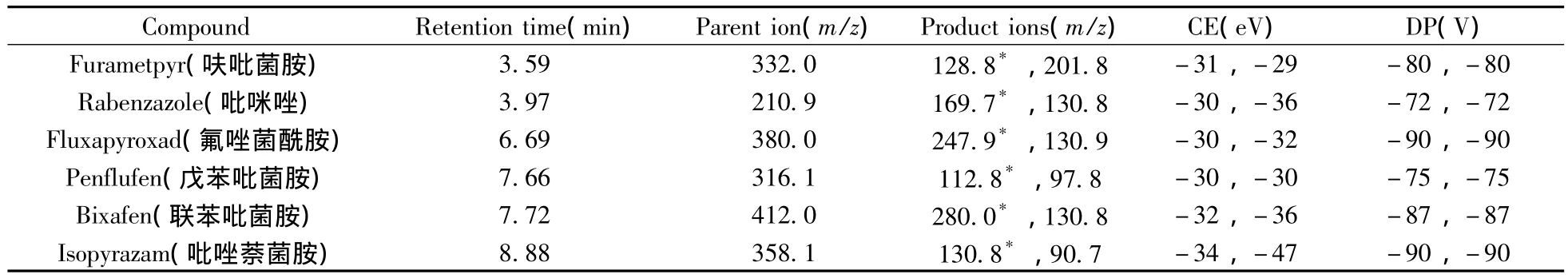
表1 化合物的多反应监测质谱参数Table 1 Optimized MRM parameters for the determination of compounds
2.3 色谱条件的优化
考察了不同色谱柱(ZORBAX Eclipse Plus C18,Waters X BridgeTMC18,Waters XselectTMHSS T3)对6种吡唑类杀菌剂分离效果和灵敏度的影响。结果表明,使用 Agilent ZOBRAX C18(2.1 mm×150 mm,5 μm)色谱柱时分离效果最佳。分别考察了以甲醇-水和乙腈-水为流动相,以及在流动相中分别添加0.05%和0.1%的甲酸、乙酸,10 mmol/L的甲酸铵、乙酸铵等物质时对目标物色谱行为和离子化程度的影响。结果发现,有机相为乙腈时的分离效果优于甲醇;在加入甲酸溶液后,负离子的形成受到抑制,而0.1%乙酸水溶液-乙腈体系的灵敏度优于甲酸铵-乙腈和乙酸铵-乙腈体系,故实验选择0.1%乙酸水溶液-乙腈为流动相,以获得较好的色谱峰形。其总离子流图见图1A。
2.4 方法评价
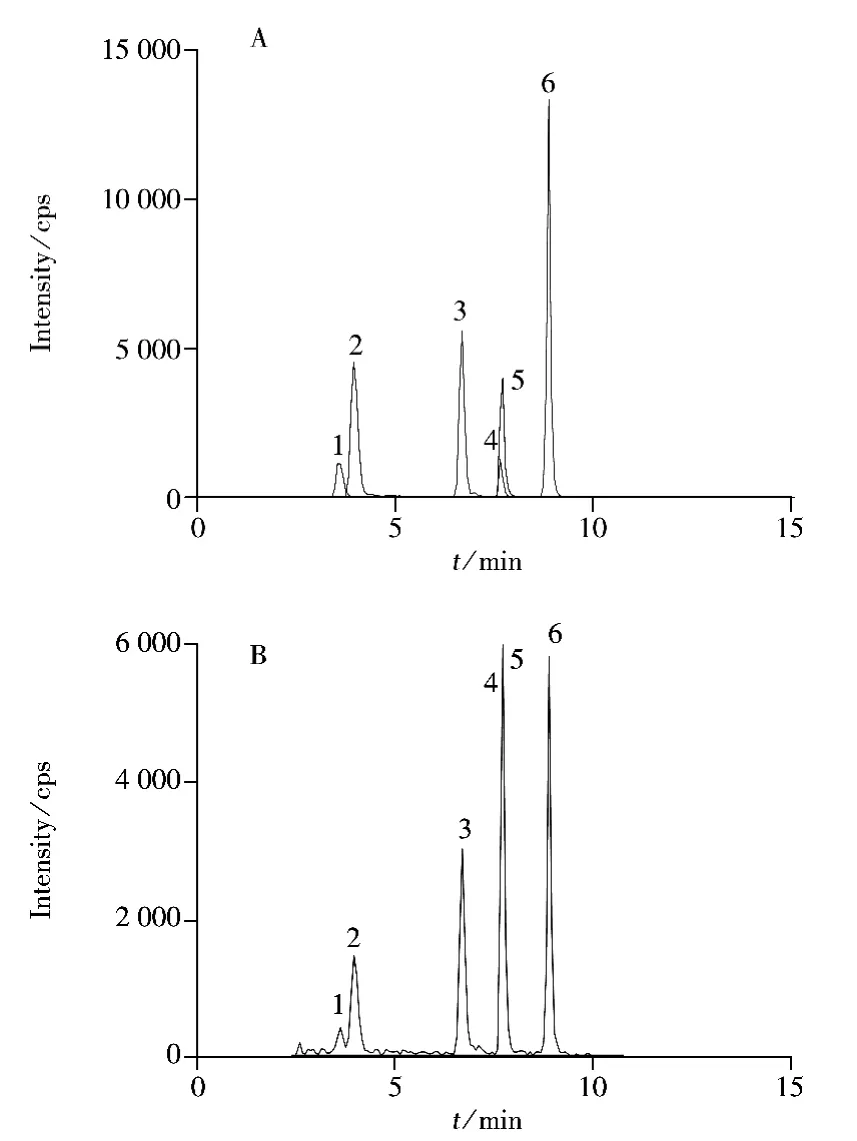
图1 6种吡唑类杀菌剂标准溶液(1.0 ng·mL-1,A)及空白葡萄酒中添加6种杀菌剂(0.4 μg·kg-1,B)的总离子流色谱图Fig.1 TIC chromatograms of six pyrazole fungicides(1.0 ng·mL-1,A)and a grape wine sample spiked with six pyrazole fungicides(0.4 μg·kg-1,B)
本方法采用基质匹配标准溶液进行校正补偿,以减少基质效应对6种杀菌剂检测结果的干扰。在优化条件下,考察了6种待测物的线性范围,结果显示,6种待测物的质量浓度(X,μg·L-1)均在 1.0 ~50.0 μg·L-1范围内与其峰面积(Y,Counts)具有良好的线性关系,相关系数(r2)均不低于0.999 3。以10倍信噪比(S/N)计算方法定量下限(LOQ)为 0.1 ~0.4 μg·kg-1(表 2)。与目前欧盟对葡萄酒中3种杀菌剂的最大残留限量(0.01 mg·kg-1)[2]要求相比,本方法完全满足这6种杀菌剂的检测要求。
在低、中、高3个加标水平下对同一空白葡萄酒样品进行3次平行实验,回收率与相对标准偏差(RSD)列于表2。由表2可知,各化合物的平均回收率为72.8%~92.6%,RSD不大于6.7%,本方法的准确度和精密度均符合农药残留分析的要求。图1B为空白葡萄酒样品中添加6种杀菌剂(0.4 μg·kg-1)后的总离子流色谱图。
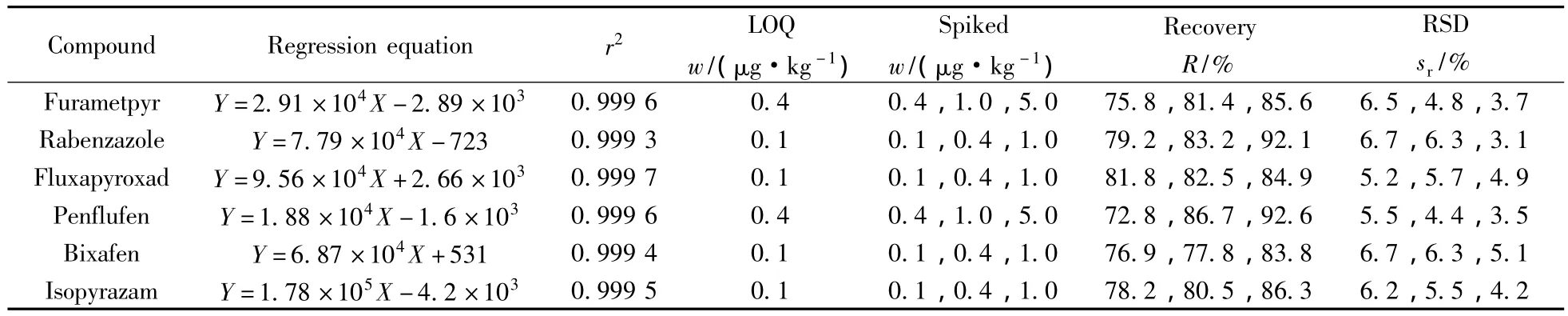
表2 6种吡唑类杀菌剂的线性关系、定量下限、回收率及相对标准偏差(n=3)Table 2 Regression relationships,limits of quantitation(LOQ),recoveries and RSDs of six pyrazole fungicides(n=3)
2.5 实际样品的测定
采用本文建立的方法,对实验室受理的50种进口葡萄酒进行6种吡唑类杀菌剂残留检测,结果均未检出上述6种杀菌剂。
3 结论
本文建立了液相色谱-串联质谱技术同时测定葡萄酒中戊苯吡菌胺、氟唑菌酰胺、吡唑萘菌胺、吡咪唑、联苯吡菌胺、呋吡菌胺的分析方法,该方法前处理简单,灵敏度高,定性、定量准确,满足国际上对葡萄酒中吡唑类杀菌剂MRLs的要求,可用于葡萄酒中这6种杀菌剂的日常测定和确证工作。
[1]Vicentini C B,Romagnoli C,Andreotti E,Mares D.J.Agric.Food Chem.,2007,55(25):10331-10338.
[2]http://ec.europa.eu/sanco_pesticides/public/index.cfm?event=pesticide.residue.CurrentMRL&language=EN,EU Pesticides database.
[3]Shen W J,Mao Y M,Wu B,Shen C Y,Jiang Y,Zhao Z Y,Liu H,Gong Y X,Lian H Z.Chin.J.Anal.Chem.(沈伟健,毛应民,吴斌,沈崇钰,蒋原,赵增运,柳菡,龚玉霞,练鸿振.分析化学),2010,38(7):941-947.
[4]Menezes Filho A,dos Santos F N,Pereira P A.Talanta,2010,81(1/2):346-354.
[5]Huang C Q,Ding H Y,Zhu X Y,Chen L L,Li B,Lou C J.J.Instrum.Anal.(黄超群,丁慧瑛,朱晓雨,陈玲玲,李铂,楼成杰.分析测试学报),2011,30(6):656-660.
[6]Tian H Z,Zhou Y M.J.Instrum.Anal.(田宏哲,周艳明.分析测试学报),2010,29(1):93-96.
[7]Li J G,Wang Y F,Shi J W,Jiang L,Yao X P,Fang L Y.Chin.J.Chromatogr.(李继革,王玉飞,施家威,蒋丽,姚浔平,方兰云.色谱),2012,30(3):262-266.
[8]Dong F S,Chen X,Liu X G,Xu J,Li Y B,Shan W L,Zheng Y Q.J.Chromatogr.A,2012,1262:98 -106.
[9]Fontana A R,Rodríguez I,Ramil M,Altamirano J C,Cela R.J.Chromatogr.A,2011,1218(16):2165 -2175.
[10]Li S S,Liu X G,Zhu Y L,Dong F S,Xu J,Li M M,Zheng Y Q.J.Chromatogr.A,2014,1358:46 -51.
[11]Tr9sken E R,Bittner N,V9lkel W.J.Chromatogr.A,2005,1083(1/2):113-119.
[12]Montes R,Rodríguez I,Ramil M,Rubí E,Cela R.J.Chromatogr.A,2009,1216(29):5459 -5466.
[13]Li Y,Chen X,Fan C L,Pang G F.J.Chromatogr.A,2012,1266:131-142.
[14]Wang C,Wu Q H,Wu C X,Wang Z.J.Hazard.Mater.,2011,185(1):71 -76.
[15]Farajzadeh M A,Khoshmaram L.Food Chem.,2013,141(3):1881-1887.
[16]Hem L,Choi J H,Park J H,Mamun M I R,Cho S K,Abd El-Aty A M,Shim J H.Food Chem.,2011,126(4):1533-1538.
[17]Fraige K,Pereira-Filho E R,Carrilho E.Food Chem.,2014,145:395-403.
[18]Sun J P,Hou X G,Liang F,Shi T H,Duan C Q.Chin.J.Anal.Chem.(孙建平,侯小歌,梁峰,时同华,段长青.分析化学),2006,34(11):1565-1569.

