重庆某地仔猪免疫蓝耳病活疫苗的最适剂量筛选
胡昌金 ,陈 勇 ,段 兵 ,唐臣学 ,程绍伟 ,范才良*
(1.重庆市荣昌县畜牧兽医局,重庆 荣昌 402460;2.西南大学荣昌校区动物医学系,重庆 荣昌 402460)
高致病性猪蓝耳病以怀孕母猪的繁殖障碍(流产、死胎、木乃伊胎)及各年龄段猪特别是仔猪的呼吸道疾病为主要特征,现已成为规模化猪场的主要疾病之一。2006年夏秋季节,我国发生不明原因的猪“高热病”,2007年1月,最终确定猪“高热病”的主要病原为变异的猪蓝耳病病毒,并定名为高致病性猪蓝耳病,现已作为我国生猪强制免疫的病种之一 其流行特点:一是流行快,发病广,危害重,多途径传播,临床表现复杂化,常由流产型向混合感染高热型转变;二是仔猪和育肥猪死亡率呈上升趋势;三是隐性带毒感染日趋普遍,主要表现为食欲下降、生产性能降低;四是继发或混合感染呈上升趋势;五是该病起初多发于6~8月,现在已经没有明显的季节之分,常年发病,呼吸道是该病的主要感染途径,应激因素可引起发病加剧。
高致病性猪蓝耳病病毒(PRRSV)是变异率较高的病毒。当前我国猪群中流行的PRRSV流行株呈现多样化趋势,不同毒株之间出现基因重组,活疫苗毒株与流行毒株重组,一个猪场、一个猪群同时存在经典蓝耳病病毒与高致病性蓝耳病病毒(HPPRRSV),并同属于美洲型。2010年在韩国与俄罗斯等国先后发生欧洲型PRRSV流行,在香港特区的猪场中也分离到欧洲型PRRSV毒株,说明我国猪群也面临着欧洲型PRRSV的严重威胁,应引起高度重视。
本试验用不同头份高致病性猪蓝耳病活疫苗对仔猪进行免疫注射,然后用ELISA试验检测抗体水平,从而筛选出最适免疫剂量,为制订仔猪的免疫程序提供参考。
1 材料与方法
1.1 材料
1.1.1 主要药品及耗材。高致病性猪蓝耳病活疫苗JXA1-R株(中牧实业股份有限公司成都药械厂生产,批号:1305044-2);猪繁殖与呼吸综合征病毒ELISA抗体检测试剂盒(重庆业为基生物科技有限公司生产,批号:20130619005);pH值为7.2的磷酸盐PBS溶液。枪头、EP管、帽子、手套,失离子水,500~1000mL试剂瓶、封膜、吸水滤纸、标记笔。
1.1.2 主要仪器。离心机、8道可调节移液器、生化培养箱、纯水仪、单道可调节移液器、酶标仪、电子天平等。
1.2 试验方法
1.2.1 确定试验动物。2013年9月,选择荣昌县清升镇5个、远觉镇8个小型养殖场符合免疫条件的30日龄左右的仔猪,每窝随机抽取3头检查血清中的母源抗体含量。把母源抗体全为阴性和临床检查健康的仔猪作为试验对象。按照荣昌县猪瘟、蓝耳病、口蹄疫三针同时免疫的操作方式进行免疫注射,免疫后佩戴耳标并作好记录。
1.2.2 试验分组。见表1。
1.2.3 采血并分离血清。分别在注射疫苗后28、60d,对被免仔猪进行前腔静脉采血、分离血清,统一编号送至实验室保存、备检。各血清样本见表2。
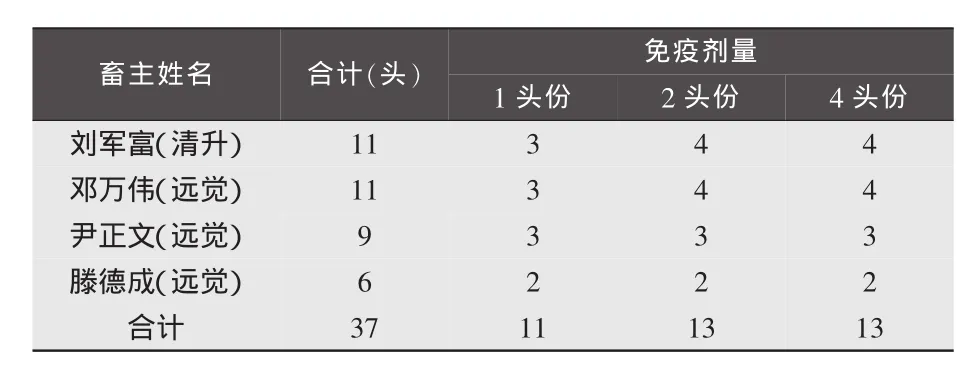
表1 试验分组
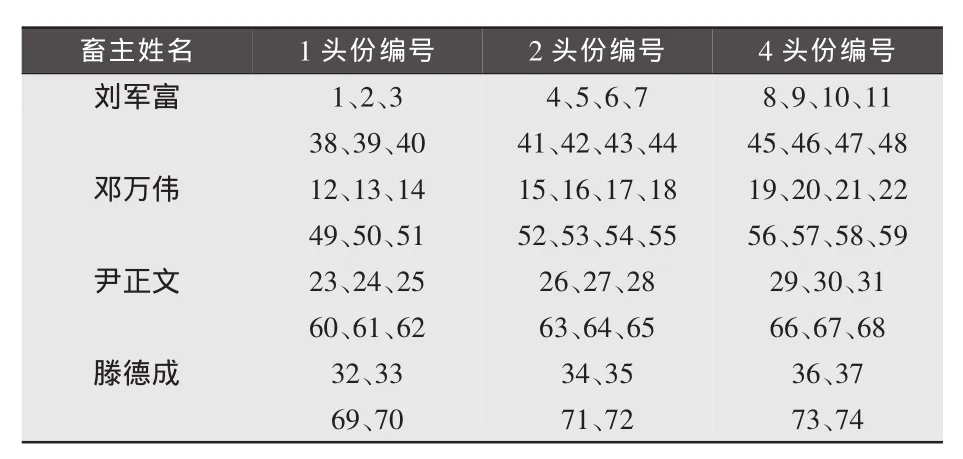
表2 样本编号
1.2.4 用ELISA方法检测免疫效果。首先对74个样本进行抗体检测,筛选出阳性血清,然后在所有阳性血清中按1、2、4头份随机抽样各5份进行血清倍比稀释,再次做ELISA血清检测,观察免疫后的相对抗体滴度。检测方法:一个血清稀释板全部加入25μL pH值为7.2的磷酸盐PBS溶液,然后分别在第一孔加入被检血清 25 μL,混匀,取出 25 μL稀释的血清放入第二孔,依次稀释,最后25μL弃之。
血清倍比稀释情况如下:1头份按1、2、4倍稀释共 15 个样,随机抽样的编号为:16、29、43、57、70;2头份按1、2、4、8倍稀释共20个样,随机抽样的编号为:6、12、30、48、62;4 头份按 1、2、4、8、16 倍稀释共25 个样,随机抽样的编号为:2、40、54、63、67。
2 试验结果
2.1 阳性血清筛选 结果见表3。由表3的吸光度可知7个为阴性,其中1头份6个,2头份1个;其他全为阳性。
2.2 免疫后相对抗体滴度的检测 由表4的吸光度可知:1头份1倍稀释的有3个阳性、2个阴性,2倍稀释、4倍稀释的都为阴性;2头份1、2倍稀释的全为阳性,4倍稀释的有3个为阳性、2个为阴性,8倍稀释的全部为阴性;4头份1、2倍稀释的全为阳性,4倍稀释的有4个为阳性、1个为阴性,8、16倍稀释的全部为阴性。
2.3 生物学统计结果 由表5分析得出:注射高致病性猪蓝耳病活疫苗1头份与2头份之间的免疫效果差异显著,注射2头份与4头份之间的差异性不显著。
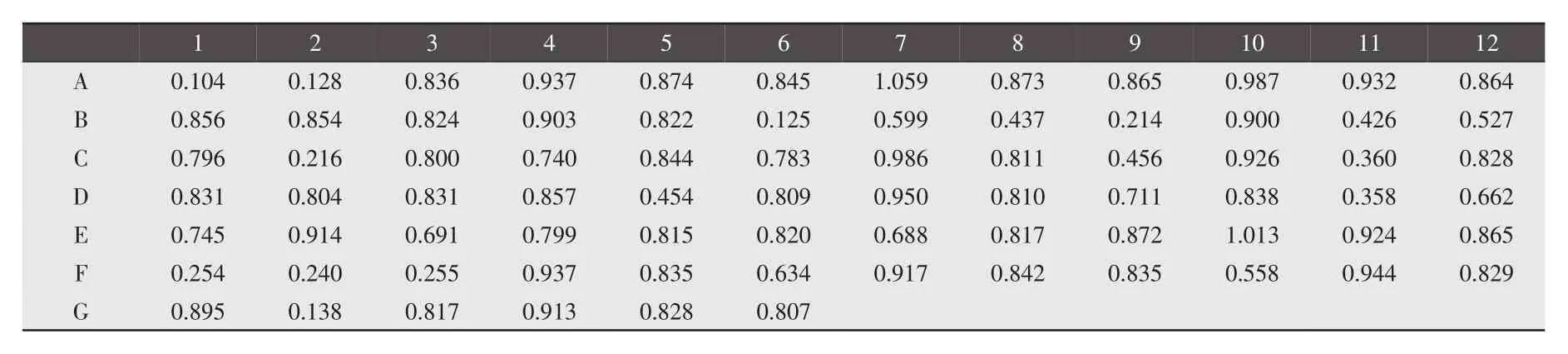
表3 吸光度

表4 吸光度
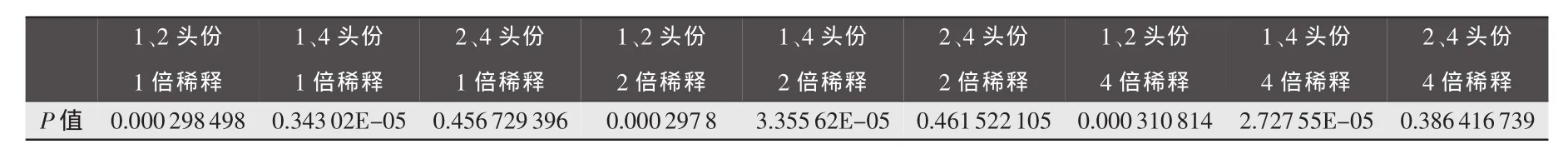
表5 方差分析P值
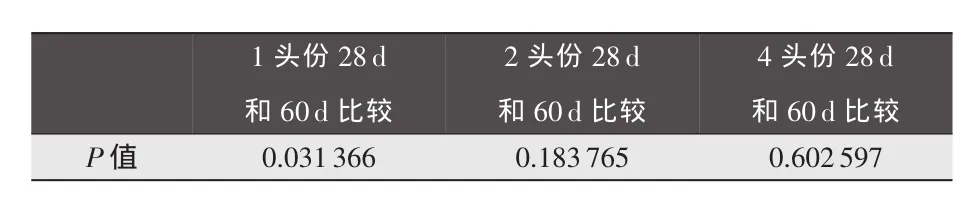
表6 方差分析P值
由表6可知,注射1头份高致病性猪蓝耳病活疫苗后28d和60d,抗体效果差异性显著;注射2头份、4头份后28d和60d,抗体效果差异性不显著。
3 分析与讨论
3.1 从本试验结果可知,注射高致病性猪蓝耳病活疫苗1头份与2头份间的抗体滴度的差异性显著,注射2头份与4头份间的差异性不显著。1头份免疫后在28d和60d所产生抗体的差异性显著,而2头份、4头份分别在28d和60d所产生的抗体差异不显著。说明免疫1头份的抗体水平不能达到坚强的免疫保护力。分析其原因可能是:(1)被免猪只处于亚健康状态或者因饲养管理水平存在差异使被免猪只产生免疫应答不完全;(2)三针同时免疫可能存在疫苗之间相互干扰的现象[3];(3)严格按照标准剂量1mL免疫可能出现疫苗注射操作不当而致药量注射不足;(4)较小的剂量不能克服疫苗之间的交叉干扰,更不能激活体内免疫细胞产生较高的抗体。
3.2 高致病性猪蓝耳病是一种免疫抑制性疾病,其持续性感染会在感染猪体内长期存在,成为消灭和减少PRRS在猪群中传播的严重障碍,一旦发病就会导致其他疾病(如猪瘟)的抗体水平下降,诱发猪瘟、猪圆环病毒病、猪支原体肺炎等疾病的混合感染或者继发感染。因此,养猪场对猪瘟的免疫非常重要,应以此作为疾病防控的基础。建议国内猪场首先需要做好猪瘟免疫,并定期检测猪瘟抗体滴度,当猪瘟抗体滴度下降到保护水平之下时,应及时补免猪瘟疫苗,这对于因高致病性猪蓝耳病暴发,降低猪只大规模死亡具有重要的作用[7]。
3.3 控制高致病性猪蓝耳病在国内外的研究很多,最有效的办法:一是加强免疫注射,国家已经将该病纳入强制免疫计划;二是随时对养殖场进行蓝耳病病原学监测,掌握带毒情况,及时制定防控措施;三是严格按照动物引种程序,做好引进猪只的检疫、隔离饲养、消毒等生物安全措施;四是淘汰带毒猪只,达到净化此病的目的[9]。
3.4 蓝耳病主要参与细胞免疫,猪接种蓝耳病活疫苗后3~4周才能产生保护性抗体,在此期间内如果发生感染都会导致之前的免疫失败。由于野毒的毒力强于弱毒,导致强毒很快侵入并占得优势,从而引起发病。所以,很多猪场在紧急接种的过程中由于无法确定是否存在野毒潜伏感染,结果导致免疫无效,甚至出现免疫后发病率反而急剧增加的现象[8-9]。
4 结论
免疫2头份的抗体滴度比免疫1头份的抗体滴度高,更具有保护力,且成本低。4头份和2头份的抗体滴度差异不显著,但注射4头份的成本更高。可见荣昌地区在注射高致病性猪蓝耳病活疫苗时,最适宜免疫2头份剂量。
[1] 王占元.猪蓝耳病的诊断与综合防控措施[J].养殖技术顾问,2012(7):90-92.
[2] 张梅,刘光瑞,王棋文,等.猪蓝耳病的诊断技术与控制方法[J].贵州畜牧兽医,2010(4):12-14.
[3] 张文亚.高致病性猪蓝耳病的防治研究[J].中国畜禽种业,2009(3):125-126.
[4] 王安民.猪蓝耳病的防治[J].畜牧兽医杂志,2013(5):119-121.
[5] 万遂如.充分认识蓝耳病对养猪业的危害[J].农村养殖技术,2011(4):19-20.
[6] 郑利霞,舒菊英,郑水芳.猪瘟、口蹄疫与高致病性蓝耳病疫苗不同组合的免疫效果试验[J].浙江畜牧兽医,2012(3):26-27.
[7] 李贺金,朱永信.影响仔猪高致病性蓝耳病免疫效果的几个因素[J].养殖技术顾问,2012(3):204.
[8] 邓永强,陈斌,秦学远,等.高致病性猪蓝耳病活疫苗(JXA1-R株)安全性与免疫效力试验[J].四川畜牧兽医,2011,38(7):24-25.
[9] 袁立岗,冉多良.猪蓝耳病与猪瘟、O型口蹄疫免疫抗体监测结果分折[J].国外畜牧学(猪与禽),2010(2):75-78.

