杯 [4]芳烃衍生物与Li+络合研究和海水提锂的新展望
温贤勇,裘俊红
(浙江工业大学绿色化学合成技术国家重点实验室,浙江 杭州 310014)
1 问题的提出
近20a来,杯芳烃的研究日新月异、迅速发展,已成为一个焦点性研究领域[1-6]。杯芳烃作为一类新型的且具有独特空穴结构的大环化合物,已成为继冠醚和环糊精之后的第三代超分子化合物[7-9]。杯芳烃的上缘由疏水亲油性、处于苯环羟基对位的取代基组成,下缘是由亲水性的酚羟基紧密而又有规律组合而成,中间则由苯环构成一个具有电子的憎水空腔。与冠醚和环糊精相比,杯芳烃具有如下的特点:①根据需要可获得大小不同的空腔;②在不同的反应条件下得到不同的构象;③通过有机合成,获得各种衍生物。所以,杯芳烃作为一种高度选择性的主体分子,它能和中性分子、有机分子等形成配合物,另外由于杯芳烃本身有多个羟基和一个电子洞穴,使杯芳烃及其衍生物几乎能与所有的金属阳离子形成配合物[10-19],而使该物质在金属离子络合研究方面取得快速的发展。
锂被公认为“推动世界进步的能源金属”[20],在国民经济和国防建设中具有重要意义的战略物资[21]。但由于缺乏有效的海水卤水萃取剂而使得贫瘠的陆地锂资源越来越不能满足日益增长的锂市场需求,而丰富的海水锂资源却得不到有效利用。因此,本文着重介绍几种对Li+具有较高选择性的杯[4]芳烃衍生物萃取剂,为后续海水、卤水中Li+的分离、提取提供一个研究基础。
探索和研究关于碱金属Li+的萃取剂,研究对其具有高选择性和高吸附性能的萃取剂是作为对分离、提取、回收、再利用海水Li+的一个新方向。杯芳烃衍生物螯合Li+便是一个新的研究方向[22-23]。
2 (2+2')系列杯 [4]芳烃衍生物对Li+的萃取
R.Abidi等[24]早在1988年就成功合成了取代基为丙酸二乙酯的系列杯[4]芳烃衍生物,并简单描述了该类衍生物与金属离子的络合情况。Baklouti,L.等[25]在 R.Abidi等的基础上提出了杯 [4]芳烃衍生物 (2+2')模型,即合成过程中使杯芳烃衍生物在1、2号位和3、4号位取代基不同 (见图1,R1为1、2号位,R2为3、4号位),并研究了该类物质对碱金属的吸附性能。经研究发现衍生物1仅对Li+、Na+有吸附性,提取率约为4.1%和6.2%,对其他离子的几乎没有吸附作用 (见表1),而5的提取率达到最高为9.4%,高于对其他所有碱金属离子的提取率,同时该物质仅与Li+可以形成ML2的配合物,与其他碱金属离子形成ML配合物;化合物7与Li+、Na+形成ML2的配合物,与其他离子形成ML的络合物,虽然该物质对单一Li+的提取率略低于K+,远远低于Na+的提取率,但是从稳定性来说,化合物7与Li+的络合稳定性却比与Na+的稳定性强,并且在双离子Li+、Na+竞争的情况下,选择性SLi/Na=10。因此对于在单一的离子溶液中衍生物5对Li+的提取率最高,混合离子溶液中衍生物7对Li+的选择性最强。而其他几类物质对碱金属离子都有一定的螯合作用,也对Li+都有一定的萃取效果和具有一定的选择性,但是都不适合作为单一的Li+萃取剂。

图1 [2+2']混合型对叔丁基杯 [4]芳烃衍生物图

表1 在20℃下,[2+2']混合型对叔丁基杯 [4]芳烃衍生物将碱金属离子从水中萃取到二氯甲烷中的提取率[25]表
3 酰胺类杯 [4]芳烃衍生物
M.A.McKervey等[26]研究了 (3+1)模型对碱金属吸附,发现下缘为3个乙酯和1个甲酯取代的衍生物;3个二乙酯和1个吡咯烷酰胺杯[4]芳烃衍生物时可以大大提高对Li+的热力学吸附性能。同时该研究小组还合成了酰胺类系列的杯[4]芳烃衍生物 (见图2)并研究了该类物质与碱金属离子的络合情况以及络合物的热力学性能。
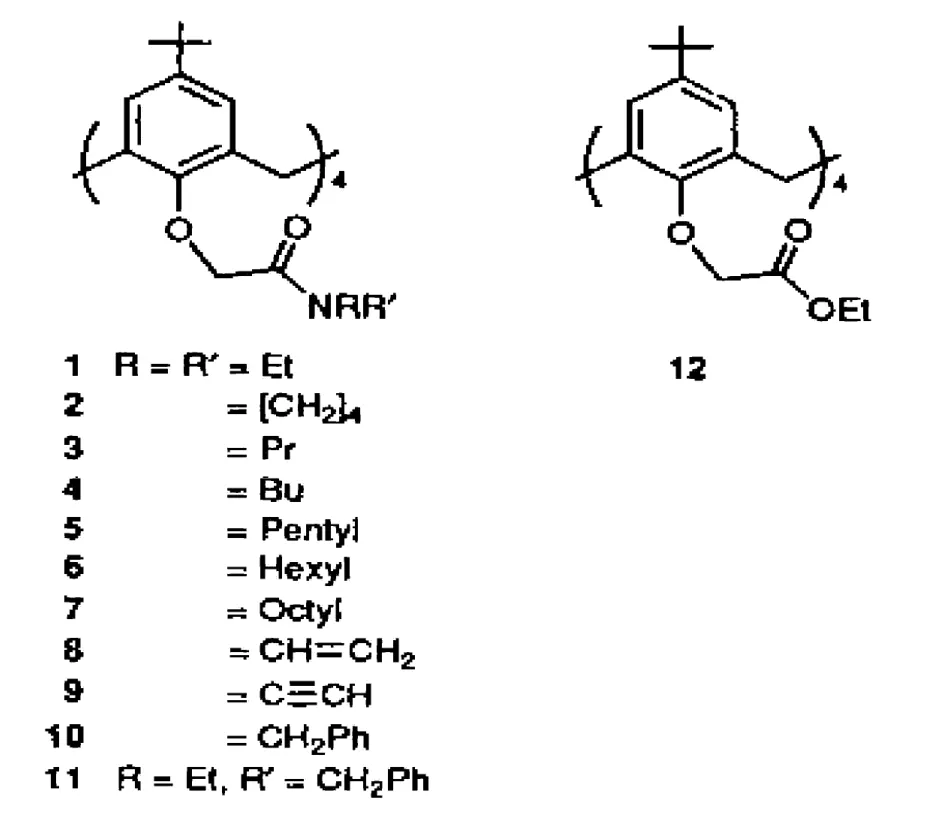
图2 酰胺类杯 [4]芳烃衍生物[26]图
该类衍生物中1、2、12对碱金属的萃取性能和溶液热力学性能 (见表2),从表2可以看出虽然1、2、12在甲醇溶剂中对Na+的选择性最好、平衡常数也最大,对Li+的选择性略低于对K+。然而无论在配体或者在溶剂中,都出现对Li+异常的热力学现象即熵增,第一,主要表现在配体中对Li+的熵总是高于其他配体;第二,在甲醇作溶剂时配合物的稳定性与熵的控制行为也有比较明显的关联性;同时在乙腈作溶剂时衍生物1、12表现出对Li+配合物热稳定性比在甲醇作溶剂时高,出现-△Hc增加现象。究其原因是因为Li+为最小的金属阳离子以及当配体与Li+配合时大量溶剂释放出来的熵值较高所导致的。这就说明1、2、12三类物质在甲醇作溶剂或者1、12在乙腈作为溶剂时比较有利于与Li+形成络合物。
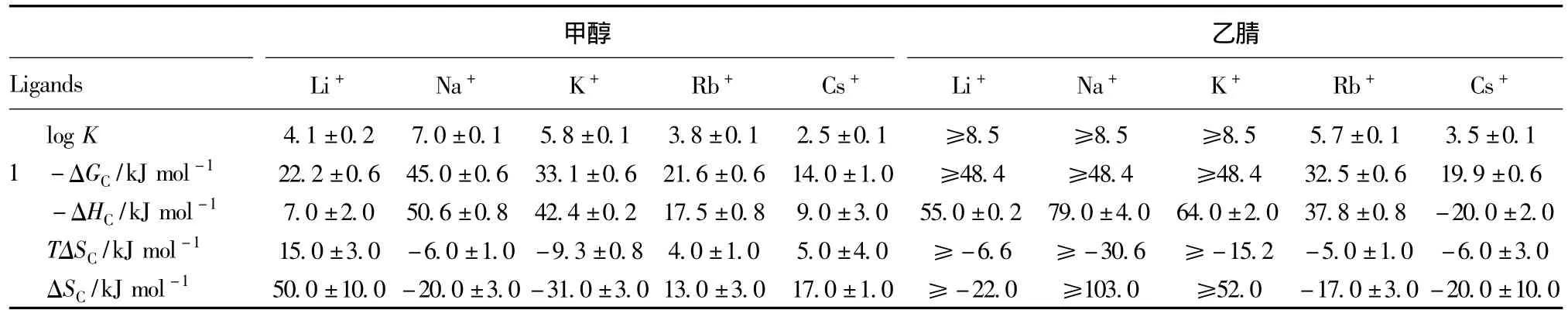
表2 酰胺类衍生物1、2、12以甲醇和乙腈作溶剂时与碱金属离子在25℃下的热力学参数[26]表

续表2
4 酯类、甲基类、苄基类杯芳烃衍生物
WandaSliwa等[27]在研究酯类、甲基类、苄基类系列杯芳烃衍生物与金属离子配合物中明确提出,对于a-g系列衍生物中 (见图3),在溶液中只有Na+和Li+时,该类物质与Li+络合稳定性比与Na+强。Lg化合物除了Cs+外都能络合,并且与Li+、Na+形成ML2配合物,与其他离子则形成ML配合物;Lb可以与除Cs+外所有的碱金属离子络合,并形成ML配合物,但是该物质对Na+的选择性最好;而对于Le化合物则可以与所有碱金属离子形成配合物,同样与Li+、Na+形成ML2配合物,与其他离子形成ML配合物,与Li+形成的ML2配合物的稳定性比与Na+的高,因此Le可以作为Li+的选择性萃取物质。经过熵和焓的对比实验得出杯芳烃衍生物对碱金属离子的络合稳定性为:含酯基的杯芳烃>含甲基的>含苄基的,其中ML2配合物为焓驱动,ML配合物为熵驱动。因此在对叔丁基杯 [4]芳烃衍生物中Le下取代为酯基时对Li+的选择性最好,同时形成ML2的配合物。

图3 酯类、甲基类、苄基累对叔丁基杯 [4]芳烃衍生物a-g[27]图
5 醚类衍生物对Li+选择性
早在1989年关于1-3桥联杯 [4]醚类衍生物对碱金属和碱土金属的高吸附性和高选择性就有了相关报道[28-29]。DongmeiZhang 等[30-31]在前人的基础上,实验(见图 4)以对叔丁基杯 [4]芳烃为原料在:①HOCH2CH2SCH2CH2OH,TPP,DEAD,甲苯作溶剂下反应3h得到 1-2桥联硫醚的衍生物 11[30];②加入 NaH,BrCH2CO2Et,THF反应12h得到1-2桥联硫醚3-4位接枝乙酸乙酯的衍生物12;③在10%aqMe4NOH,THF回流12h得到3-4位为乙酸取代基的衍生物1;④加入草酰氯、苯回流10~12h后;⑤加入NaH,NH2SO2X,THF反应12h便可以得到2-5的系列衍生物。1-5衍生物可以在水溶液中直接萃取 Li+、Na+、K+、Cs+、Rb+,形成 M2L配体,增加了单位配体萃取金属离子的量,但是在酸性较强的条件下,无萃取效果。1、3、5衍生物优先对Na+萃取,而2、4衍生物则优先萃取Li+。在1-5衍生物配合碱金属离子的基础上,DongmeiZhang等[31]研究了1,2桥联氧的杯芳烃衍生物6-10(见图5)。对比对叔丁基杯[4]芳烃1-2桥联氧或者硫时对Li+的选择性时发现,在相同的酸性条件下,桥联硫醚的衍生物对Li+的选择性明显比桥联氧好。因此可以得出:桥联硫时不仅增加该杯芳烃的水溶性同时取代为乙酸乙酯基时对Li+的选择性最强。
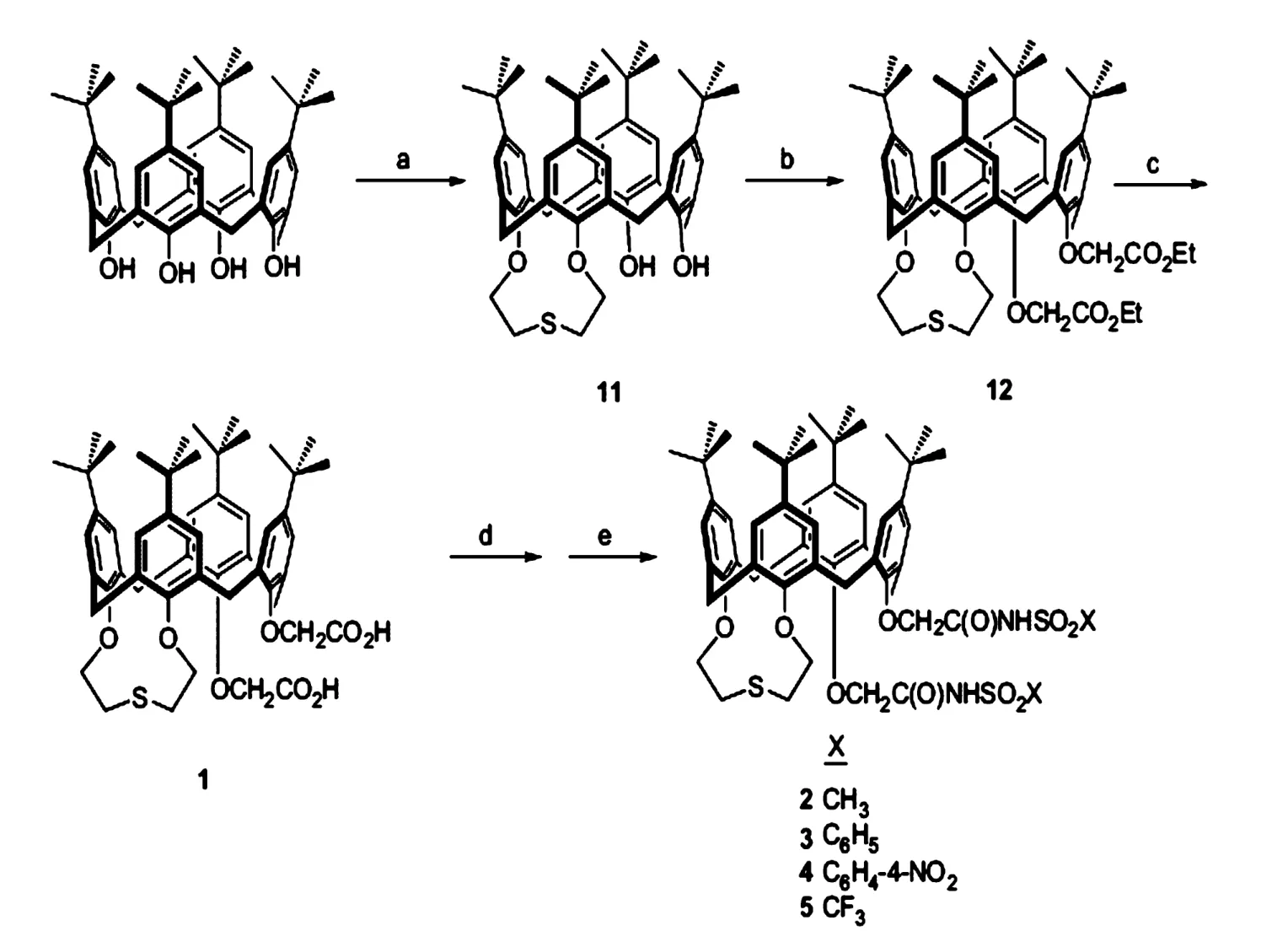
图4 合成1,2-桥联硫醚的对叔丁基杯 [4]芳烃的系统衍生物1-5[30]图
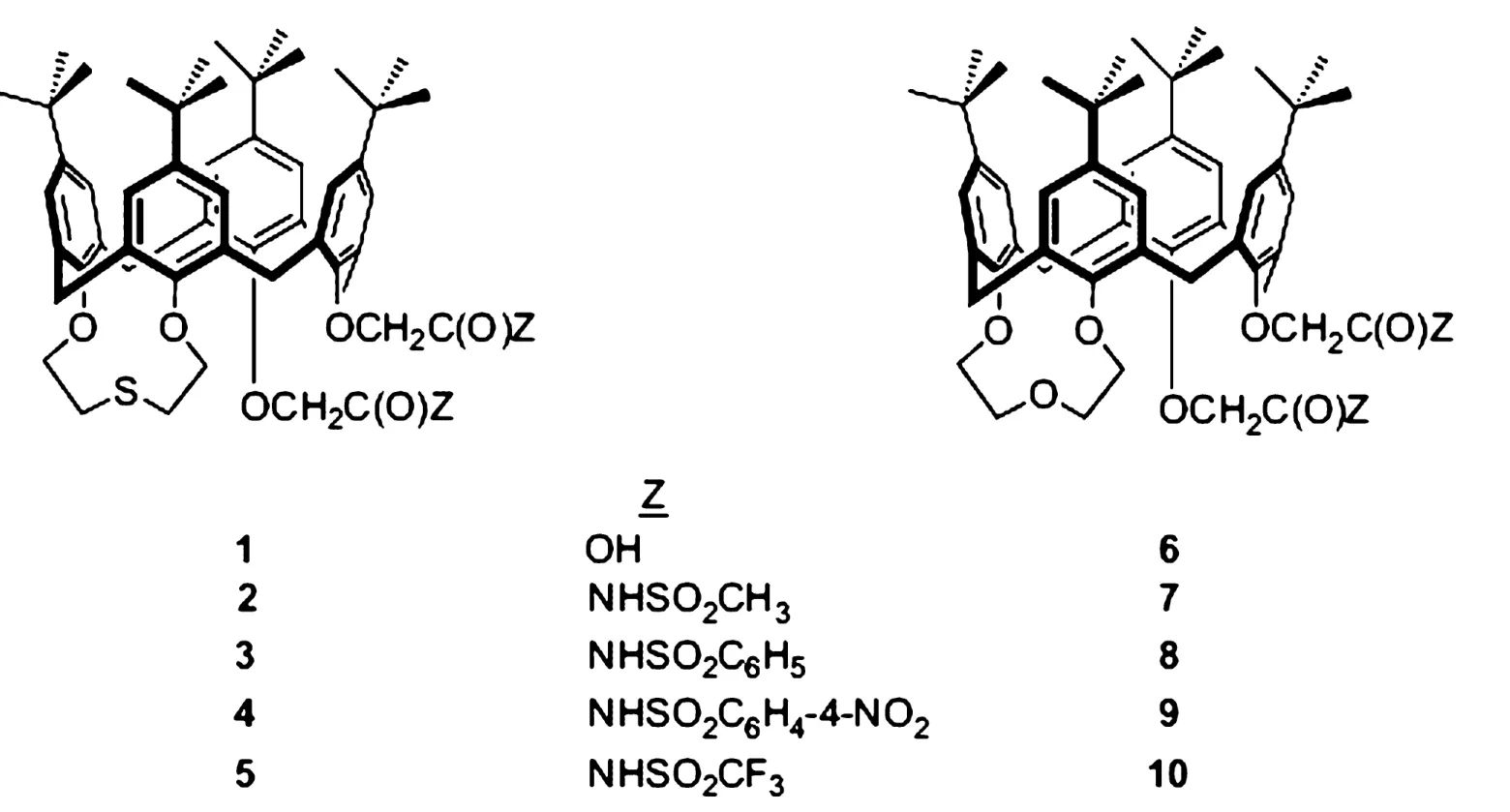
图5 1-5为1,2-桥联硫醚的对叔丁基杯 [4]芳烃衍生物,6-10为1,2-桥联醚的对叔丁基杯 [4]芳烃衍生物[31]图
6 其他类型杯芳烃对Li+的选择性
E.Makrlík[32]等在研究了对叔丁基杯 [6] 芳烃衍生物对碱金属在水-硝基苯2项体系中的萃取实验。

M+(Li+、Na+、K+、Rb+)aq为水系,nb为硝基苯系。同时研究了杯[6]芳烃衍生物在水-硝基苯体系中的2项平衡常数进行探讨 (见表3),得出碱金属离子与六乙基对叔丁基杯[6]芳烃六乙酸酯配合的稳定性常数顺序为Li+>Na+>K+>Cs+>Rb+。赵群力等[33]在杯芳烃与金属离子配合的最新进展中提到,M.R.YAFTIAN等[34]对2种不同的杯[4]芳烃衍生物对于碱金属的螯合稳定性进行研究时发现,与碱金属离子的螯合稳定性为:Na+>K+>Rb+>Li+≈Cs+。

表3 对叔丁基杯 [6]芳烃六乙酸乙酯在25℃下与碱金属离子在两相体系水和硝基苯中的络合稳定平衡数据[32]表
7 结语
从几类衍生物对Li+的选择性和吸附性可以看出,(2+2’)系列对Li+的选择性为酯类竞争性最好,醚类的提取率最高;酰胺类杯[4]芳烃衍生物对Li+的选择性时发现,酰胺酯类对Li+的选择性最好,并且该类物质形成的配合物热稳定性强,萃取过程中熵增明显,利于Li+提取的进行;酯类、甲基类、苄基类杯芳烃衍生物对Li+形成ML2络合物,并且得出对Li+的选择性高低顺序为:含酯基的杯芳烃>含甲基的>含苄基的;醚类杯芳烃衍生物对Li+的选择性时,形成M2L不仅增加了单位配体的提取率,同时该杯芳烃的具有水溶性可以直接在水中进行对Li+提取,同时桥联硫醚取代为乙酸乙酯基时对Li+的选择性最强。因此可以得出结论:不管哪一类杯芳烃衍生物,其中具有酯基取代基时对Li+的选择性最强,热稳定性也相对较高,有利于对Li+的分离提取。
在未来的海水中Li+的分离提取上可以通过离子印迹技术或者分子筛等手段对上述对Li+具有较好选择性的酯基类杯芳烃衍生物单体进行聚合,合成可以对Li+分离提取过程中具再生性强、使用寿命长、特异性吸附效果好、吸附容量大、粒度均匀并可实现连续性操作的海水提锂吸附剂。
[1] Gutsche,C. D. . Calixarenes: An Introduction,Monographs in Supramolecular Chemistry [M]. Cambridge: Royal Society of Chemistry,2008: 208 - 238.
[2] Vicens, J. , Harrowfield, J. . Calixarenes in the Nanoworld [M]. Dordrecht : Springer Verlag,2007: 4020 - 4021.
[3] Dalgarno, S. J. , Thallapally, P. K. , Barbour, L. J. . Engineering void space in organic van der Waals crystals:calixarenes lead the way [J]. Chem. Soc. Rev. ,2007,36(30) : 236 - 245.
[4] Mohammed - Ziegler,I. ,Billes,F. . Optical spectroscopy and theoretical studies in calixarene chemistry [J]. Incl. Phenom.Macrocycl. Chem. ,2007,58 (4) : 19 - 42.
[5] Baldini, L. ,Casnati,A. , Sansone, F. . Calixarenebasedmul tivalent ligands [J]. Chem. Soc. Rev. ,2007,36 (3) : 254- 266.
[6] Sliwa,W. , Kozlowski, C. . Calixarenes and Resorcinarenes, Synthesis Properties and Application [M]. Weinheim: Wiley -VCH,2009: 57 - 135.
[7] Takeshita M, Shinkai S. Bull. . Recent Topics on Functionalization and Recognition Ability of Calixarenes: The ‘Third Host Molecule’ [J]. Chem. Soc. Jpn. . 1995,68(7) : 1088 - 1097.
[8] Dodziuk,H. . Cyclodextrins and their Complexes: Chemistry,Analytical Methods, Applications [M]. Weinheim: Wiley -VCH,2006 (34) : 106 - 147.
[9] Roux,M. ,Perly,B. ,Djeda¨ni - Pilard,F. . Self - assemblies of amphiphilic cyclodextrins [J]. Eur. Biophys, 2007, 36(24) : 861 - 867.
[10] Ocak, U ¨. , Ocak, M. , Surowiec, K.,. Metalion complexation in acetonitrile by di - ionized calix [4] arenesbearing two dansyl fluorophores. [J]. Incl. Phenom. Macrocycl. Chem. ,2009,63 (35) : 131 - 139.
[11] Sgarlata,C. ,Zito,V. ,Arena,G.,. A sinapic acid - calix [4] arene hybrid selectively binds Pb2+ over Hg2+ and Cd2+ [J]. Polyhedron,2009,28 (4) : 343 - 348.
[12] De Zorzi, R. , Guidolin, N. , Randaccio, L. , et al. Nanoporous crystals of calixarene /porphyrin supramolecularcomplex functionalized by diffusion and coordination of metalions [J]. Am. Chem. Soc. ,2009,131 (3) : 2487 - 2489.
[13] Kotzen,N. ,Goldberg,I. ,Vigalok,A. . Stepwise boron - to - zinc C6F5 group transfer in a Zn - calixarene system [J].Organometallics,2009,28 (21) : 929 - 932.
[14] Redshaw,C. ,Homden,D. ,Hughes,D. L. . New structural motifs in chromium (III) calix [4] and [6] arene chemistry[J]. Dalton Trans,2009,35 (9) : 1231 - 1242.
[15] Liu Y. ,Bi Y. ,He W.,. A copper /p - sulfonatocalix [6]arene /phenanthroline supramolecular compound with 1D [Cu2++ - calixarene] n coordination chains [J]. Mol. Struct, 2009,919 (4) : 235 - 238.
[16] Gidwani, M. S. , Kaur, H. , Pal, U.,. Achromogeniccalixarene hydroxamic acid for the sequential separation of Ti (IV) and Zr (IV) [J]. Anal. Chem,2009,64 (5) : 104 - 109.
[17] Sodaye,H. ,Nisan,S. ,Poletiko,C.,. Extraction of uraniumfrom the concentrated brine rejected by integrated nuclear desalination plants [J]. Desalination,2009,235 (3) : 9 -32.
[18] Ha, J. - M. , Katz, A. , Drapailo, A. B. . Mercapto calixarene - capped gold nanoparticles via postsyntheticmodification and direct synthesis: effect of calixarene cavity - metal interactions [J]. Phys. Chem, 2009, 113 (21 ) :1137 - 1142.
[19] Dijkstra, P. J. , Brunink, J. A. , Bugge, K. - E. . Kinetically Stable Complexes of Alkali Cations with RigidifiedCalix [4] arenes: Synthesis, X - ray Structures, and Complexation of Calixcrowns and Calixspherands [J].Am. Chem. Soc. ,1989,111 (6 ) : 7567 - 7575.
[20] 雷家珩,弓巧侠,尚建华,等. 锂离子筛前驱体正尖晶石结构LiMn2O 的合成及其特性的研究[J]. 武汉大学学报:理学版,2001,47 (6) : 707 - 7l1.
[21] 杨晓菲. 能源生命金属—锂[J]. 中国金属通报,2009,28(4) : 34 - 35.
[22] Venkataramanan, N. S. , Sahara, R. , Mizuseki, H. . Hydrogen adsorption on lithium - functionalized calixarenes: acomputational study [J]. Phys Chem. ,2008,112 (12 ) : 19676 - 19679.
[23] Li, H. , Chen, Y. , Tian, D. . The synthesis of novel polysiloxanes with pendant hand - basket type calix [6] crownsand their transporting properties for metal ions in a liquidn Li+membrane [J]. Memb. Sci. ,2008,310 (22) : 431 - 437.
[24] L. Baklouti, R. Abidi, Z. Asfari. Novel Ligands Derivingfrom p - tert - Butyleafix [4] arene O - Substituted by Diethyl Malonate Functions [J]. Tetrahedron Letters, 1998, 39(7) : 5363 - 5366.
[25] Baklouti,L. ,Cherif. J. ,Abidi. R. . Synthesis and binding properties of calix [4] arenes with [2 + 2’] mixed ligatingfunctional groups [J]. Org. Biomol. Chem. , 2004, 2 (33) : 2786 - 2792.
[26] M. A. McKervey,M. J. Schwing - Weill,F. Arnaud - Neu. Extraction and Solution Thermodynamics of Complexation of Alkaliand Alkaline - earth Cations by Calix [4] arene amides [J]. J. CHEM. SOC. ,1996,199 (6) : 453 - 461.
[27] Wanda Sliwa,Tomasz Girek. Calixarene complexes with metal ions [J]. Incl Phenom Macrocycl Chem,2010. 10,6 (41) :15 - 41.
[28] Dijkstra, P. J. , Brunink, J. A. , Bugge, K. - E. . Kinetically Stable Complexes of Alkali Cations with Rigidified Calix,4] arenes: Synthesis,X - ray Structures,and Complexation of Calixcrowns and Calixspherands [J]. Am. Chem. Soc. ,1989,111 (31) : 7567 - 7575.
[29] Lamare,V. ,Dozol,J. - F. ,Ugozzoli,F. . X - ray Crystal Structures and Molecular Modelling Studies of Calix [4]dibenzocrowns - 6 and Their Alkali Metal Cation Complexes [J]. Org. Chem. ,1998,5 (2) : 1559 - 1568.
[30] Dongmei Zhang,Jennifer D. Crawford,Richard A. Bartsch. . Di - ionizable p - tert - butylcalix [4] arene - 1, 2 -monothiacrown - 3 ligands in the cone conformation: synthesis and metal ion extraction [J]. Tetrahedron,2008,64 (17) : 9843- 9849.
[31] Zhang,D. ,Cao,X. ,Purkiss,D. W. . Di - ionizable p - tert - butylcalix [4] arene - 1,2 - crown - 3 ligands in cone and1,2 - alternate conformations: synthesis and metal ion extraction [J]. Org. Biomol. Chem. ,2007,4 (2) : 1251 - 1259.
[32] E. Makrlík, P. V. aura, J. Budka. . Contribution to the thermodynamics of complexes of alkali metal cations with hexaethylp - tert - butylcalix [6] arene hexaacetate in the water - nitrobenzene extraction system [J]. Journal of Radioanalyticaland Nuclear Chemistry,2008. 11. 5 (15) : 463 - 466.
[33] 赵群力,高霞,陈平,等. 杯芳烃与金属离子配合的最新进展[J]. 应用化工,2010,39 (8) : 1237 - 1243.
[34] M. R. YAFTIAN, M. VAHEDPOUR. Alkali Metal Complexation. Binding Properties of cone and partial - coneCalix[4] arenes Bearing a Mixed (O2,O - 2 ) Donor Set (O =Phosphine Oxide; O - = Amide or Ester) [J]. Journal ofInclusion Phenomena and Macrocyclic Chemistry,2003. 10,7(54) : 129 - 132.

