相转移催化剂催化合成DL-扁桃酸
赵 仑,唐 栋,吴志正
DL-扁桃酸,又名α-羟基苯乙酸,是一种应用广泛的有机化学反应中间体,在各种有机反应和药物合成中用途广泛。在医药方面由于它具有较强的抑菌作用,因而广泛地应用于治疗泌尿系统疾病,杀菌剂扁桃酸乌洛托品就是其典型代表,同时也是合成其它一些抗生素药物的重要中间产物,如解痉剂乌托品类[1]、末梢血管扩张剂环扁桃酸酯等。而且在有机手性合成中它是一个重要的酸性光学拆分剂,广泛地应用于外消旋体氨基酸类、胺类等光学物质的拆分。传统的制备扁桃酸的方法为苯甲醛法,但由于在此反应中需要使用到剧毒物质氰化物,因而不安全且操作不便、步骤多、反应时间长,已经逐渐被其它方法取代。目前国内外用于合成扁桃酸主要采用相转移催化(phase transfer catalysis,PTC)法[2-3]。相转移催化技术是在20世纪70年代初发展起来的。相转移催化作用能使离子化合物与不溶于水的有机物质在低极性溶剂中进行反应,或加速这些反应。这种方法现在广泛应用于医药、农药、香料、造纸、制革等行业。相转移催化剂能加速或者能使分别处于互不相溶的两种溶剂(液-液两相体系或固-液两相体系)中的物质发生反应。反应时,催化剂把一种实际参加反应的实体(如负离子)从一相转移到另一相中,以便使它与底物相遇而发生反应。现阶段随着人们对实验工艺和反应条件的不断改进,相转移催化法也成功地应用于扁桃酸的合成,并且收到了很好的效果,大大地提高了扁桃酸的得率。目前常用相转移催化剂有:阴离子作反应物时,相转移催化剂常常是季铵盐(四级铵盐)、季鏻盐、锍盐或砷盐;阳离子作反应物时,相应的相转移催化剂往往是冠醚或穴醚等[5-6]。本实验中我们采用了一种新的季铵盐类相转移催化剂四乙基溴化铵,应用于DL-扁桃酸的合成中取得了较好实验效果。
1 实验方法
1.1 主要实验仪器及试剂
DF-1x型集热式磁力加热搅拌器(江苏金坛市金城国胜实验仪器厂);DZTW型电子调温电热套(河北黄骅市新兴电器厂);搅拌器(上海南汇电讯器材厂);NICOLET-370红外光谱仪(Nicolet公司制造)。
苯甲醛(化学纯,天津市化学试剂二厂);三氯甲烷(分析纯,北京市大兴区安定镇工业东区);四乙基溴化铵(分析纯,国药集团)。
1.2 实验方法
在250mL三颈烧瓶上配置搅拌器、冷凝管、滴液漏斗和温度计。依次加入5.6mL苯甲醛、10mL氯仿和0.46g四乙基溴化铵,水浴加热并搅拌。当温度升至56℃时,开始自滴液漏斗中加入70mL 30%的氢氧化钠溶液,滴加过程中保持温度在60~65℃,约20min滴加完毕,继续搅拌40min,反应温度控制在65~70℃。反应结束后,用100mL水稀释反应物并转入250mL分液漏斗中,再用乙醚萃取2次(每次18mL)。将萃取后的水相用硫酸酸化至pH=2~3,再次用乙醚萃取2次(每次18mL)。将4次萃取后的醚层合并用无水硫酸镁干燥,用水浴蒸除乙醚即得扁桃酸粗品。将粗产品置于转入50mL的圆底烧瓶中,加入少量甲苯进行回流,沸腾后补充甲苯至晶体完全溶解,趁热过滤,母液静置冷却后晶体析出,过滤即得产品[7-9]。
2 结果与讨论
2.1 反应时间对产率的影响
以四乙基溴化铵为催化剂,其用量为0.002mol,反应温度为65~70℃,改变反应时间(从滴加氢氧化钠开始),产物收率列入表1中。
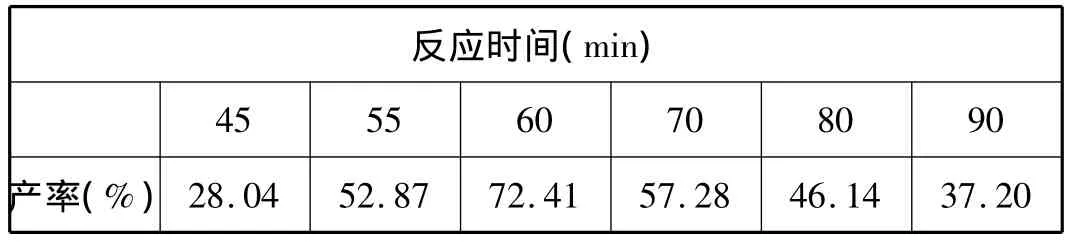
表1 反应时间对产率的影响
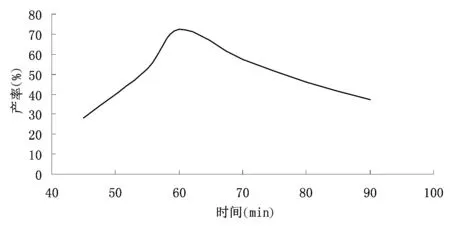
图1 反应时间对产率的影响
由图1可以看出,因反应时间在60min之前时,生成扁桃酸的产率一直在升高,随着反应时间的增加反应更充分,因而产率增大;当反应时间为60 min的时候,产品的收率达到最高;其后随着反应时间的增加,发现产率明显降低,这主要是由于随着反应时间增长,体系中发生了一些副反应,从而使副产物增多,同时产物扁桃酸也会发生一些分解,从而使产率降低。因此适宜的反应时间为60 min。
2.2 催化剂用量对产率的影响
以四乙基溴化铵为催化剂,65~70℃下反应60min,催化剂用量与产物收率(以苯甲醛计算)的关系列入表2中。

表2 催化剂用量对产率的影响
从图2可以看出,随着催化剂用量的增加,产物的得率增加,当催化剂用量达到0.002mol时产率基本达到最高点,随后增加催化剂的用量,产率也有所增加,但整体增加的幅度不大。且当催化剂用量较多时会给后处理带来较大困难,给反应中引入杂质,从而影响产物的纯度。综合考虑最佳的相转移催化剂用量为0.002mol。
2.3 反应物摩尔比对产率的影响
苯甲醛与三氯甲烷合扁桃酸,在反应中三氯甲烷是过量的,在n(苯甲醛)∶n(四乙基溴化铵)=1∶0.002,反应温度65~70℃,反应时间60min的条件下,改变三氯甲烷用量,结果见表3。
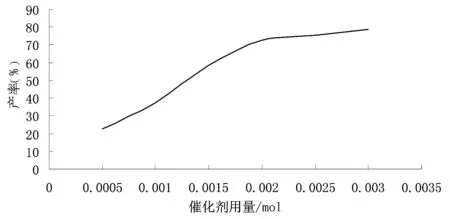
图2 催化剂用量对产率的影响
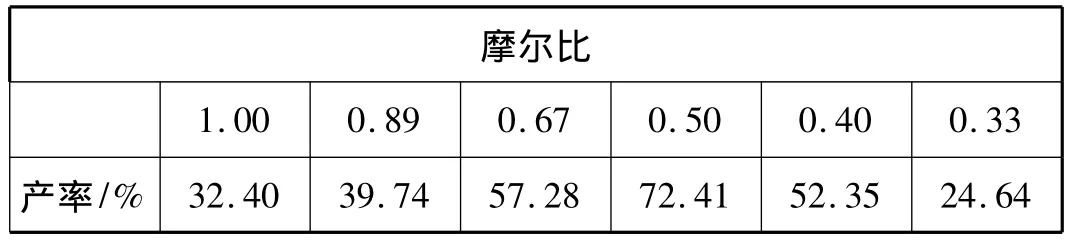
表3 反应物摩尔比对产率的影响

图3 反应物摩尔比对产率的影响
由图3可知,随着反应摩尔比的增加,扁桃酸的产率逐渐升高,当反应物的摩尔比为0.5时,产率达到最高;之后增加三氯甲烷的用量产率明显下降。这主要是由于随着三氯甲烷用量的增多,反应混合物中氢氧化钠的浓度相对减小,同时催化剂的浓度也会降低,进而影响催化效果致使产率降低。因此,n(苯甲醛)∶n(三氯甲烷)=0.5时最合适。
3 产品分析与鉴定
合成的产物经红外光谱表征IR(cm-1):1455、1487、1572(苯环骨架伸缩振动吸收峰),1289(羟基弯曲振动吸收峰),1718(羰基伸缩振动吸收峰),2632、2963(羧羟基伸缩振动吸收峰),3402、1048(醇羟基伸缩振动吸收峰),测试结果与文献值相符。经提纯后:熔点为120~122℃与文献值相符。
4 结论
结合实验结果、后处理等因素考虑,由苯甲醛与氯仿在相转移条件下合成扁桃酸外消旋体的最佳反应条件:反应温度为 65 ~70℃,反应时间为 60min,n(苯甲醛)∶n(三氯甲烷):n(四乙基溴化铵)=1∶2∶0.002,在此条件下产物最高收率可达72.41%。
[1]刘良.扁桃腈和扁桃酸的技术进展[J].精细化工化纤信息通讯,2002(1):6.
[2]陈红飘,林原斌,刘展鹏.D/L扁桃酸的合成研究[J].合成化学2002,10(8):186-189.
[3]张楠.手性化合物扁桃酸开发前景广阔[N].中国化工报,2002,2(21).
[4]李建生,郭英凯,吴静,等.固体酸催化合成3-甲氧基-4-羟基苯乙醇酸[J].精细与专用化学品,2006,14(13):16-18.
[5]龚楚儒,刘建明,周自怀,等.相转移催化制备苦杏仁酸[J].湖北师范学院学报:自然科学版,1988,8(2):79-82.
[6]Bigi F,Casiraghi G,Casnati G,Sartori G,Gasparri Fava G,Belicchi.M.F.J.Asymmetric electrophilic substitution on phenols.Enantioselective ortho-hydroxyalkylation mediated by chiral alkoxyaluminum chlorides[J].Org.Chem,1985,50(5018):368.
[7]Gathergood N,Zhuang W,J rgensen K.A.J.Catalytic Enantioselective Friedel-Crafts Reactions of Aromatic Compounds with Glyoxylate:A Simple Procedure for the Synthesis of Optically Active Aromatic Mandelic Acid Esters.Am.Chem Soc,2000,122(1251):217.
[8]覃春菀,刘艳凯.扁桃酸合成反应的研究[J].工艺与制备,2008,53(1):979-1006.
[9]焦家骏,有机化学实验[M].上海:上海交通大学出版社,2000.

