不同中药对桑黄液体深层发酵的影响1)
程俊文,贺亮*,胡传久,魏海龙,付立忠,邹景泉,韩素芳,韦朝阳
(1.浙江省林业科学研究院,浙江省森林资源生物与化学利用重点实验室,杭州 310023;2.浙江大学生命科学学院,杭州 310058)
桑黄(Phellinusigniarius)俗称桑黄菇、桑臣、桑耳等,是一种珍贵的大型药用真菌。目前,桑黄是国际公认的生物抗癌领域中效果最好的真菌[1]。桑黄具有抗癌、抗炎、抗氧化、提高免疫力、保肝护肝等多种药用功效[2-3],现代药理学研究表明,三萜、多糖和黄酮类物质是其关键药性成分[4]。目前,桑黄在国际市场上供不应求,野生桑黄资源有限,桑黄的人工栽培研究在国内又刚刚起步,因此,采用液体发酵技术进行桑黄的规模化生产具有广阔的前景。
中药中含有丰富的纤维素、淀粉、蛋白质、脂类等营养成分以及萜类、黄酮类、生物碱、皂甙类等活性物质[5],有研究表明,在培养基中添加适量中药成分,可促进药用真菌的生长或提高活性产物的产量[6],但中药在桑黄液体发酵上的应用尚未见报道。本研究选用5味不同中药添加到桑黄发酵培养基中,探究中药对其菌体生长、代谢产物的合成的影响,为提高桑黄活性物质的液体发酵生产探索一条新的途径。
1 材料和方法
1.1 供试菌株
桑黄(Phellinusigniarius):由浙江省林业科学研究院生物技术研究所实验室保藏。
1.1.2 中药材
薏苡仁、苦荞、银杏叶、连翘、金银花购自杭州华东医药中药材分公司,粉碎后备用。
1.1.3 培养基
斜面培养基(PAD):马铃薯浸出液200g/L,葡萄糖20g/L,琼脂15g/L,pH自然,在121℃下灭菌30min,备用。
液体种子培养基:葡萄糖20g/L,酵母粉5g/L,KH2PO41.0g/L,MgSO40.5g/L,pH 自然,在121℃下灭菌30min,备用。
液体发酵培养基:葡萄糖20g/L,酵母粉3g/L,蛋白胨4g/L,KH2PO41.0g/L,MgSO40.5g/L,pH自然。
1.1.4 主要仪器
可见分光光度计(U-1900);超净工作台(SWCJ-2F);电子分析天平(BSA224S);高压灭菌锅(SX500);恒温振荡器(ZHWY-211B);旋转蒸发仪(R-210);多功能高速离心机(CL31R);真空干燥箱(DZF6020);冷冻干燥机(LGJ-10C)等。
1.2 方法
1.2.1 中药提取液的制备
称取适量中药材(已粉碎,过60目),加6倍水浸泡0.5h,用电炉煎熬,调整适当的加热温度,保持温和的沸腾状态,煮沸30min,过滤收集提取液。重复提取1次,合并2次药汁,用8层纱布过滤,所得药汁用于桑黄液体摇瓶培养。
1.2.2 摇瓶液体培养
种子液培养:将在PDA斜面培养基中活化后的桑黄菌种,取5mm2(即黄豆大小)接入灭菌后种子液培养基中,150mL/500mL锥形瓶,28℃,130 r/min下摇床培养7d。
液体发酵:将一定量的中药水提物加入液体发酵培养基中,充分溶解混匀,分装于500mL锥形瓶中,装液量为200mL,将装有培养基的锥形瓶放入高温灭菌锅中,在121℃下灭菌30min。冷却后以10% 的接种量接入培养基中,在25℃,60r/min摇床中培养5d。每个试验设3个平行,并设置1组对照试验(不添加中药水提物的液体发酵培养基,其他条件相同)。
1.2.3 菌丝生物量的测定
发酵液经离心,沉淀,用水洗涤3次,再次离心,沉淀的菌丝体,置于65℃的干燥箱内干燥至恒重,称重得桑黄生物量。
1.2.4 胞外多糖含量的测定
取发酵上清液,加4倍95%乙醇沉淀,4℃放置24h,3000r/min离心20min,弃去上清液,用85%乙醇洗涤沉淀两次,3000r/min离心20min弃去上清液。所得沉淀待酒精完全挥发后,溶于蒸馏水以硫酸-苯酚法进行测定[7]。
2 结果与分析
2.1 中药提取物对桑黄发酵的影响
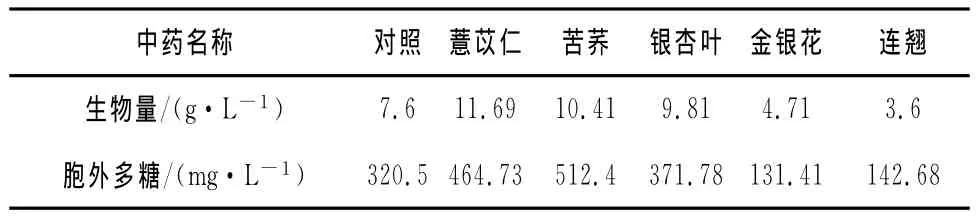
表1 中药提取物对桑黄深层发酵的影响
由表1可知,从桑黄发酵生物量来看,在所试验的5种中药水提物中,银杏叶、苦荞、薏苡仁对桑黄菌丝体的生长具有较好的促进作用,这3种中药对应各组的生物量分别是对照组的1.29~1.54倍;金银花、连翘对桑黄生长具有一定的抑制作用,生物量为对照的61.9%和47.4%。
从桑黄发酵胞外多糖来看,在所试验的5种中药水提物中,银杏叶、薏苡仁、苦荞对桑黄胞外多糖的生长具有一定的促进作用,这3种中药对应各组的胞外多糖分别是对照组的1.16~1.59倍;金银花、连翘对桑黄胞外多糖生成具有一定的抑制作用,胞外多糖仅为对照的41%和44.5%。
2.2 不同添加量的中药水提物对桑黄液体发酵的影响

图1 不同中药对桑黄深层发酵菌丝生物量的影响
由图1可知,薏苡仁、苦荞和银杏叶3味中药在低浓度时均能促进桑黄的生长,但随着添加量的增加,其生物量呈现了下降的趋势,说明这几味中药的用量应该控制在一定范围内,其中薏苡仁和苦荞的最佳添加量在2%,银杏叶的最佳添加量在4%。在试验浓度范围内,金银花和连翘随着浓度的增加,对桑黄深层发酵菌体生长的抑制作用越明显。

图2 不同中药对桑黄深层发酵胞外多糖生产的影响
由图2可知,薏苡仁、苦荞和银杏叶3味中药在低浓度时均能促进桑黄胞外多糖的分泌,但随着添加量的增加,其胞外多糖都呈现了下降的趋势,说明这几味中药的用量应该控制在一定范围内,其中薏苡仁和苦荞的最佳添加量在2%,银杏叶的最佳添加量在4%。在试验浓度范围内,金银花和连翘随着浓度的增加,对桑黄深层发酵菌体生长的抑制作用越明显。
3 结论
中药中的成分与药用真菌的生长代谢间存在着相互作用,因此中药中的某些成分可能刺激药用真菌的生长或活性代谢产物的产生[8]。本文开展了添加多种中药进行桑黄发酵的试验研究,对适合桑黄发酵的中药种类进行筛选,以期提高桑黄液体发酵菌丝体生长及其胞外多糖的生产。研究表明,薏苡仁、苦荞和银杏叶这3味中药在低添加量时,不仅对桑黄深层发酵菌丝体生长有促进作用,还能促进胞外多糖的分泌,随着添加量的升高,生物量和胞外多糖在一定剂量下都出现了峰值。金银花和连翘对桑黄桑黄深层发酵菌丝体生长和胞外多糖的分泌具有一定的抑制作用。至于中药对桑黄发酵的影响机理目前尚不清楚,还有待于进一步研究。
[1] 戴玉成.药用担子菌:鲍氏层孔菌(桑黄)的新认识[J].中草药,2003,34(1):94-95.
[2] LI Ge,KIM D H,KIM T D,et al.Protein-bound polysaccharide from Phellinus linteus induces G2/M phase arrest and apoptosis in SW480human colon cancer cells[J].Cancer Letters,2004,216(2):175-181.
[3] Shone M Y,Kim T H,Sung N J.Antioxidants and free radical scavenging activityof Phellinus baumii(Phellinus of Hymenochaetaceae)extracts[J].Food Chemistry,2003,82(4):593-597.
[4] 吕英华,王建芳,李玉平,等.药用真菌桑黄的研究进展[J].蚕业科学,2009,35(1):204-210.
[5] 侯晓梅,陈敏青,张慧蕾,等.中药提取物对桑黄深层发酵的影响 [J].食品科技,2013,38(9):185-188.
[6] Liu G Q,Xiao H X,Wang X L,et al.Stimulated production of triterpenoids of Ganoderma lucidum by an ether extract from the medicinal insect,Catharsius molossus,and identification of the key stimulating active components [J].Applied Biochemistry and Biotechnology,2011,165(1):87-97.
[7] 张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994.
[8] 杨海龙,唐华.中药对药用真菌深层发酵的影响[J].食品与发酵工业,2009,35(4):128-131.

