赤桉木质素合成途径OMT基因家族的原核表达与纯化研究
谷振军,章怀云 ,张党权,何含杰 ,陈丽莉,彭 宽 ,陈 容
(1. 经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004;2. 中南林业科技大学 林业生物技术湖南省重点实验室/ 湖南省生物发育工程及新产品研发协同创新中心,湖南 长沙 410004)
赤桉木质素合成途径OMT基因家族的原核表达与纯化研究
谷振军1,2,章怀云2,张党权1,2,何含杰2,陈丽莉2,彭 宽2,陈 容1,2
(1. 经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004;2. 中南林业科技大学 林业生物技术湖南省重点实验室/ 湖南省生物发育工程及新产品研发协同创新中心,湖南 长沙 410004)
双子叶植物的木质素主要由愈创木基单体和紫丁香基木质素单体聚合形成,这两种单体的比例对造纸过程中木质素去除难易程度具有重要的影响。植物OMT基因家族的CCoAOMT和COMT基因是木质素合成途径的关键酶基因,可调控植物体内木质素单体的比例与含量。本文以所克隆的赤桉COMT、CCoAOMT1、CCoAOMT2三个基因的cDNA为模板,分别构建pET-32a的原核表达质粒,并优化在大肠杆菌BL21(λDE3)中的表达体系。结果显示,在加入0.4 mmol IPTG诱导表达后,COMT、CCoAOMT1、CCoAOMT2的原核表达质粒分别在4 h、2 h和3 h后达到可溶性重组蛋白表达峰值。通过渗透休克纯化方法,可在原核表达菌株的周质空间提纯CCoAOMT1和CCoAOMT2重组蛋白,在原核表达菌株的细胞质中可提纯COMT重组蛋白。
赤桉;木质素合成;OMT基因家族;原核表达
桉树是世界上最重要的制浆造纸原材料[1],在我国已有一百多年的历史,是我国南方热带、亚热带地区最为重要的速生人工造林树种,在我国造纸产业中有着极其重要的地位。近年来,桉树木材又被开发成生物柴油[2],使得桉树有成为新型生物质能源树种的巨大潜力。木质素是一种具有三维立体结构的天然高分子聚合物,广泛存在于高等植物的维管束中,是木质部细胞壁的主要成分之一[3]。在木材细胞壁中,木质素作为一种填充和粘合物质,以物理或化学的方式与纤维素和半纤维素相互之间紧密粘合在一起[4],而在制浆造纸工业中,需要将木质素从纤维素和半纤维素中去除,从而产生大量的造纸废液,严重污染环境。因此,去除木质素已成为制浆造纸工业污染的主要源头物质[5]。木质素含量降低除了能够减少造纸工业药品和能量的消耗,也能明显提高纸张的白度和颜色稳定性[6]。不同类型植物的木质素单体组成明显不同,裸子植物主要为愈创木基木质素(G木质素),双子叶植物主要含愈创木基-紫丁香基木质素(G-S木质素),单子叶植物则为愈创木基-紫丁香基-对-羟基苯基木质素(G-S-H木质素)[7]。木质素三种单体的比例对造纸过程中木质素去除难易程度和饲料中可消化性都具有重要影响[8]。
氧位-甲基转移酶基因家族(O-Methyltransferase, OMT)通常作用于植物体内木质素生物合成、类黄酮生物合成、生物碱生物合成等次生代谢途径中一些小分子的甲基化[9-10],而这种甲基化则决定了这些小分子在植物体内生理功能的特异性[11]。COMT(咖啡酰O-甲基转移酶)和CCoAOMT(咖啡酯乙酰辅酶A氧位-甲基转移酶)是OMT基因家族中控制植物次生细胞壁中的木质素含量和组分的关键基因,对木材结构和强度等特性有密切关系[12],能够控制木质素G、S、H三种单体的比例和含量[13],是决定木质素单体组分比例和木质素去除难易程度的关键基因[14]。通过在大肠杆菌等原核生物中表达目标基因的核苷酸序列片段,翻译合成异源目的蛋白,可以方便快捷地研究目标蛋白的功能特征和酶学特性[11]。本研究通过融合(硫氧化还原蛋白A,trxA)原核表达方式,对赤桉COMT、CCoAOMT1、CCoAOMT2三个基因进行高效表达与纯化,为进一步研究这三个蛋白的功能和酶学活性提供基础。
1 材料与方法
1.1 引物设计
根据已克隆的赤桉COMT基因(GU109375)、CCoAOMT1基 因 (GQ889423)、CCoAOMT2基因(GQ889422),设计带有酶切位点的PCR扩增引物,扩增目的基因的CDS(coding sequence)序列。在COMT基因扩增正向引物和反向引物分别引入EcoRI和HindⅢ酶切位点,CCoAOMT1和CCoAOMT2基因扩增正、反引物则分别引入EcoRI和XhoI酶切位点,用于插入至pET-32a原核表达载体中(表1,其中下划线表示酶切位点)。
1.2 原核表达载体的构建
用含有目的基因全长cDNA片段的三个质粒DNA为模板,进行目的基因CDS序列的PCR扩增。使用PCR引物(表1)和Takara Pyrobest酶进行扩增,PCR程序为:预变性(94℃/5 min);变性(94℃/40 s)、退火(45 s)、延伸(72℃/120 s),35个温度循环;总延伸(72℃/8 min)。COMT、CCoAOMT1、CCoAOMT2的退火温度分别为60℃、62℃、58℃。纯化回收目的产物,双酶切后,与经相同双酶切的载体pET-32a进行体外连接,连接产物转化至大肠杆菌DH5α,构建出最终的原核表达质粒。

表1 原核表达载体构建的引物Table 1 Primers used for prokaryotic expression vector
1.3 原核表达体系的优化
将三个表达质粒分别转化至大肠杆菌表达菌株BL21(λDE3),接入5 mL含Amp抗生素的LB培养基中,37℃震荡培养至OD600值达到0.4,再按1∶100比例稀释接种至新鲜的50 mL LB培养基,37℃震荡培养至OD600达0.6,加入100 mmol的IPTG贮藏液至终浓度为0.4 mmol,进行诱导培养。在加入ITPG后的2 h、3 h和4 h,分别取5 mL菌液离心收集菌体。用500 μL的PBS缓冲液重悬菌体进行超声波破碎,离心分离出的上清液即为菌体的可溶性蛋白质。
1.4 重组蛋白的纯化
(1)原核表达体系的放大培养。按照已优化的原核表达体系,放大成500 mL的培养体系,用于提取并纯化目的蛋白。为获得良好的通气,培养基体积不超过摇瓶容量的20%。
(2)渗透休克法提纯目的蛋白。将摇瓶置于冰上5分钟,于5 000 g条件下4℃离心5 min收集菌体。再用适量预冷(约100 mL)的高渗透压溶液(80%蔗糖,2.5 mmol EDTA,20 mmol Tris-HCl (pH 8.0))重悬菌体,使菌体浓度达到OD550值等于5单位/mL,冰浴静置10 min;于15 000 g条件下离心30秒,去除上清后再重悬于同体积的低渗透压溶液(2.5 mmol EDTA,20 mmol Tris-HCl (pH 8.0)),冰浴静置10 min;于15 000 g条件下4℃离心10 min,收集含有目的蛋白的上清液。
(3)从细胞质中提纯可溶性蛋白。将摇瓶置于冰上5 min,于5 000 g条件下4℃离心5 min收集菌体,重悬于100 mL PBS缓冲液中。使用超声波破碎仪在冰上破碎细胞,与14 000 g条件下4℃离心10 min,收集含有可溶性重组蛋白的上清液。
2 结果与分析
2.1 原核表达质粒的构建
赤桉COMT通过EcoRI/ HindⅢ双酶切,CCoAOMT1、CCoAOMT2通过EcoRI/ XhoI双酶切,分别将三个目的基因的CDS插入至pET-32a的多克隆位点中,实现与trxA基因的融合表达。pET32a-COMT原核表达质粒的EcoRI/ HindⅢ双酶切结果显示,有两条长度分别为1098 bp和5900 bp的条带,长度较小的条带与赤桉COMT的CDS序列大小一致;pET32a-CCoAOMT1、pET32a-CCoAOMT2原核表达质粒的EcoRI/ XhoI双酶切结果与预期一致,分别酶切产生5900 bp的载体片段,696 bp的CCoAOMT1的CDS片段,和741 bp的CCoAOMT2的CDS片段,表明三个目的基因CDS插入片段大小正确(图1)。将构建的表达质粒进行DNA双向测序,表明所获得的三个目的基因原核表达质粒序列未发生变化。
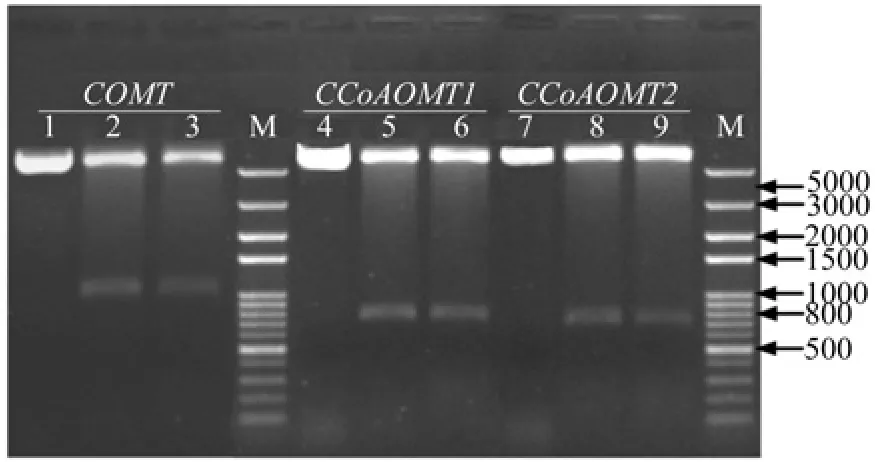
图1 三个重组表达质粒的双酶切鉴定Fig.1 Double digestion D pattern of three constructed expression plasmids
2.2 原核表达体系的优化
采用SDS-PAGE电泳方法,分析原核表达菌株在加入IPTG后不同诱导时间条件下的可溶性重组蛋白表达变化情况,分别优化这个三个原核表达体系。结果显示(图2),赤桉COMT蛋白与TrxA标签蛋白融合形成58.49 kDa的融合蛋白,产物符合预期大小,在加入IPTG诱导表达4 h后的可溶性COMT蛋白表达量最大;CCoAOMT1、CCoAOMT2的融合蛋白大小分别为44.57 kDa、46.34 kDa,分别在加入IPTG诱导表达2 h后、3 h后的可溶性蛋白表达量最大。
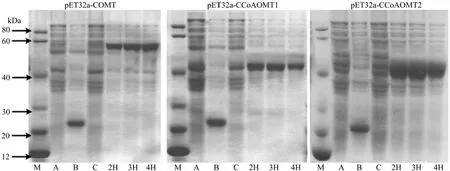
图2 大肠杆菌中不同时间诱导表达后的可溶性重组蛋白表达变化分析Fig.2 Analysis of recombinant soluble proteins expressed in proteins of E.coli by different induction time
2.3 重组蛋白表达产物的纯化
本文使用LaVallie报道[15]的渗透休克提取法,在4℃温度下将大肠杆菌先后悬浮于高渗透压与低渗透压的溶液中,利用渗透震荡作用(osmotic shock)可将细胞质中的可溶性TrxA-目的蛋白的重组融合蛋白释放细胞外,用于提纯目的蛋白。
Tricine-SDS-PAGE分析结构表明,对表达的赤桉COMT重组融合蛋白使用渗透休克作用后,只有少量的融合蛋白被释放到渗透休克组分中,绝大部分保留在细胞质可溶部分中,还有一部分融合蛋白以不溶解的包涵体形式存在于细胞质中;而赤桉CCoAOMT1和CCoAOMT2的重组融合蛋白则主要存在于渗透休克组分中(图3)。因此,赤桉COMT重组融合蛋白可在加入ITPG诱导4 h后直接从细胞质的可溶部分中提取,而赤桉CCoAOMT1和CCoAOMT2的重组融合蛋白可在加入ITPG诱导2 h后通过渗透休克作用进行提取。

图3 电泳分析目的蛋白的表达定位分析Fig.3 Tricine-SDS-PAGE analysis of target protein’s location in E.coli BL21(λDE3)
3 结论与讨论
不同物种的OMT基因家族成员差别较大,涉及到多个此生代谢物质合成途径[9]。OMT基因家族所属的甲基化酶超基因家族(包含OMT、SMT(S-methyltransferase)等多个基因家族)则更加复杂庞大,通过序列相似性法则归类各个成员之间的关系时,易发生与酶学特性的不一致[16-17],如通过序列比较认为是长春花OMT的一个基因,酶学实验则表明是SMT基因家族成员[17]。随着更多蛋白质的三维结构被测定,有利于从高级结构水平上理解蛋白质结构与其功能的关系。通过蛋白质结构模拟技术,可在三维结构水平上进行OMT家族成员的分类。在植物木质素合成途径中,OMT基因家族主要成员为COMT和CCoAOMT,作用于木质素合成途径中的底物包括:5-Hydroxy Coniferaldehyde(5-羟基松柏醛)、5-Hydroxyconiferyl Alcohol(5-羟基松柏醇)和Caffeoyl Coenzyme A(咖啡酯乙酰辅酶A)等[9,18]。本研究所克隆的赤桉CCoAOMT为2个成员的小型亚基因家族。
通过在大肠杆菌等原核生物中表达目的基因的重组蛋白质产物,是研究目标蛋白的功能特征和酶学特性的基础。本研究通过构建基于pET-32a的CCoAOMT1、CCoAOMT2、COMT的原核重组表达质粒,并实现了该三个重组质粒在大肠杆菌BL21(DE3)中的高效表达。通过分析大肠杆菌诱导表达蛋白组分和不同IPTG诱导时间对重组蛋白表达量的影响,表明赤桉CCoAOMT1和CCoAOMT2重组融合蛋白可在加入ITPG诱导2 h后通过渗透休克作用提取和纯化,而赤桉COMT重组融合蛋白可在加入ITPG诱导4 h后提取细胞质进行纯化,最后利用pET-32a上携带的硫氧化还原蛋白A标签,初步提纯了重组融合蛋白。本文结果为研究赤桉OMT基因家族中CCoAOMT和COMT的蛋白质底物催化活性提供了基础。
[1] 刘 果, 张党权, 谢耀坚, 等. 桉树Genomic-SSR和EST-SSR引物的快速筛选与通用性研究[J].林业科学,2013,(2):127-133.
[2] Tarabet, L., K. Loubar, M.S. Lounici, et al. Eucalyptus biodiesel as an alternative to diesel fuel: preparation and tests on DI diesel engine[J].Journal of biomedicine & biotechnology, 2012. 2012: 235485.
[3] Schuetz M, R Smith, B Ellis. Xylem tissue specification,patterning, and differentiation mechanisms[J]. J Exp Bot, 2013.64(1): 11-31.
[4] Li, X. and C. Chapple. Understanding Lignif i cation: Challenges Beyond Monolignol Biosynthesis[J]. Plant Physiology, 2011.154(5): 449-452.
[5] Baucher, M., C. Halpin, M. Petit-Conil, et al. Lignin:Genetic Engnieering and Impact on Pulping[J]. Critical Reviews in Biochemistry and Molecular Biology, 2003(38): 305-350.
[6] 张利萍, 高 慧, 牛 敏. 欧美杨107的制浆性能[J]. 经济林研究, 2009, 27(1): 80-84.
[7] Nunes C A, C F Lima, L C Barbosa, et al. Determination of Eucalyptus spp lignin S/G ratio: a comparison between methods[J]. Bioresour Technol, 2010. 101(11): 4056-61.
[8] 李潞滨, 刘 蕾, 何聪芬, 等. 木质素生物合成关键酶基因的研究进展[J]. 分子植物育种, 2007,(S1): 45-51.
[9] Lam K C, R K Ibrahim, B Behdad, et al. Structure, function,and evolution of plant O-methyltransferases[J]. Genome, 2007.50(11): 1001-1013.
[10] 郭 昭, 赵一玲, 刘景利, 等. 木质素合成酶咖啡酸3-O-甲基转移酶(COMT)的遗传调控研究[J]. 分子植物育种, 2006,(S2): 122-126.
[11] Bassard J E, L Richert, J Geerinck, et al. Protein-protein and protein-membrane associations in the lignin pathway[J]. Plant Cell, 2012. 24(11): 4465-82.
[12] Vanholme R, B Demedts, K Morreel, et al. Lignin biosynthesis and structure[J]. Plant Physiol, 2010. 153(3): 895-905.
[13] 谷振军, 张党权, 黄青云. 木质素合成关键酶基因与造纸植物转基因改良应用研究[J]. 中南林业科技大学学报, 2010,30(3): 67-74.
[14] Vanholme, R., V. Storme, B. Vanholme, et al. A systems biology view of responses to lignin biosynthesis perturbations in Arabidopsis[J]. Plant Cell, 2012. 24(9): 3506-29.
[15] LaVallie E R, E A DiBlasio, S Kovacic, et al. A Thioredoxin Gene Fusion Expression System That Circumvents Inclusion Body Formation in the E. coli Cytoplasm[J]. Nat Biotech, 1993.11(2): 187-193.
[16] Deavours, B., C.-J. Liu, M. Naoumkina, et al. Functional analysis of members of the isoflavone and isoflavanone O-methyltransferase enzyme families from the model legume Medicago truncatula[J]. Plant Molecular Biology, 2006. 62(4):715-733.
[17] Coiner, H., G. Schrder, E. Wehinger, et al. Methylation of sulfhydryl groups: a new function for a family of small molecule plant O-methyltransferases[J]. Plant Journal, 2006. 46(2): 193-205.
[18] Day, A., G. Neutelings, F. Nolin, et al. Caffeoyl coenzyme A O-methyltransferase down-regulation is associated with modifications in lignin and cell-wall architecture in flax secondary xylem[J]. Plant Physiology and Biochemistry, 2009.47(1): 9-19.
[19] 廖 立, 涂登云, 李重根, 等. 热处理对尾赤桉木材物理力学性能的影响[J]. 中南林业科技大学学报, 2013,33(5):128-131.
Prokaryotic expression and purif i cation of OMT family genes involved in lignin niosynthesis of Eucalyptus camaldulensis
GU Zhen-jun1,2, ZHANG Huai-yun2, ZHANG Dang-quan1,2, HE Han-jie2, CHEN Li-li2, PENG Kuan2, CHEN Rong1,2
(1. Key Laboratory of Cultivation and Protection for Non-Wood Forest Trees, Ministry of Education, Changsha 410004, Hunan, China;2. Hunan Provincial Key Laboratory of Forestry Biotechnology / Cooperative Innovation Center of Engineering and New Products for Developmental Biology of Hunan Province, Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
∶ In dicotyledons, the lignin polymer is constructed by the guaiacyl and syringyl units, and the ratio of this two units decide the wood characteristics and the pulping performance. The CCoAOMT and COMT gene of OMT gene family plays a key role in the lignin biosynthesis, with a function to determine the contents of lignin and the ratio of monolignol. In this study, three target cDNAs (COMT,CCoAOMT1, CCoAOMT2) of Eucalyptus camaldulensis were inserted into the prokaryotic expression vector pET-32a, and constructed plasmids were transformed into E. coli BL21 (λDE3). The expression condition was optimized. The analysis result showed that the optimal induction time after 0.4 mmol ITPG been added for COMT, CCoAOMT1 and CCoAOMT2 expression is 4 hours, 2 hours and 3 hours, respectively. The CCoAOMT1 and CCoAOMT2 recombinant protein can be purif i ed by the osmotic shock-mediated method, and soluble COMT recombinant protein can be purif i ed from the cytoplasm of E. coli..
∶ Eucalyptus camaldulensis; lignin biosynthesis; OMT gene family; Prokaryotic expression
S781.29
A
1673-923X(2014)06-0024-04
2014-01-14
湖南省研究生科技创新项目(CX2013B360);中南林业科技大学研究生科技创新项目(CX2013A02)
谷振军(1985-),男,湖南株洲人,博士研究生
张党权(1976-),男,江西抚州人,教授,博士,硕士生导师,研究方向为植物分子生物学与林产品加工利用;
E-mail:zhangdangquan@163.com
[本校编校:吴 彬]

