伯乐树SSR-PCR反应体系的优化
闫丽君,王红霞 ,黄芳芳,何长青,梁 艳,徐刚标
(1.中南林业科技大学 生命科学与技术学院,湖南 长沙 410004;2.国家林业局林产工业规划设计院,北京 100010)
伯乐树SSR-PCR反应体系的优化
闫丽君1,王红霞2,黄芳芳1,何长青1,梁 艳1,徐刚标1
(1.中南林业科技大学 生命科学与技术学院,湖南 长沙 410004;2.国家林业局林产工业规划设计院,北京 100010)
以伯乐树叶片为材料,利用单因素试验及正交试验对影响伯乐树SSR-PCR扩增的主要因素进行了优化。结果表明,伯乐树SSR-PCR最佳反应体系(20 µL)为:Mg2+1.25 mmol/L,dNTP 0.2 mmol/L,Taq DNA聚合酶0.5 U,引物0.3 µmol/L,DNA 90 ng。这为利用SSR标记进一步开展伯乐树种群遗传多样性研究奠定了前期实验基础。
伯乐树;SSR-PCR;体系优化
伯乐树Bretschneidera sinensis Hemsl.为伯乐树科伯乐树属落叶乔木,是我国特有的单科、单属、单种孑遗植物[1],零星间断分布于我国长江流域以南各省区[2-3]。伯乐树自然更新困难[4],人为干扰严重,现已处于濒危状态,已被列为国家一级重点保护植物[5]。
简单重复序列(Simple Sequence Repeat,SSR),又称微卫星DNA,是一类由几个(多为1-6个)碱基组成的基序串联重复而成的DNA序列,长度较短,200 bp左右,广泛分布于基因组的不同位置[6]。与其它的分子标记相比,SSR标记为共显性标记,具有分布广、多态性丰富、重复性好、可靠性高的独特优点,已被广泛应用于植物遗传连锁图谱构建、种质资源鉴定及遗传多样性分析[7]。
本研究拟采用单因素与正交试验相结合方法,对影响伯乐树SSR-PCR扩增的主要因素进行优化,旨在建立一套适合于伯乐树种群遗传多样性分析的SSR-PCR反应扩增体系。
1 方法与材料
1.1 材料
伯乐树叶片采自湖南阳明山国家级自然保护区。野外采集的叶片经硅胶干燥后,置于-70℃冰箱保存备用。SSR-PCR反应引物参考文献[8],由华大基因公司合成。根据预试验结果,选用引物Bl9(F: ACACACACACACAGAGAGAGAG;R:CAACCAAGGAAGCCATTACAAC)作为PCR扩增体系优化试验的固定引物。
1.2 方法
1.2.1 总DNA提取与检测
伯乐树总DNA提取,参考文献[9],0.8%琼脂糖凝胶电泳检测DNA质量,Eppendorf公司Bio Photometer核酸蛋白质分析仪测定浓度与纯度。提取的DNA稀释至60ng/µL,-20℃保存备用。
1.2.2 单因素试验设计
对影响SSR-PCR反应主要因素(Mg2+、dNTP、Taq DNA聚合酶、引物、模板DNA)进行单因素优化试验(表1)。当一种因素进行浓度(用量)梯度变化实验时,其它因素的浓度不变,比较不同浓度处理对SSR-PCR扩增结果的影响。
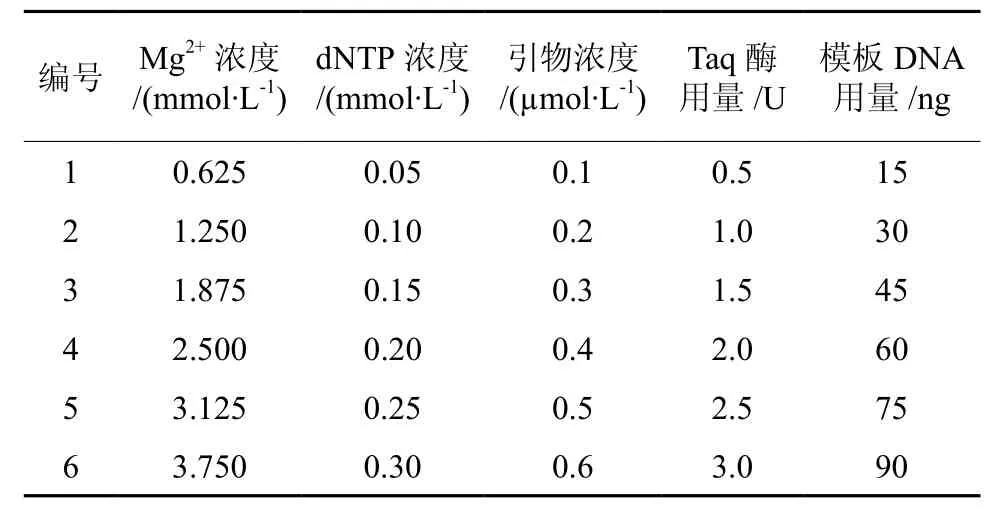
表1 SSR-PCR单因素试验设计Table1 Single factor experiments design for SSR-PCR
1.2.3 正交试验设计
根据单因素试验确定的各影响因素的浓度范围,设计5因素3水平正交试验设计(表2),以确定适合伯乐树SSR-PCR扩增的最佳反应体系。
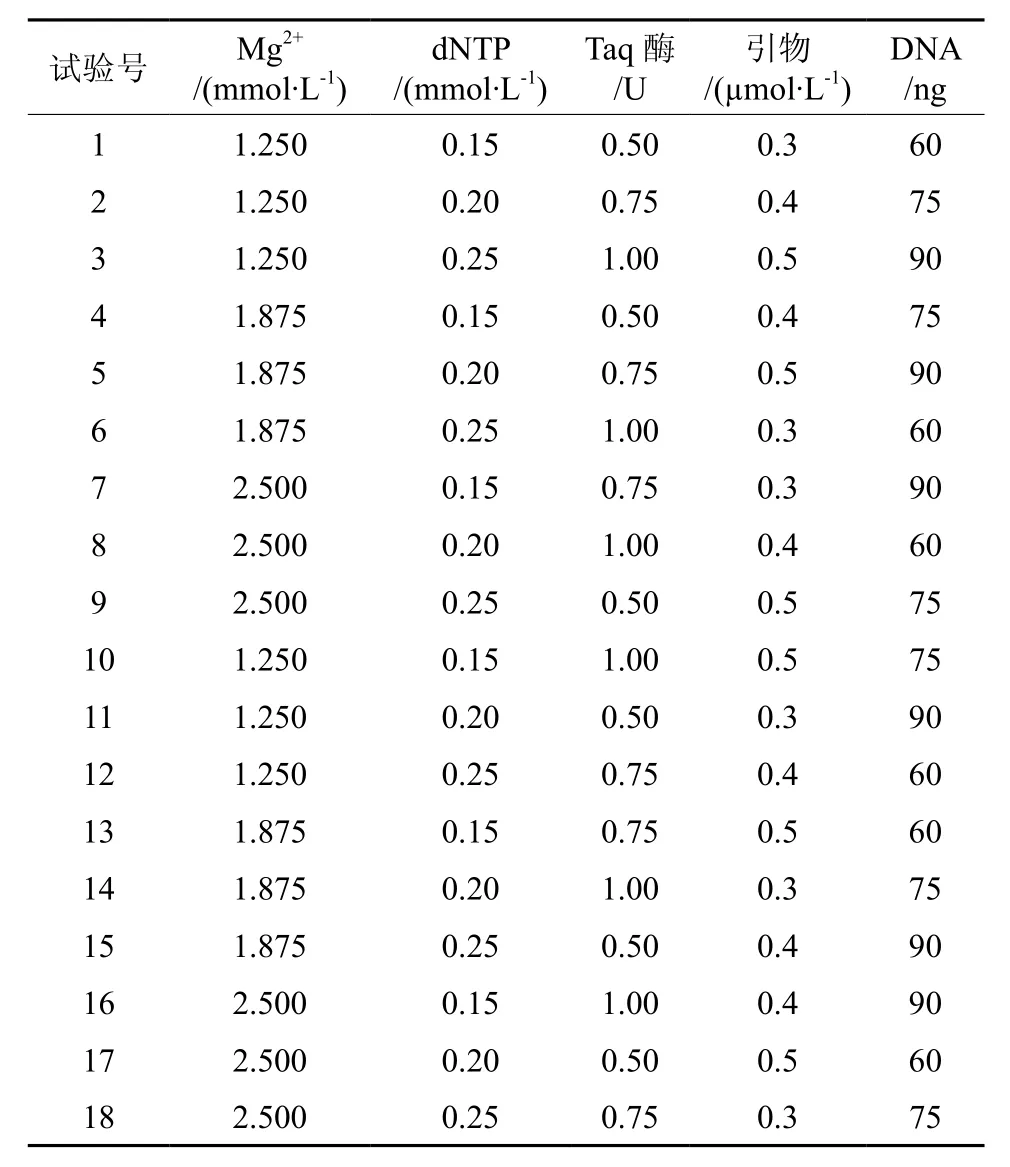
表2 SSR-PCR正交试验设计Table2 Orthogonal design for SSR-PCR
1.2.4 退火温度确定
在试验确定的最佳反应体系基础上,设置6个退火温度梯度(53℃、54℃、55℃、56℃、57℃、58℃)试验,以确定选用引物的最佳退火温度。
1.2.5 扩增产物检测
取扩增产物5 µl与等量上样缓冲液(98%去离子甲酰胺,10 mmol/L EDTA,0.25%溴酚蓝,0.25%二甲苯青)混匀,于95℃变性5 min后,置冰上冷却后,取3 µL上样,6%变性聚丙烯酰胺凝胶电泳,150 V恒压。当溴酚蓝指示剂距底部1 cm时,停止电泳,银染[10],用CanoScan LiDE 100型扫描仪扫描保存。
1.2.6 最佳反应体系验证
用优化的伯乐树SSR-PCR最佳反应体系对样本进行PCR扩增,验证其稳定性。
2 结果与分析
2.1 单因素试验
影响SSR-PCR反应5种主要因素6个不同浓度水平的扩增结果图1。由图1可知,Mg2+浓度梯度对SSR-PCR扩增产物影响显,随着Mg2+浓度增大,条带亮度由暗变亮再变暗。Mg2+浓度为0.625 mmol/L时,扩增条带不明显;浓度范围为1.25~2.5 mol/L,条带清晰明亮;浓度范围为3.125~3.75 mmol/L,条带模糊。6种dNTP浓度均可扩增出产物,但浓度不同,扩增条带的亮度差异明显。低浓度或高浓度条件下,扩增条带不清晰、模糊,当浓度为0.15 mmol/L时,条带最为清晰。不同引物浓度的扩增结果差异较小,引物浓度较低(0.1 µmol/L)时,扩增条带不清晰;引物浓度达0.2 µmol/L时,扩增条带的亮度不随引物浓度变化而变化。Taq DNA聚合酶为0.5 U时,扩增条带最为清晰;Taq DNA聚合酶用量大于0.5 U时,扩增条带有弥散现象出现。模板DNA用量对SSR-PCR扩增影响不明显,模板DNA用量为75 ng时,条带最清晰。
2.2 正交试验
正交试验结果见图2。由图2可知,第11组条带清晰明亮,稳定性好:由此确定伯乐树SSRPCR扩增最佳反应体系为。20 µL反应体系含有Mg2+1.25 mmol/L,dNTP 0.2 mmol/L,Taq DNA聚合酶0.5 U,引物0.3 µmol/L,DNA 90 ng。
2.3 退火温度
不同退火温度对SSR-PCR扩增影响结果(图3)表明,退火温度范围为53~55℃,电泳条带亮度相当;退火温度高于55℃时,PCR扩增的条带亮度减弱。因此,综合考虑选择55℃作为引物Bl9的最适退火温度。
2.4 最佳反应体系验证
利用最佳反应体系,对19份伯乐树样品进行SSR-PCR扩增的结果(图4)显示,所有样品扩增出的目的条带明亮清晰。这说明本研究筛选出的最佳反应体系扩增稳定,可用于进一步开展伯乐树SSR遗传多样性研究。
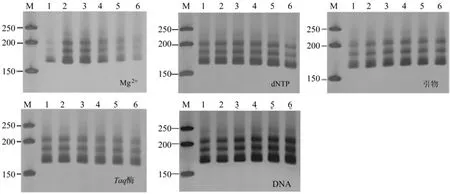
图1 各单因素对SSR-PCR扩增的影响Fig.1 Effects of each single factor on SSR-PCR
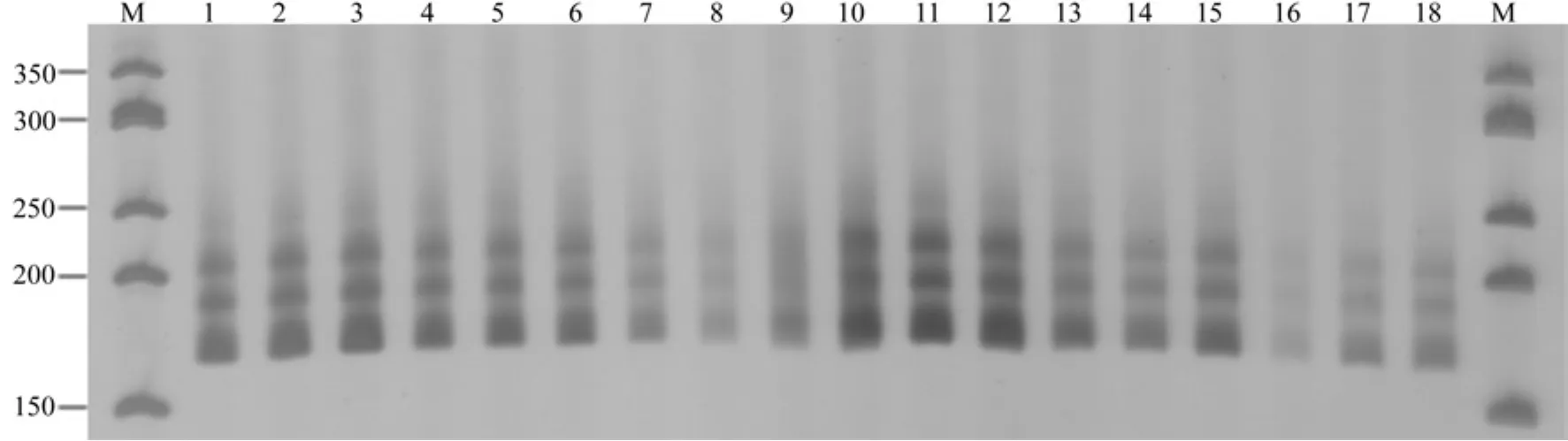
图2 伯乐树SSR-PCR正交试验电泳Fig.2 Electrophoretogram for SSR-PCR orthogonal design of B.sinensis
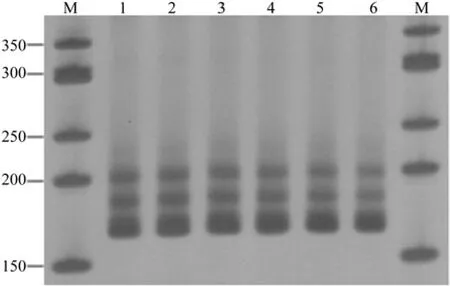
图3 退火温度对SSR-PCR的影响Fig.3 Effects of annealing temperature on SSR-PCR
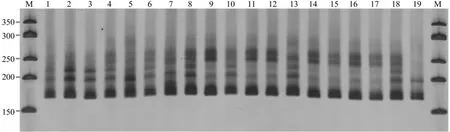
图4 最佳反应体系对19份伯乐树样品的SSR-PCR结果Fig.4 SSR-PCR results of 19 materials by the optimal reaction system
3 结 论
SSR-PCR反应体系涉及到Mg2+、dNTP、Taq DNA聚合酶、引物、模板DNA的浓度及退火温度等诸多影响因素,各种影响因素之间存在交互作用[11],本研究采用单因素试验与正交试验相结合对伯乐树SSR-PCR反应体系进行优化,建立了适合于伯乐树的最佳反应体系,这为进一步开展基于SSR标记的伯乐树遗传多样性研究奠定了基础。
[1] 吴征镒, 路安民, 汤彦承, 等. 中国被子植物科属综论[M].北京: 科学出版社, 2003: 702.
[2] 中科院植物研究所. 中国高等植物图鉴(第二册)[M]. 北京:科学出版社, 1980: 72.
[3] 傅书遐, 傅坤俊. 中国植物志[M]. 北京: 科学出版社, 1984,34: 8-10.
[4] 乔 琦, 秦新生, 邢福武, 等. 珍稀植物伯乐树一年生更新幼苗的死亡原因和保育策略[J]. 生态学报, 2011, 31(16): 4709-4716.
[5] 于永福. 国家重点保护野生植物名录(第一批)[J]. 植物杂志,1999, 5: 4-11.
[6] Litt M, Luty J A. A hypervariable microsatellite revealed by in vitro amplification of a dinucleotide repeat within the cardiac muscle actin gene[J]. American journal of human genetics, 1989,44(3): 397.
[7] 周延清, 杨清香, 张改娜. 生物遗传标记与应用[M]. 北京:化学工业出版社, 2008: 155-158.
[8] Guan B C, Song G R, Ge G. Sixteen microsatellite markers developed from Bretschneidera sinensis (Bretschneideraceae)[J].Conservation Genetics Resources, 2012, 4(3): 673-675.
[9] 梁 艳, 徐刚标, 张合平, 等. 南岭山地伯乐树天然种群和人工种群遗传多样性比较[J]. 林业科学, 2012, 48(12): 45-52.
[10] 文 浩, 艾 辛, 蒋建雄, 等. 采用SSR分子标记鉴定荻与南荻F1杂交种的真实性[J]. 草原与草坪, 2013, 33(4): 7-11.
[11] 许玉兰, 蔡年辉, 康向阳, 等. SSR-PCR反应体系建立与优化的研究概述[J]. 生物技术, 2012, 22(2): 73-76.
Optimization of SSR-PCR System for Bretschneidera sinensis
YAN Li-jun1, WANG Hong-xia2, HUANG Fang-fang1, HE Chang-qing1, LIANG Yan1, XU Gang-biao1
(1. School of Life Science and Technology, Central South University of Forestry and Technology, Changsha 410004; Hunan,China; 2. Planning and Design Institute of Forest Products Industry, Beijing 100010, China)
The main factors affecting SSR-PCR system of Bretschneidera sinensis were optimized through single factor experiments and orthogonal design with the leaves of B. sinensis. An optimal SSR-PCR system for B. sinensis was established, containing 1.25 mmol/L Mg2+, 0.2 mmol/L dNTP, 0.5 U Taq DNA polymerase, 0.3 µmol/L primers, 90 ng DNA template. This SSR-PCR system lays a foundation for SSR analysis in B. sinensis.
Bretschneidera sinensis; SSR-PCR; reaction system optimization
S718.46
A
1673-923X(2014)12-0083-04
2014-05-13
国家林业公益性行业科研专项(201104033);十二五国家科技支撑计划(2012BAC01B07-2)
闫丽君(1989-),女,河南卫辉人,硕士研究生,主要从事植物分子群体遗传学研究
徐刚标(1965-),男,安徽枞阳人,教授,主要从事植物种群遗传与林木遗传改良研究;E-mail:gangbiaoxu@163.com
[本文编校:吴 彬]

