细胞骨架观察实验的改进
王宏刚,陈成彬,王春国,陈 力,宋文芹,白艳玲,张金红,刘 方
(南开大学 生物实验教学中心,天津 300071)
细胞骨架是指存在于真核细胞中的蛋白纤维网络结构,主要包括微管、微丝以及中间纤维三类蛋白[1]。细胞骨架不仅在维持细胞形态,承受外力、保持细胞内部结构的有序性方面起重要作用,而且还参与许多重要的生命活动[2-3]。细胞骨架的重要作用使其已经成为细胞生物学乃至生命科学、医学等诸多领域的研究热点,也成为生命科学类专业学生所必须掌握的重要知识点。多年来,为了让学生更好地掌握细胞骨架的相关知识及对细胞骨架进行研究的方法,各个高校都付出了艰辛的努力,进行了大量的探索[4]。
目前,在本科生的基础实验教学中,细胞骨架的观察经常采用的是考马斯亮蓝染色法,该方法多采用植物细胞作为实验材料,取材方便,操作简单,但也存在诸多缺陷。首先,考马斯亮蓝并不是细胞骨架蛋白的特异性染色剂,而是利用Triton X-100处理细胞后可以保留细胞骨架蛋白而去除其他蛋白的特性来对细胞骨架蛋白进行染色。因此,考马斯亮蓝染色法不能够对特异性地区分细胞骨架的具体组分。其次,Triton X-100处理后如有其他蛋白质残留就会对实验结果造成影响。因此,我们决定对其进行改进,采用间接免疫荧光法特异地显示微管,采用甲基罗丹明-鬼笔环肽荧光标记法特异地显示微丝,并针对学生基础实验教学的特点设计了教学方案[5-7]。
1 实验材料和试剂
材料:仓鼠卵巢CHO细胞(以下简称CHO)系、人胚肾T细胞293T细胞(以下得称293T)系、人宫颈癌细胞HeLa细胞(以下简称HeLa)系。
试剂:1640培养基、小牛血清、0.25%胰蛋白酶、双抗、PBS缓冲液(以下简称PBS)、2%BSA (PBS缓冲液配制)、4%多聚甲醛、甲醇、0.1%TritonX-100(PBS缓冲液配制)、小鼠抗人tubulin的单克隆抗体、FITC标记的山羊抗小鼠的荧光二抗、甲基罗丹明-鬼笔环肽、防荧光淬灭封片剂(含DAPI)。
2 实验方法
2.1 间接免疫荧光标记法显示微管
在3.5cm培养皿中放入无菌的盖玻片,加入细胞(本文为CHO)培养至融合度为80%;吸去培养基,加入37℃预温的PBS洗涤3次,每次5min;吸去PBS,加入预冷的甲醇固定15min;吸去甲醇,PBS洗涤3次,每次5min;吸去PBS,用滤纸轻轻吸去片子上的液体,滴加20μL、2%BSA封闭液,盖上培养皿盖,室温下封闭15min;吸去封闭液,滴加20μL、1∶200稀释的小鼠抗人tubulin的单克隆抗体,盖上封口膜和培养皿盖,37℃孵育20min;用PBS洗涤3次,每次5 min;用滤纸小心吸去片子上的液体,滴加20μL、1∶500稀释的FITC标记的山羊抗小鼠荧光二抗,盖上封口膜和培养皿盖,37℃孵育20min;PBS洗涤3次,每次5min;孵育结束后用蒸馏水洗涤片刻,将盖片风干;在干净载玻片上滴加3μL含有DAPI的防荧光淬灭剂,将长有细胞的盖玻片从培养皿中取出,反扣于淬灭剂上;使用荧光显微镜观察,并用冷CCD拍照。
2.2 鬼笔环肽荧光标记法显示微丝
细胞(293T和HeLa)培养方法同2.1节,当细胞融合度为80%时加入37℃预温的PBS洗涤3次,每次5min;吸去PBS,加入4%多聚甲醛溶液固定15 min;吸去多聚甲醛,加入用37℃预温的0.1%TritonX-100处理5min;PBS洗涤3次,每次5min;吸去PBS,用滤纸轻轻吸去片子上的液体,滴加20μL、2%BSA封闭液,盖上盖,室温下封闭15min;吸去封闭液,PBS洗涤3次,每次5min;滴加10μL、1∶30稀释的甲基罗丹明-鬼笔环肽,盖上封口膜,放入湿盒中,室温染色15min;PBS洗涤3次,每次5min;用蒸馏水冲洗片刻,在洁净载玻片上滴加3μL含有DAPI的防荧光淬灭剂,将盖玻片从培养皿中取出,反扣于淬灭剂上;在荧光显微镜下观察,并用冷CCD拍照。
3 实验结果
3.1 间接免疫荧光标记法显示微管
在荧光显微镜下,DAPI染色后CHO细胞核经紫外线激发而发出蓝色荧光,FITC标记的微管经蓝光激发后发出绿色荧光,见图1和图2。
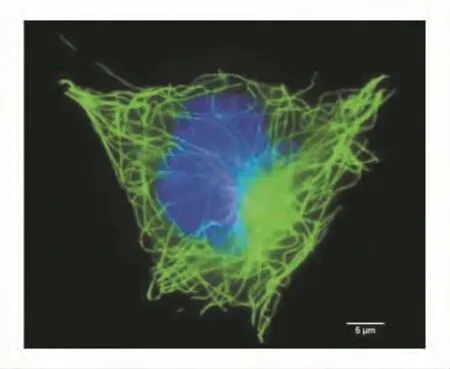
图1 CHO细胞中的微管(100×,示间期)
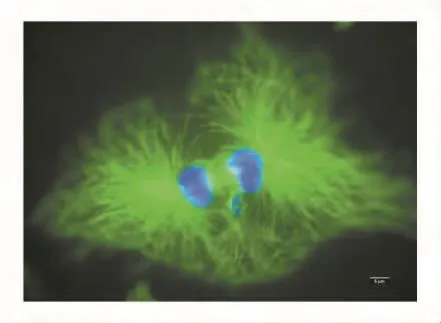
图2 CHO细胞中的微管(100×,示有丝分裂后期)
3.2 甲基罗丹明-鬼笔环肽荧光标记法显示微丝
在荧光显微镜下,DAPI染色后的293T和HeLa细胞核经紫外线激发发出蓝色荧光,甲基罗丹明-鬼笔环肽标记的微丝经绿光激发后发出红色荧光,见图3和图4。
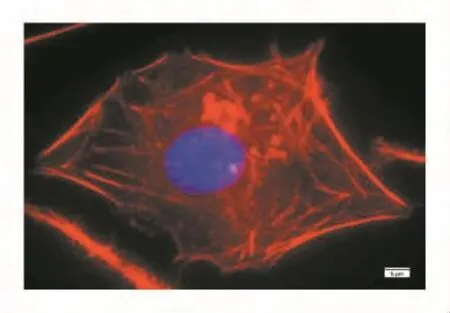
图3 293T细胞中的微丝(100×)
4 讨论
4.1 实验材料的选择
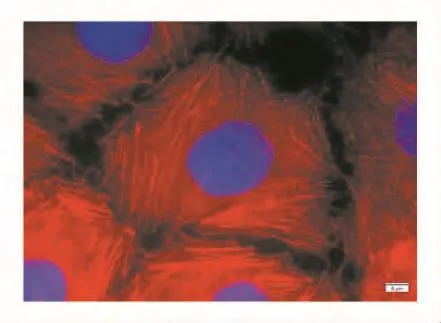
图4 HeLa细胞中的微丝(100×)
该实验中,在选择细胞时应考虑:(1)应尽量选用贴壁生长的细胞株系,这样可以简化实验步骤,节省实验所需的时间;(2)应尽量选用贴壁牢固的细胞株系,以防学生在操作时应动作不够轻柔而造成细胞的丢失;(3)应尽量选用体积较大、铺展较好的细胞株系,以便在观察时得到较好的效果。
4.2 教学的组织
本科生基础实验课最大的特点是课时相对固定,要求学生在一次实验课(约4~5学时)中完成一个相对完整的实验内容。我们通过大量的预实验,对细胞固定的时间、抗体孵育的时间、PBS洗涤的时间及次数等实验环节进行了优化,以保证大部分学生可以在约3个半小时内完成整个实验。在教学实践中,也可以根据自身的实际情况对这些环节进行优化,以保证在不影响授课效果的前提下用合适的时间来完成实验教学。实验内容方面也可以根据实际情况进行调整。例如只安排微管与微丝中一种细胞骨架组分的观察就可以保证学生在较短的时间内在视觉上对细胞骨架形成有一定程度的认识。
5 结束语
基础实验教学是生命科学类专业本科生培养过程中最重要的环节之一。在基础实验教学的过程中,不但要让学生通过亲自动手操作来进一步掌握在理论课上学到的基础知识,更要训练学生的基本实验技能与操作,提高学生的动手能力和思维能力[8-10]。细胞骨架的观察是一个很经典、很重要的实验。这次探索希望能提高学生的学习兴趣,帮助其加深对细胞骨架组分中微管、微丝的认识。更重要的是,能帮助学生掌握间接免疫荧光和荧光标记染色的实验方法,提高学生的科研能力,为学生将来的发展奠定扎实的基础[11-13]。
(
)
[1]翟中和,王喜忠,丁明孝,等.细胞生物学[M].4版.北京:高等教育出版社,2011.
[2]谢朝辉,陈兰英.细胞骨架研究进展[J].癌变·畸变·突变,2011,23(4):315-318.
[3]张鹏,张旭.以细胞骨架为靶点抗癌药物的研究进展[J].解放军医学院学报,2013,34(6):661-669.
[4]何大澄.对细胞骨架教学的体会[J].中国细胞生物学学报,2012,34(5):475-476.
[5]罗果,保玉心,李晋.不同固定液对细胞骨架荧光染色标记效果的影响[J].第三军医大学学报,2011,33(7):753-755.
[6]张维,蓦爱荣,高翔,等.细胞骨架染色中不同固定方法的探讨[J].中国细胞生物学学报,2010,32(1):149-153.
[7]闫晓梅,王莲芸,秦敏君,等.细胞骨架形态观察新实验的设计和教学实践初探[J].中国大学教学,2010(8):81-82,48.
[8]王源远,王丽萍.高校实践教学的理论认识与实践探索[J].实验技术与管理,2013,30(1):11-14.
[9]许国安.构建基础实验训练平台,培育创新型人才[J].实验技术与管理,2009,26(12):18-21.
[10]李兵,李鸿飞,刘中来,等.生物学研究创新型实验的探索与实践[J].实验技术与管理,2012,29(3):27-29.
[11]薛雅蓉,庄重,康铁宝.构建三级细胞生物学实验教学体系的实践[J].高等理科教育,2013(2):90-94.
[12]胡鑫,高梅,李绍军,等.细胞生物学实验教学改革探索[J].中国细胞生物学学报,2013,35(1):110-114.
[13]张伟.细胞生物学实验教学中学生科研能力培养的措施研究[J].高等理科教育,2012(1):130-133,162.

