基于RNA-Seq的油茶种子油脂合成过程磷脂酰肌醇信号系统的基因分析
江 南 , 谭晓风 , 张 琳
(1.中南林业科技大学 经济林培育与保护教育部重点实验室 经济林育种与栽培国家林业局重点实验室,湖南长沙 410004;2.湖南工业大学 包装与材料工程学院,湖南 株洲 412008)
磷脂酰肌醇(phosphatidyldinositol,PI)信号系统广泛存在于生物体中,是与生物体内Ca2+子信号途径密切相关的一个信号网络,既能够影响基因表达,又参与细胞对外界环境变化的响应[1]。所有生物都需要对它们赖以生存的外界环境中各种环境因子做出响应而适应环境得以生存,当外界环境发生改变时,胞外信号需要通过第二信使系统将信号传递到胞内,从而引起细胞的相应生理生化反应,达到调节生物体的生理功能适应环境生存的目的[2]。磷脂酰肌醇及其各种衍生物具有相应的信号传递功能[1]。目前磷脂酰肌醇及其相关衍生物在动物及人体中的机能已有较为深入详细的研究,对动物磷脂酰信号传递途径(PI途径)已经建立了一个较为完整的模型。研究表明,动物细胞中的PI途径对细胞间信号运输、转录调控细胞功能、离子通道开闭和能量代谢都具有重要的作用[3-4]。植物中PI途径的研究近年来也取得了一些进展,有研究表明,植物PI途径与许多植物生理反应关联,例如渗透压调节和植物防御反应[5-6],Perera和Fallon等重力刺激玉米实验[7-8]和红光处理小麦黄化苗原生质体实验[9],证明了植物中三磷酸肌醇(IP3)信号被关联到植物体中多个发育和生理途径中。植物PI途径中相关的基因PIS(磷脂酰肌醇合成酶基因)、PI4K(磷脂酰肌醇-4-激酶基因)、PIPK (二磷脂酰肌醇激酶基因)、PLC(磷脂酶 C 基因)、PLD(磷脂酶 D 基因)和5PTase(多磷酸肌醇-5-磷酸酶基因)等已经被分离出来并进行了功能的研究[6,10-11]。
油茶(Camellia oleifera)是世界四大木本油料树种之一,适应性广,耐干旱、耐霜冻、耐贫瘠土壤。其成熟种子所含油脂——茶油是一种优质保健的食用油,其色纯味香,富含油酸和亚油酸,不饱和脂肪酸质量分数高达85%~90%。茶油的营养价值、保健价值可与目前风糜欧美的橄榄油相媲美,是名副其实的绿色食用植物油。油茶遗传基础复杂,基因组庞大,近年来我国科研工作者对油茶分子研究主要集中在油脂合成过程基因调控方面,而油茶对环境因素响应的分子机理研究甚少,油茶PI途径的研究的未见报道。作者所在实验室对油茶信号传导和逆境胁迫应答进行了初步研究,主要以实验室构建的油茶cDNA文库和EST文库为材料,从油茶近成熟种子中分离克隆了油茶钙调素基因 (Calm)、油茶亲环素基因 (Cyc)、油茶酪氨酸蛋白磷酸酶基因(PTPase)、油茶热激蛋白质基因(HSP)和油茶水通道蛋白质基因(Aquaporin)等相关的基因[12-13]。同时在油茶种子的转录组研究中发现,油茶种子油脂合成过程存在PI信号系统。作者在油茶种子转录组和不同时期表达谱数据分析的基础上,对油茶种子PI信号系统关键基因的表达进行系统分析,以期为相关基因的分离克隆、油茶品种的遗传改良提供科学依据。
1 材料与方法
1.1 试验材料
国家审定油茶品种‘华硕’的膨大期果实和同年油脂合成高峰期果实,采自中南林业科技大学油茶种质资源圃;果实采摘后需立即剥取种仁,锡箔纸包好放入液氮保存,回实验室后种仁置于-80℃超低温冰箱中保存。
1.2 试验方法
1.2.1 油茶种仁总RNA提取及质量检测 在液氮中研磨‘华硕’果实膨大期和油脂合成高峰期种仁至均匀粉末,用Invitrogen公司总RNA提取试剂盒分别提取不同时期种仁总RNA。电泳检测RNA的完整性,核酸/蛋白质定量分光光度计测定RNA浓度;取完整性好(28S∶18S 大致为 2∶1)、OD260/280值在1.9至2.2之间,样品质量浓度≥200 ng/μL的RNA样品,-80℃保存备用测序。
1.2.2 油茶种子转录组数据库构建 分别取以上两个时期RNA等比例混合至总量为1 mg左右的混合样品,干冰保存送至华大基因公司采用Illumina技术进行转录组测序,组装软件SOAP denovo处理后获得非冗余Unigene序列,构建了油茶种子油脂合成调控过程中的转录组数据库。以Nr、SwissProt、KEGG和 COG等数据库为参考,完成油茶种子转录组Unigene序列基因注释,取evalue<0.000 01的 Unigene视为已知基因[14]。
1.2.3 油茶种子表达谱数据库构建 将上述两个不同时期的RNA样品各1mg左右分别用干冰保存,送至深圳华大基因公司采用Solexa技术进行数字化表达谱测序。构建油茶种子不同时期的表达谱数据库,并以已有的转录组数据库为参考,对整理和去杂后的表达谱数据库Unigene序列进行基因注释。
1.2.4 生物信息学分析 从华大基因公司下载油茶种子转录组数据和表达谱测序数据,按转录组数据中Pathway显著富集对数据库中的Unigenes按基因功能进行分类,综合分析油茶种子油脂形成过程中各代谢通路关键酶基因的调控位点、不同时期的表达差异,并推测其在油茶种子发育过程中的功能及与油茶油脂合成的关系。
2 结果与讨论
2.1 油茶种子油脂合成过程中转录组和不同时期表达谱的基本信息
油茶果实膨大期和油脂合成高峰期RNA混合样品进行Illumina双末端测序(PE)及数据处理后最终获得了69 798个非冗余Unigene片段。将油茶种子转录组非冗余Unigene序列比对到Swissport、Kegg、COG、Gene Ontology(GO)等数据库,共有18 714条Unigene获得基因注释,归并为124个代谢途径,其中涉及PI号系统的Unigenes序列共212条,占全部注释基因的1.13%。采用Solexa单端测序(SE),分别获得油茶果实膨大期和油脂合成高峰期表达谱数据库,对数据库进行整理和去杂后,得到高质量测序标签(Clean Tags);大部分数据能够通过前期构建的油茶种子转录组数据库得到注释。为了方便分析两个时期基因表达差异,表达谱中Unigene的表达量取标准化基因表达量TPM(Transcript Per Million clean tags)值,可直接用于比较不同样品间的相应基因表达差异[15],取FDR(false discovery rate)≤0.001来最终决定差异检验的P值的阈值。本研究中,以FDR≤0.001且存在2倍以上表达差异作为判断基因表达差异显著的标准。
2.2 油茶种子油脂合成过程中磷脂酰肌醇信号系统及其相关基因
油茶种子果实膨大期和油脂合成高峰期的转录组数据几乎包含了与油茶油脂合成相关的所有基因的mRNA信息。转录组中Unigenes序列的基因注释信息确定了油茶种子发育过程中相关基因参与的生理过程、调控位点及表达状况。从油茶种子转录组数据分析可知,PI信号系统Unigene序列共212条,综合分析各Unigene序列的NR、Swissport、Pathway、COG和Gene Ontology(GO)基因注释信息,并对Unigene序列按功能进行分类,可以确定212条Unigene序列编码调控油茶种子磷脂酰肌醇信号系统的关键酶有12种,分属于12种基因,分别为:磷脂酰肌醇4-激酶(PI4K);磷脂酰肌醇3-激酶 (PI3K); 磷脂酰肌醇-3,4,5-三磷酸-3-磷酸酶(PTEN);磷脂酰肌醇合成酶(PIS);磷脂酰肌醇(3)4-磷酸-5-激酶(PIP5K);磷脂酶 C(PLC)、肌醇-三磷酸-激酶(ITPK);肌醇单磷酸酶(IMP);3'(2'),5'-二磷酸-核苷酶;二酰基甘油激酶(DGK);磷脂酸胞苷酰转移酶;钙调蛋白质(Calm)等基因。其中PLC、ITPK、PIP5K、DGK等表现出多基因家族特征。12种基因的油茶种子转录组数据库基本信息见表1。可看出,油茶种子PI信号传递过程关键基因中,ITPK基因在油茶种子发育过程中表达量最大,RPKM(Reads Per Kilobases per Millionreads) 值 最 大 达162.373 5,其次是Calm,RPKM最高值达156.316 9,1-磷脂酰肌醇4-磷酸5-激酶基因表达量最低,RPKM 仅为 7.955 2~35.400 2。
2.3 油茶种子磷脂酰肌醇信号系统关键酶功能基因不同时期的表达
PI信号系统在生物的发育过程和细胞对环境的响应过程中都起着重要的作用,分析油茶种子磷脂酰肌醇信号系统的基因,特别是关键基因的表达模式,有助于探索其功能。油茶种子果实膨大期和油脂合成高峰期数字化表达谱数据库分析显示,油茶种子磷脂酰肌醇信号系统12种关键基因,在油茶种子不同的发育时期都具有表达特异性。各基因不同时期表达详情见表2。
表2数据分析显示,磷脂酰肌醇4-激酶(PI4K)、磷脂酰肌醇(3)4-磷酸-5-激酶(PIP5K)、肌醇-三磷酸-激酶(ITPK)和钙调蛋白质(Calm)等基因FDR≤0.001且存在2倍以上表达差异,属于油茶种子发育过程中磷脂酰信号系统果实膨大期和油脂合成高峰期表达差异显著基因,其中Calm基因在果实膨大期几乎无表达,油脂合成高峰期表达量比果实膨大期上调11倍,和PIP5K、ITPK等同属于表达明显上调基因,PI4K相对于果实膨大期,油脂合成高峰期表达明显下调。磷脂酰肌醇3-激酶(PI3K)、磷脂酶 C(PLC)、肌醇单磷酸酶(IMP),以及3'(2'),5'-二磷酸-核苷酶等基因,虽然油脂合成高峰期基因表达上调,但上调幅度不大;磷脂酰肌醇合成酶(PIS)、二酰基甘油激酶(DGK)、磷脂酸胞苷酰转移酶等基因油脂合成高峰期表达下调,下调幅度也不大。这些基因的表达方式不能归为有显著变化的基因表达模式。磷脂酰肌醇-3,4,5-三磷酸-3-磷酸酶(PTEN)基因在不同时期表达无明显变化。
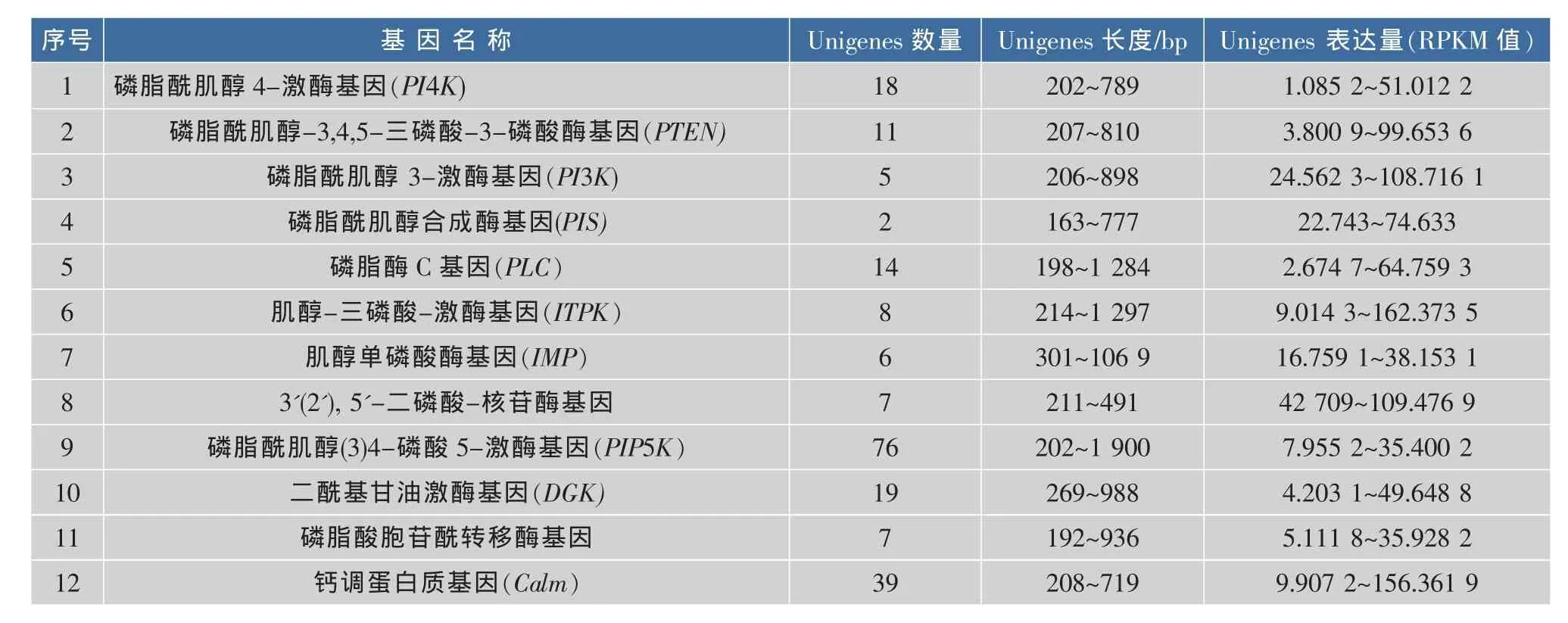
表1 油茶种子磷脂酰肌醇信号系统主要表达基因Table 1 Unigenes and related enzyme functional genes regulating Phosphatidylinositol signaling system in transcriptome of Camellia oleifera seeds
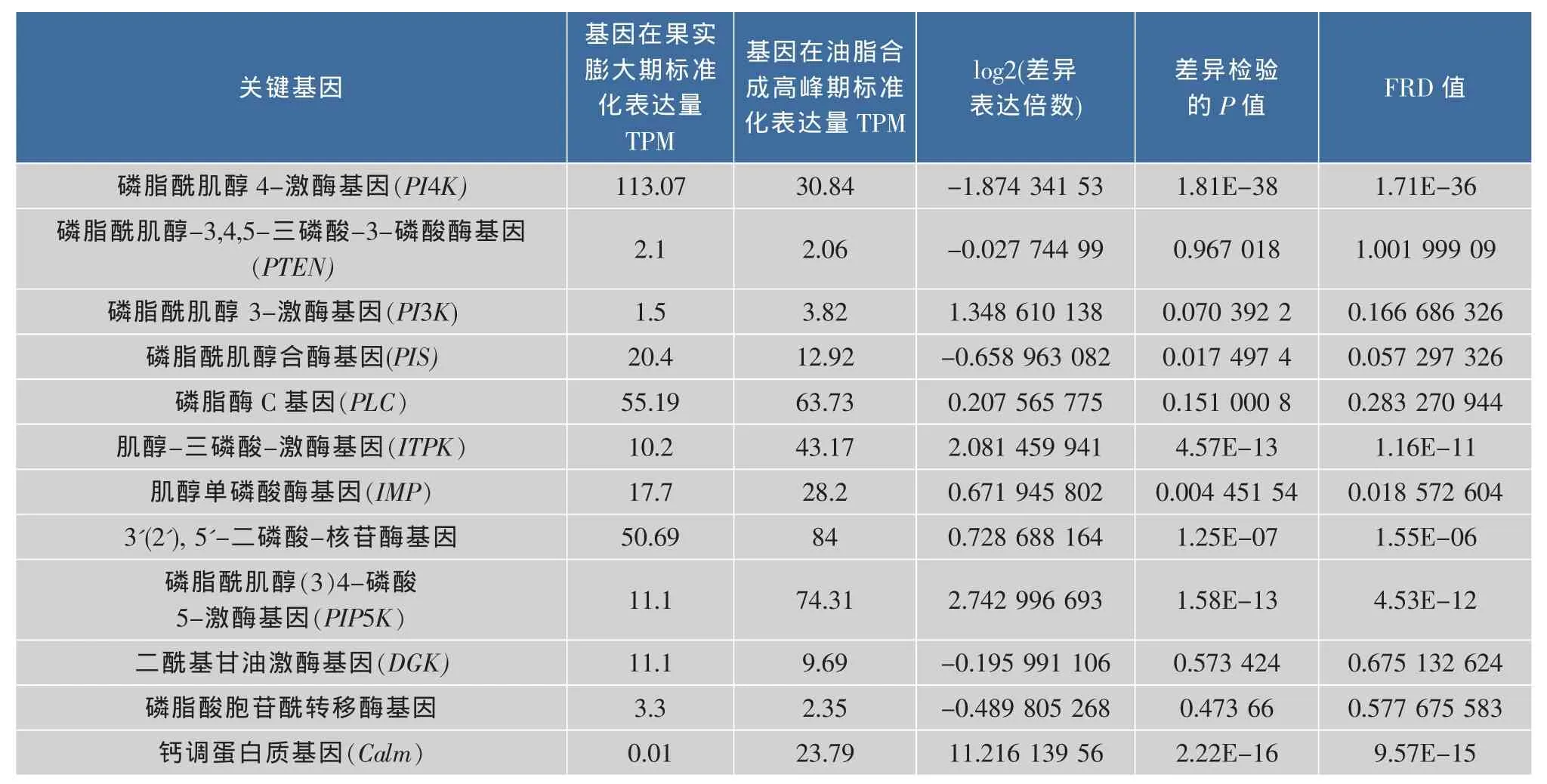
表2 油茶种子PI信号系统关键基因不同时期表达差异分析Table 2 Expression difference analysis of key genes in PI signaling system of Camellia oleifera seeds with different stages and the peak stage
结合已有植物PI信号途径研究,从基因功能分析,PI4K、PI3K和PIP5K是PI途径中调控磷脂酰肌醇磷酸化的关键基因,其作用底物的磷酸化位点各不相同,PI4K、PI3K分别将PI在4位上和3位上磷酸化产生PI4P和PI3P,进一步在PIP5K的调控下形成磷脂酰肌醇-(3)4、5-二磷酸 (PtdIns(3/4,5)P2)。 PtdIns (4,5)P2是生物细胞内重要的磷酯衍生物,能被PLC催化形成细胞内两种重要的第二信使分子,水溶性三磷酸肌醇(IP3)和脂溶性二酰基甘油(DG), 能够启动和激活细胞内的钙信号途径[1,16],Ca2+能充当中间媒介介导细胞的多种反应过程,通过与细胞内多种酶或蛋自质结合调节细胞多种重要生理功能,其中Calm是细胞内主要Ca2+受体[20],研究表明Calm参与了多种生理活动的调节,如植物对环境刺激的应答所表现的抗性,推测油茶的抗干旱、抗霜冻的特性与油茶Calm基因的表达相关。
在拟南芥、水稻等模式植物中,PI4K和PIP5K表达模式和调控植物的发育过程和信号响应等功能已有详细研究[17-18]。ITPK可调控肌醇-三-磷酸(IP3)磷酸化成四磷酸肌醇(IP4)[21],四磷酸肌醇可以使细胞外Ca2+内流而升高胞内Ca2+浓度,调节细胞生理生化过程[22]。有报道表明,PI3K不但具有肌醇磷脂激酶活性,而且还具有蛋白激酶的活性,在细胞增殖、迁移和分泌等生物作用中起重要的作用[19]。很明显 ITPK、PI4K、PI3K、PIP5K 和 PLC 等基因是调控油茶种子IP信号系统上游信号转导的关键基因。在油茶种子发育过程中,PI3K表达平稳且不同时期表达量不大,PI4K基因尽管在油脂合成高峰期表达明显下调,但其在油茶种子发育不同时期始终高丰度表达,PLC和PIP5K基因果实膨大期表达量较大且随着油茶种子发育成熟表达上调,显示与PI4K基因表达协同一致。与此相对应,Calm基因和ITPK基因表达模式应与PIP5K或PLC一致,这由表2数据可得到充分证明。Gillaspy等研究表明,以上过程形成的不同种类的磷脂酰肌醇-多磷酸可以作为植物体内重要的信号分子参与调控植物不同的生理活动。从油茶种子果实膨大期(6月)到油脂合成高峰期(8、9月),油茶种子油脂积累处于逐渐上升趋势。油茶种子发育过程中油脂成功积累过程需要植物细胞内各生理过程协调作用,PI信号系统上游反应过程中各基因的表达促使形成不同种类的磷脂酰肌醇-多磷酸,作为植物体内重要的信号分子可以参与调控油茶种子发育和环境应答过程中各种生理活动,从而推动油脂积累过程顺利进行,因此油茶种子PI信号系统上游反应过程中关键基因的表达上调或高丰度表达与油茶油脂的积累呈正相关。
磷脂酰肌醇-多磷酸在不同的磷酸酶的作用下还可以去磷酸化,以实现不同种类磷脂酰肌醇-多磷酸之间的转化和含量的控制[23],或最终将磷脂酰肌醇-多磷酸去磷酸化重新生成自由肌醇[24]。与此同时IP信号系统第二信使分子DG在IP信号系统下游反应过程中还可被DGK和磷脂酸胞苷酰转移酶调控形成CDP-二酰基甘油(CDP-DG),和磷脂酰肌醇-多磷酸去磷酸化生成的自由肌醇在PIS调控下可重新合成磷脂酰肌醇,参与下一轮信号传导过程[25]。
从表2数据分析可发现,油茶种子PI途径中含PTEN和IMP两种磷酸酶基因、DGK基因和PIS基因,且各基因在油茶种子发育过程不同时期表达稳定,可推测油茶种子发育过程PI信号系统下游反应过程中存在磷脂酰肌醇再生循环利用过程,这一生理过程保证了PI信号系统的最初底物供应,为油茶种子正常发育和油脂的积累提供了保障。
目前PTEN、IMP和PIS在拟南芥中均发现多种基因,各基因均表现不同的生理功能[17]。DGK在多种动植物中均已有研究,且表现为多基因特征,例如拟南芥基因组中有7个,哺乳动物有9个[26]。油茶种子转录组数据分析发现,油茶种子DGK基因也表现出多基因家族特征。
3 结语
高通量测序技术获得油茶种子转录组和果实膨大期及油脂合成高峰期表达谱数据库,为油茶的分子生物学研究提供了数字化信息平台。要想获得其中的信息,需要进行大量的分析、试验验证工作。生物体内PI信号途径既能调控生物细胞基因表达,又能调控生物体对环境因素的响应,对生物的生存十分重要。目前植物PI信号途径研究报道不多,油茶种子转录组数据库和表达谱数据分析发现,油茶种子油脂积累过程中存在PI信号途径,且PI途径中关键基因在油茶果实膨大期和油脂合成高峰期存在不同表达模式。从整体上看,油茶种子PI信号途径各基因的表达协调进行,这有助于油茶种子发育过程油脂的平稳积累,但各环节的基因调控和生理变化,以及与油脂合成及积累的关系,有待实验进一步验证和深入研究。
[1]Carafoli E.Calcium signaling:A tale for all seasons[J].Proc Natl Acad Sci,2002,99:1115-1122.
[2]Stevenson J M,Perera I Y,Heilmann I,et al.Inositol signaling and plant growth[J].Trends Plant Sci,2000(5):252-258.
[3]Erneux C,Govaerts C,Communi D,et al.The diversity and possible functions of the inositol polyphosphate 5-phosphatases[J].Biochimica et Biophysica Acta,1998(8):185-199.
[4]Ekblad L,Jergil B.Localization of phosphatidylinositol 4-kinase isoenzymes in rat liver plasma membrane domains[J].Biochimica et Biophysica Acta,2001,1531:209-21.
[5]Dove S K,Cooke F T,Douglas M,et al.Osmotic stress activates phosphatidylinositol-3,5-bisphosphate synthesis[J].Nature,1997,390:187-192.
[6]Mueller-Roeber B,Pical C.Inositol phospholipid metabolism in arabidopsis characterized and putative isoforms of inositol phospholipid kinase and phosphoinositide-specific phospholipase C1[J].Plant Physi,2002,130:22-46.
[7]Perera I Y,Heilmann I,Boss W F.Transient and sustained increases in inositol 1,4,5-trisphosphate precede the differential growth response in gravistimulated maize pulvini[J].Proc Natl Acad Sci,1999,96:5838-5843.
[8]Perera I Y,Heilmann I,Chang S C,et al.Arole for inositol 1,4,5-trisphosphate in gravitropic signaling and the retention of cold-perceived gravistimulation of oat shoot pulvini[J].Plant Physiol,2001,125:1499-507.
[9]Fallon K M,Trewavas A J.Phosphorylation of a renatured protein from etiolated wheat leaf protoplasts is modulated by blue and red light[J].Plant Physiol,1994,105(1):253-258.
[10]Qin C,Wang X M.The Arabidopsis phospholipase D family characterization of a calcium-independent and phosphatidycholineselective PLD1 with distinct regulatory Domains[J].Plant Physiol,2002,128:1057-1068.
[11]Berdy S E,Kudla J,Gruissem W,et al.Molecular characterization of At5Ptase1,an inositol phosphatase capable of terminating inositol trisphosphate signaling[J].Plant Physiol,2001,126:801-810.
[12]胡孝义,谭晓风,田晓明,等.油茶种子水通道蛋白CoPIP1-1的鉴定与分析[J].林业科学,2008,44(12):488-56.HU Xiaoyi,TAN Xiaofeng,TIAN Xiaoming,et al.Identification and analysis of an aquaporin (CoPIP1-1) in the seeds of Camellia oleifera[J].Scientia Silvae Sinicae,2008,44(12):48-56.(in Chinese)
[13]王保明,谭晓风.油茶亲环素基因的鉴定与其在大肠杆菌中的表达[J].中南林业科技大学学报,2011,31(10):85-93.WANG Baoming,TAN Xiaofeng.Identification of a gene for cyclophilin of camellia oleifera and its expression in escherichia coli[J].Journal of Central-South University of Forestry and Technology,2011,31(10):85-93.(in Chinese)
[14]邵奉公.油茶种子油脂合成调控的转录组与表达谱研究[D].长沙:中南林业科技大学,2011.
[15]聂志扬,肖飞,郭健,等.DNA测序技术与仪器的发展[J].中国医疗器械信息,2009,15(10):13-16.NIE Zhiyang XIAO Fei,GUO Jian.The development of DNA sequencing technologies and instruments[J].China Medical Device Information,2009,15(10):13-16.(in Chinese)
[16]Gillaspy G E.The cellular language of myo-inositolsignaling[J].New Phytol,2011,192:823-839.
[17]吴俐,王若仲,徐文忠.拟南芥中myo-肌醇-多磷酸合成与代谢及其信号[J].植物学报,2013,48(1):94-106.WU Li,WANG Ruozhong,XU Wenzhong.Myo-inositol polyphosphate metabolism and signaling in arabidopsis[J].Chinese Bulletin of Botany,2013,48(1):94-106.(in Chinese)
[18]马晖.水稻磷脂酰肌醇信号传导途径中一磷酸磷脂酰肌醇激酶(OsPIPK1)的分子遗传分析[D].北京:中国科学院 研究生院,2003.
[19]Wang W Y,Zhang L,Xing S F,et al.Arabidopsis AtVPS15 plays essential roles in pollen germination possibly by interacting with AtVPS34[J].Genet Genomics,2010,39:81-92.
[20]霍建飞,宋水山,李星,等.Ca2+·CaM信使系统参与小麦抗叶锈病反应的初步研究[J].华北农学报,2008,B10:234-239.HUO Jianfei,SONG Shuishan LI Xing,et al.Preliminary research on Ca2+·CaM involved in the resistance response of wheat to puccinia triticina[J].Acta Agriculturae Boreali-Sinica,2008,B10:234-239.(in Chinese)
[21]Stevenson-Paulik J,Phillippy B Q.Inositol polyphosphates and kinases[M]//Munnik T.Lipid Signaling in Plants.Berlin:Springer,2010:161-174.
[22]虞悦悦,戴谷,陈洁,等.钙调素(CaM)在中体上的分布及参与胞质分裂的调控[J].实验生物学报,2003,36(5):335-341.YU Yueyue,DAI Gu,CHEN Jie,et al.The distriibution of calmodulin with midbody and its involvement in cytokinesis regulation[J].Acta Biologiae Experimentalis Sinica,2003,36(5):335-341.(in Chinese)
[23]Gillaspy G E.Signaling and the polyphosphoinositide phosphatases from plants[M]//Munnik T.Lipid Signaling in Plants.Berlin:Springer,2010:117-130.
[24]林文慧.拟南芥磷脂酰肌醇信号传导途径相关基因的表达谱分析及多磷酸肌醇-5-磷酸酶的生理功能研究[D].北京:中国科学院 研究生院,2005.
[25]Lofke C,Ischebeck T,Konig S,et al.Alternative metabolic fates of phosphatidylinositol produced by phosphatidylinositol synthase isoforms in Arabidopsis thaliana[J].Biochem,2008,413:115-124.
[26]袁苑,武玉叶,李德全.植物甘油二醋激酶信号转导作用[J].植物生理学通讯,2007,43(6):1009-1014.YUAN Yuan,WU Yuye,LI Dequan.Diacylglycerol kinase signal transduction and function in plants[J].Plant Physiology Communication,2007,43(6):1009-1014.(in Chinese)

