益生菌发酵糙米饮料的制作工艺及其营养价值研究
陈海旭,赵丽芹,贠婷婷,刘珊,李怡然,杨志清,綦文涛
1(国家粮食局科学研究院,北京,100037)2(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特,010018)
糙米是指除了外壳之外都保留的全谷粒,具有完整生命力,含有丰富的膳食纤维和矿物质[1]。但由于糙米在脱去壳后仍然保留有部分外层组织,故口感较为粗糙,质地紧密,蒸煮费时,口感不如精白米好,所以并不受大众喜爱。糙米中约64%的营养元素都积聚于种皮和胚芽中[2-3]。但由于人们过度追求大米的“精”与“白”,使得大米在精加工过程中除去种皮,导致大量营养的损失,同时也造成了食物营养资源的极大浪费[4-6]。
本文针对全谷物饮料研究的空白,利用益生菌发酵,通过实验筛选适宜发酵的菌种及菌种组合,将糙米经过糊化、发酵等工艺制作成发酵糙米饮料。以期为开发既保留糙米中的营养物质,又改善了适口性和滋气味的健康饮品,同时也为全谷物食品更广泛的研究与推广提供理论依据。
1 材料与方法
1.1 实验材料
糙米:国家粮食局科学研究院提供;嗜酸乳杆菌、唾液乳杆菌、双歧杆菌、德式乳杆菌、酿酒酵母:国家粮食局科学研究院菌种保藏室保存;干酪乳杆菌:分离于自然发酵的糙米浆。
将实验菌株按2%的接种量接种于MRS液体培养基中,37℃培养48 h,连续活化3代后,以2%的接种量接种于脱脂牛奶中,37℃培养48 h进行菌种驯化,离心,清洗后转移到MRS培养基中待用。
1.2 仪器设备
Foss 2300 Kjeltec全自动蛋白仪、Foss soxtec2050脂肪检测仪、Foss Fibertec 2010粗纤维测定仪,丹麦FOSS公司;Agilent 1260高效液相色谱仪,Agilent公司;L-8800氨基酸自动分析仪,日立公司;Parr 6300 calorimeter能量仪,美国PARR公司;Horizontal Basis超净台,Thermo Scientific;LVDVC型黏度计,美国Brookfield公司;雷磁pHS-25 pH检测计,上海精密科学仪器有限公司;SBA-40C生物传感分析仪,山东省科学研究院生物研究所;DHP-9272电热恒温培养箱,上海科技试验设备有限公司。
1.3 发酵糙米饮料工艺流程

1.4 检测方法
1.4.1 乳酸含量测定
使用SBA-40C型乳酸-葡萄糖生物传感分析仪根据葡萄糖氧化酶固定化膜和氧电极组成的葡萄糖酶电极进行测定,使用乳酸-葡萄糖标准品进行标定后,进样20 μL,将读数乘以稀释倍数即得乳酸含量。
1.4.2 pH值的测定
使用雷磁pHS-25 pH检测计,经pH标准缓冲液标定后测定,结果取小数点后2位。
1.4.3 水溶性小肽含量的测定[7]
采用液相色谱法测定发酵产品中小肽含量:
(1)色谱条件
色谱柱:TSKgel G2000SWXL 300 mm×7.8 mm凝胶排阻柱;流动相:V(水)∶V(三氟乙酸)=1 000∶1;检测波长UV215 nm;流速1.0 mL/min;进样体积10 μL。
(2)样品制备
吸取各组发酵后产品的上清液5 mL,12 000 r/min离心 60 s,吸取 1 mL离心后的上清液,过0.45 μm的水系膜后,滤液放入样品瓶中上机待测。
1.4.4 氨基酸含量的测定[8]
采用日立L-8800氨基酸自动分析仪分析发酵产品中小肽含量变化情况,具体包括以下步骤:
(1)实验试剂的配制
按照仪器要求配制标准分析用 B1、B2、B3、B4、B5洗脱溶液、茚三酮试剂和茚三酮缓冲溶液。泵1(洗脱溶液)流速:0.40 mL/min;泵2流速:0.35 mL/min;分析柱温度:57℃;反应器温度:135℃;进样体积:20 μL。洗脱溶液、茚三酮试剂和茚三酮缓冲溶液配制方法如下:
茚三酮试剂:称取39 g茚三酮,溶于979 mL乙二醇甲醚中,过0.45 μm有机系微孔滤膜。
茚三酮缓冲液:称取无水醋酸钠204 g,冰醋酸123 mL,乙二醇甲醚401 mL,加超纯水溶解后,定容至1 L,过0.45 μm有机系微孔滤膜。

洗脱溶液试剂B1 B2 B3 B4 B5超纯水/mL 700 700 700 700 700柠檬酸三钠/g 6.19 7.74 13.31 26.67 -NaCl/g 5.66 7.07 3.74 54.35 -柠檬酸/g 19.80 22.00 12.80 6.10 -无水乙醇/mL 135.0 25.0 9.0 - 100.0 NaOH/g - - - - 8.00定容/L 1 1 1 1 1
(2)标准品的配制
取AAS-18氨基酸标准品(Sigma)1 mL,用0.1 mol/L的 HCl溶液稀释至 25 mL,移取此稀释液1 mL,过0.45 μm微孔滤膜,滤液入样品瓶中上机待测。
(3)样品的制备
称取蛋白质含量为7.5~25 mg的试样加6 mol/L HCl 15 mL,吹氮气封口后于110℃恒温箱中酸解22 h后,吸取200 μL酸解液加入样品瓶中,氮气吹干,然后加入200 μL去离子水用氮气吹干,重复此步骤3遍后,加入1.5 mL柠檬酸钠缓冲液并过0.45 μm滤膜后上机待测。
1.4.5 粗蛋白含量的测定
使用Foss 2300 Kjeltec凯式定氮仪,根据GB/T 14489.2-2008的标准,准确量取3 mL发酵后的样品,加入15 mL浓H2SO4及2片消化片,420℃消化至液体变为透明蓝色后冷却至室温上机测定。
1.4.6 粗脂肪含量的测定
使用 Foss soxtec2050脂肪检测仪,根据 GB/T 5512-2008的标准,准确称取5 g左右的烘干后的发酵样品,加入20 mL丙酮,上机设置循环温度后,进行测定。
1.4.7 能量的测定
使用Parr 6300 calorimeter能量仪,称取1.00 g左右的样品,放入仪器特制的燃烧盒中,使用压片器将样品压实,放入引线后上机进行测定。
1.4.8 碳水化合物的测定
碳水化合物/%=[100%-(蛋白质含量+脂肪含量+水分含量+灰分含量+膳食纤维含量)]×100
1.4.9 膳食纤维的测定
根据GB/T 5009.88-2008的方法进行检测。
1.4.10 活菌数的测定
按照确定的工艺参数制备饮料,对发酵后的最终产品做活菌计数,采用 MRS琼脂培养基,37℃培养24~48 h,每组发酵产品平行测定3次,计算活菌数目的平均值,结果以CFU/mL计。
1.5 操作要点
清洗:将糙米去杂后,放入浓度为1%的NaClO2溶液中浸泡5 min后用蒸馏水冲洗干净,对糙米进行初步的清洗消毒。
粉碎:将糙米用粉碎机粉碎至过30目筛。
糊化:按料液比1∶10的比例105℃糊化20 min。
均质:使用高压均质机在30 MPa的压力均质一次。
灌装、灭菌:将料液分装入500 mL的Schott瓶中,121℃灭菌 15 min。
接种:在微生物洁净工作台内,将冷却分装后的料液按照一定比例接入预处理过的种子液。
发酵:在恒温培养箱内,37℃发酵12 h。
调配:在微生物洁净工作台内,向产品中加入一定比例的蜂蜜。
1.6 数据处理
本文最终数据均来自于3次发酵实验的样品平行测定3次,所得实验数据采用Excel软件进行处理,用平均值±标准差 的形式表示,并通过单向方差和t检验进行显著性统计分析,其中P<0.05认为数据之间具有显著性差异(*);P<0.01认为数据之间差异极显著(**),n为实验次数。
2 结果与讨论
2.1 发酵菌种的选择
图1为6种不同益生菌菌株的初步糙米发酵结果。由图1可以看出,不同菌种发酵后产品中的乳酸含量有一定差异。其中干酪乳杆菌、唾液乳杆菌和双歧杆菌发酵后产品的乳酸含量均在15 mmol/L以上,其次为嗜酸乳杆菌,含量为13.83 mmol/L,而德式乳杆菌和酿酒酵母的乳酸含量较低,分别为9 mmol/L和7.5 mmol/L。在相同发酵条件下,德式乳杆菌和酿酒酵母的产乳酸能力明显低于其他4株菌种。同时由此图可以看出,发酵可以显著降低产品的pH值。6株菌种发酵后的pH值都比对照组(pH 6.5)低,其中德式乳杆菌和酿酒酵母的pH值为6株菌中最高的,分别为5.87和5.48,而嗜酸乳杆菌和唾液乳杆菌的发酵最终酸度是6株菌中最低的,分别为4.67和4.68,说明这2种菌对酸度具有更高的耐受性,能够更好地利用糙米中的营养物质在低pH环境下产生代谢产物。而干酪乳杆菌和双歧杆菌的pH值分别为5.04和4.94。市售的发酵饮品中,无论是发酵乳制品还是发酵米酒等制品,其发酵的最终pH值大约都在3.9~4.2之间[9],因此,单一菌种发酵后产品的乳酸含量较低,pH值较高,且无法达到丰富浓郁的口感。鉴于干酪乳酸杆菌、嗜酸乳杆菌、唾液乳杆菌和双歧杆菌的发酵效果要明显好于德式乳杆菌和酿酒酵母,本文接下来研究将选用这4株菌种进行混合复配发酵试验,以筛选出发酵效果最好的菌种组合。
2.2 最佳发酵菌种组合的选择

图1 单一菌株发酵后的乳酸含量及pH值Fig.1 The content of lactic acid and pH after single strain fermentation
复配菌种发酵后的乳酸含量及pH值如图2所示。由图2可见,在乳酸产量和pH值变化方面混菌发酵效果明显较单菌发酵好,且3种菌混合发酵组合的平均乳酸含量显著高于双菌混合发酵结果,乳酸最高的组合B+SS+SQQ组,其含量高达42.6 mmol/L,高浓度的乳酸含量赋予了产品浓郁的发酵风味。与此同时,双菌发酵的pH值较3种菌发酵的pH值偏高,在相同培养时间内pH值降低速率更慢。而发酵12 h后的3种菌复配发酵产品的pH值已经显著降低,并达到与市售发酵制品(pH=3.92)相当的pH值,充分说明3种菌复配的发酵效果的要好于双菌复配发酵。因此,本文进一步深入分析了复配发酵糙米饮料的营养价值和工艺参数。

图2 复配菌株发酵后乳酸、pH值含量图Fig.2 The content of lactic acid and pH of mixing strain fermentation
2.3 复配菌种发酵后的氨基酸及小肽含量变化分析
本文采用归一化法进一步分析了复配菌种发酵后的糙米饮品中水溶性肽的含量情况,由图3可以看出,发酵后的各组在分子质量1 800~10 000Da的水溶性多肽的峰面积明显大于未发酵的对照组,可以说明发酵后糙米食品中的多肽和小分子蛋白质含量有所增多。
表1显示了各发酵菌种组合在此分子质量区间的面积相比于未发酵的对照组的增长率平均达到400%左右,即为对照组的4倍左右,其中组合B+SS+SQQ组的增长率最高,达到了对照组的4.3倍。而分子质量在600~1 800Da区间内的小肽的峰面积中,发酵组也高于对照组,且增加率更是平均高达961%之多。充分说明发酵过程对水溶性肽类物质的增加起到了重要的作用。

表1 不同菌种组合发酵前后水溶性肽类物质面积增长率Table 1 The growth area rate of water-soluble peptides after mixing strain fermentation

图3 不同菌种复配发酵后的水溶性肽变化图Fig.3 The graph of water soluble peptide after fermentation by mixing strain
表2为4组3种菌混合复配发酵后的糙米饮料中的总氨基酸及主要氨基酸含量的变化情况。由表2可见,在总氨基酸含量上,组合干酪乳杆菌+嗜酸乳杆菌+双歧杆菌的总氨基酸量(1 179 mg/100g)较对照组氨基酸总量(930 mg/100 g)增长了26.74%,为4个菌种组合中总氨基酸含量增加最多的一组,该组合发酵后的产品中,使用酸水解法可以检测出的7种人体必需氨基酸全部高于未发酵对照组,平均增加率为39.97%,而参与蛋白质合成的人体必需氨基酸——蛋氨酸的增加率更是高达73%。由于人体内不能合成必需氨基酸而只能通过食物获取,因此必需氨基酸的增加有利于提高其在人体中的吸收率,促进人体的健康发展。在该发酵组合的产品中,除胱氨酸和甘氨酸外,发酵后产品中的非必需氨基酸含量全部高于未发酵对照组,平均增加率为25.64%。
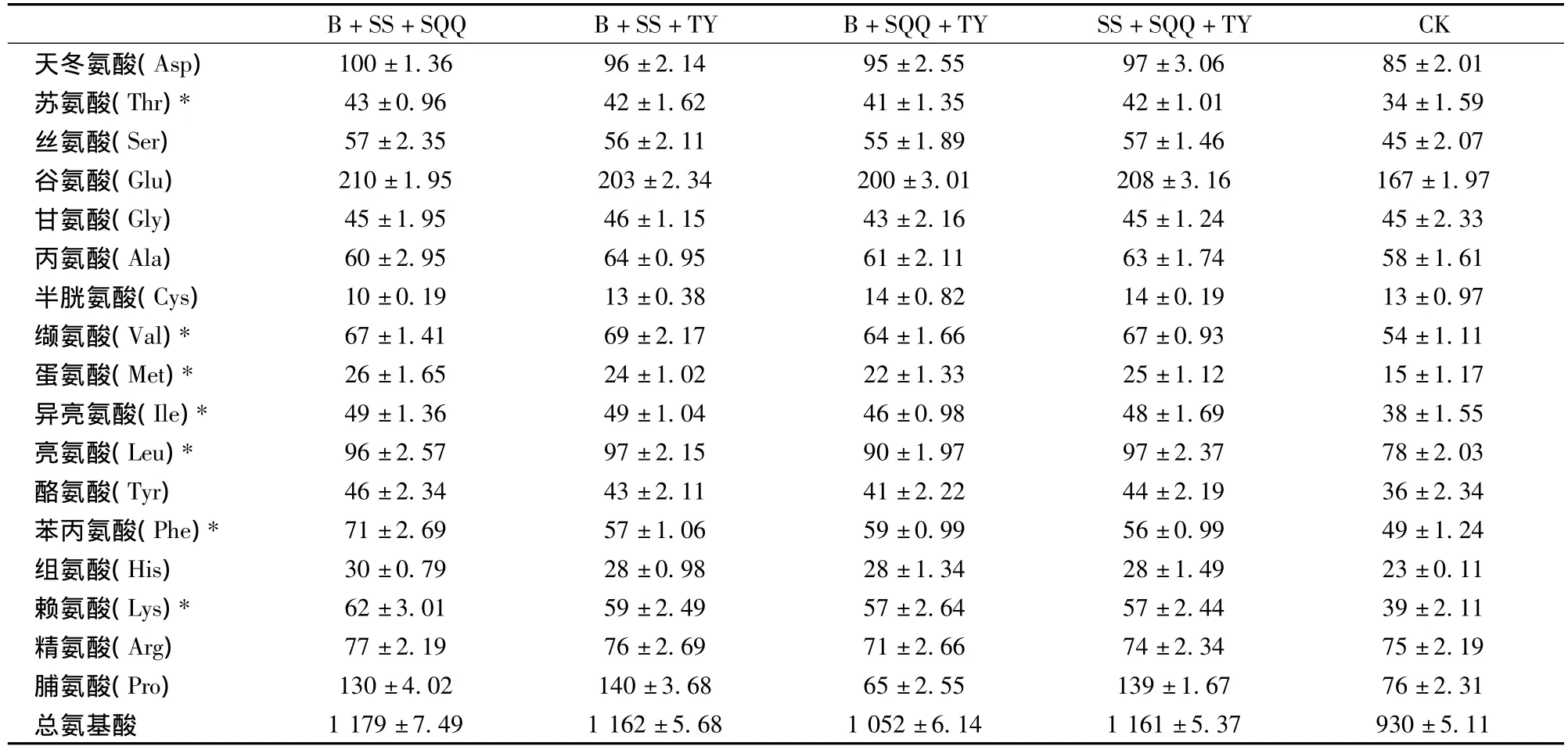
表2 复配菌株发酵前后产品氨基酸含量 mg/100gTable 2 The amino acid content on mixing strain fermentation mg/100g
通过乳酸、pH值、氨基酸含量、水溶性肽含量的综合比较和分析,发现嗜酸乳杆菌+干酪乳杆菌+双歧杆菌组合发酵后的氨基酸、水溶性小肽含量高于其他3个菌种组合,符合当代人对食物的选择标准:既味美价廉又低脂、高纤维、高营养,故最终选择该组合为发酵糙米饮料的复配菌种组合。因此,本文进一步对该菌株复配组合发酵糙米的工艺进行了优化研究。
2.4 发酵糙米饮料制作工艺参数的确定
2.4.1 料水比的确定
料水比不同,发酵后产品的黏度有显著差异,如图4所示。其中,料水比50∶1 000组的黏度过低,静置30 min后产品上下分层严重,难以形成稳定的悬浮体系;料水比为100∶1 000的发酵产品的黏度为24.87 mPa·s,与市售谷物饮料黏度(20.88 mPa·s)相比略高,其发酵后无明显分层,有较强的流动性。料水比150∶1 000组的黏度为34.29 mPa·s,明显高于市售对照组,发酵后产品无明显分层,但流动性要低于100∶1 000组。而料水比200∶1 000组的产品基本无流动性,其黏度更是高达98.05 mPa·s,流动性较差,不适宜用此比例制作饮料。从节约原材料的成本角度考虑,选择料水比为100∶1 000进行发酵产品的开发更合适。

图4 料水比对产品黏度的影响Fig.4 Effect of viscosity in different water mixture fermented products
2.4.2 发酵时间的确定
发酵时间的长短会直接影响产品的乳酸含量和风味,发酵时间短,产酸量不足,发酵气息不足,达不到合适的感官体验;发酵时间长,产酸过多且容易产生刺激性酸味,pH值过低,而且发酵周期长,会使发酵成本增加。由图5可以看出,发酵时间的长短对产品的乳酸含量和pH值具有一定影响。随着时间的延长,产品内富集的乳酸含量逐渐增多,发酵24 h左右,产品的乳酸含量为26.75 mmol/L,此时乳酸增加最快,增幅达到52%。同时,pH值在此时间段内下降最快,由4.45下降至4.18。该时间段的产品已具有浓郁的发酵气息,滋味偏酸,呈浅乳白色。当发酵至36h时,乳酸含量为52.17 mmol/L,pH值为3.99,此时产品的发酵气味偏酸,口感较酸,且带有一定的涩味。由此可见,单纯追求发酵时间并不一定能够提升产品的发酵口感。
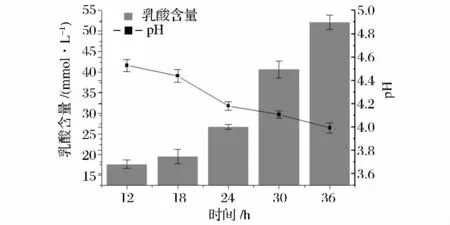
图5 发酵时间对产品的影响Fig.5 Effect of lactic acid and pH after different fermented time
2.4.3 接种量的确定
随着接种量的增大,产品的乳酸含量呈现逐步上升的趋势,而pH值呈现下降的趋势。这主要是由于,随着接种量的增加,起始发酵液中的乳酸菌活菌数随之增加,产酸能力强,乳酸含量上升较快,pH值下降也较快,而随着接种量继续增大,产酸过多,pH值过低,反而抑制了菌体的活性,导致乳酸的增长速度放缓,另一方面也许是由于菌种数目过多,相互竞争加大,对营养物质的竞争导致菌体生长活性降低。例如图6中,接种量为5%的乳酸含量较4%的接种量的乳酸含量增加了18 mmol/L,pH值降低了0.3,而接种量6%的乳酸含量较接种量5%的乳酸含量仅增长了4.2 mmol/L,pH值仅降低了0.05,基本无变化。这一结果与潘廷跳等[10]在制作搅拌型燕麦酸奶中的结果相似。他们发现在一定的范围内,随着乳酸菌接种量的增大,感官评定的分数就越高,而达到顶峰之后,分数又减小。他认为接种量过低时,在一定的时间内乳酸菌的繁殖生长能力有限,不能充分发酵而导致发酵不完全;而接种量过高时,在较短一段时间内产生较多的乳酸,导致酸度过大。所以5%左右的接种量最为适合发酵糙米饮料。
2.5 正交分析
根据单因素试验结果,以料水比、发酵时间、接种量,选取发酵后产品的乳酸含量作为评价指标,采用L9(34)正交设计对工艺条件进行优化。因素水平见表3,结果见表4。
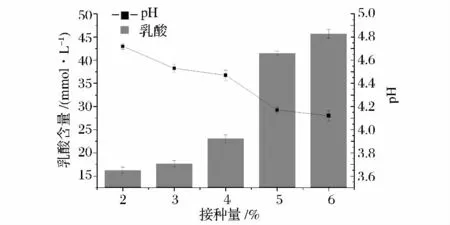
图6 接种量对发酵产品的影响Fig.6 Effect of lactic acid and pH on different inoculation
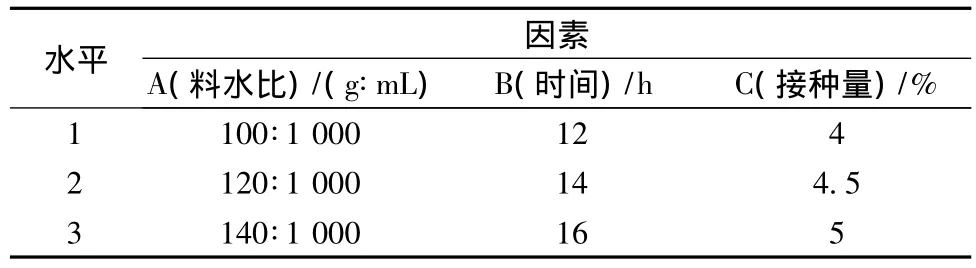
表3 发酵糙米饮料工艺正交试验因素水平表Table 3 Factors and levels of orthogonal experiment on fermentation of brown rice beverage
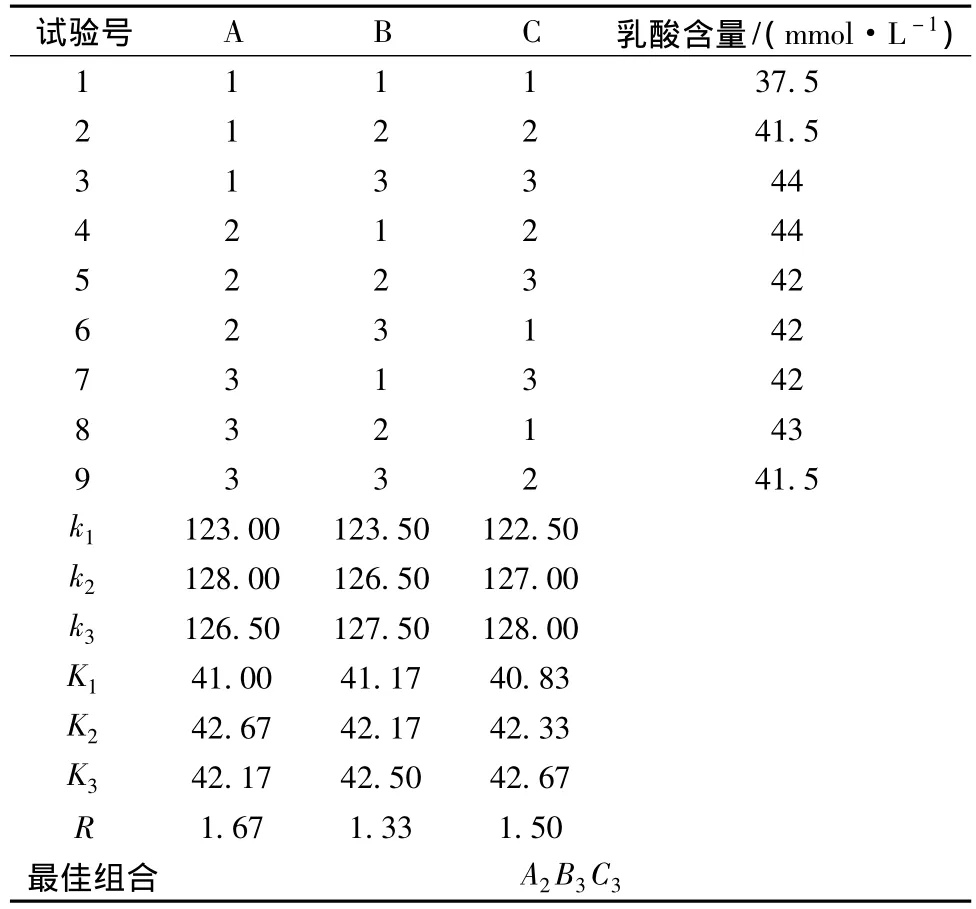
表4 发酵糙米饮料工艺正交试验结果Table 4 The result of orthogonal experiment on fermentation factors of brown rice beverage
由表4看出,影响发酵后产品的乳酸含量的因素主次顺序为:料水比>接种量>发酵时间,按各因素水平应选择组合A2B3C3作为最佳发酵组合,即接种量5%,料水比为120∶1000,发酵时间为16 h。3号(A1B2C3)、4号组合(A2B1C2)的乳酸含量最高,为了得到最佳发酵组合,将这2个组合与极差分析得到的组合N(A2B3C3)做发酵重复试验。结果见表7。
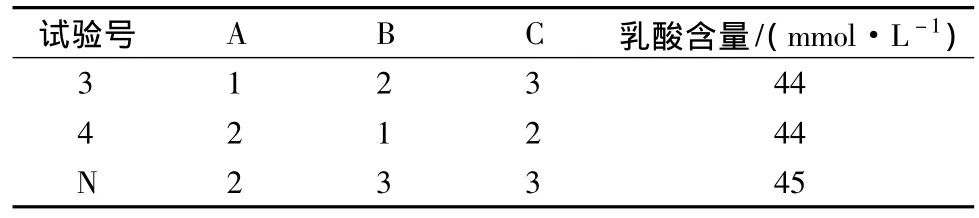
表5 发酵糙米饮料最佳工艺参数重复试验Table 5 Result of repeated test on fermentation factors of brown rice beverage
2.6 发酵产品营养成分的对比
对发酵后的糙米饮料立即进行营养成分及活菌数的测定,通过糙米饮料发酵前后的营养数据对比可以看出,发酵后的产品蛋白质有所提高,脂肪、碳水化合物、能量及膳食纤维含量有所下降,如表6所示。碳水化合物的下降是由于发酵过程中乳酸菌的生长代谢对碳水化合物的利用所导致的,膳食纤维和脂肪含量的下降来源于加工过程中高温条件对其的破坏。而发酵的糙米饮料与市售饮料对比可以看出,蛋白质含量较谷物饮料略显不足,但高出乳酸菌饮料。脂肪含量虽然高于乳酸菌饮料但远远低于谷物饮料中的脂肪含量。碳水化合物和能量的含量均低于市售饮料,发酵糙米饮料呈现为低能量的状态。反观膳食纤维含量,发酵糙米饮料的膳食纤维含量是市售谷物饮料的3.2倍,在每天正常饮食范围内再多补充300mL发酵糙米饮料大约便可满足成人膳食纤维的日平均摄入量。同时,发酵糙米饮料与市售乳酸菌饮料相比含有更多的活菌数目,又由3种益生菌复配发酵而成,菌种种类多,活性好,更有助于人体肠道菌群的平衡,保持肠胃年轻。

表6 发酵糙米饮料与市售饮料的营养成分对比Table 6 Comparison of nutrients between fermented brown rice beverage and market sale beverages
3 结论与讨论
三菌复配混合发酵较单菌和双菌混合发酵更利于健康、营养、美味全谷物糙米饮料的开发。单因素和正交试验表明嗜酸乳杆菌+干酪乳杆菌+双歧杆菌组合发酵糙米的最佳工艺为:接种量为5%,料水比为120∶1 000,于37℃发酵16 h,所得的发酵产品的风味浓郁清香,有较适宜的酸度,口感醇厚。与市售谷物饮料和乳酸菌饮料进行营养成分分析对比,最佳菌种组合和工艺条件下发酵糙米饮料的蛋白质、膳食纤维含量均高于市售饮料,而脂肪、碳水化合物、能量含量低于市售饮料,产品的营养全面、均衡,适宜现代人对营养的需求,活菌数更是达到1.2×108cfu/mL,是一种具有很好开发潜力的营养全面、风味独特、健康的全谷物饮品。
[1] 刘月好,任力民.糙米的营养价值及在食品中的应用[J].粮食加工,2004,10(2):18-20.
[2] 陈志刚.糙米的营养成分及其在发芽过程中的变化[J].南京农业大学学报,2003,26(3):84-87.
[3] 黄迪芳.糙米萌发工艺及发芽糙米功能饮料的研究[D].无锡:江南大学,2005.
[4] 单斌.双酶法优化复合碎米-糙米乳饮料工艺条件[J].食品与机械,2011,12(6):69-71.
[5] 胡秀娟.酶对发芽糙米皮层结构影响的研究[J].粮食与饲料工业,2012,3(8):30-32.
[6] 骆超超.几种益生菌发酵谷物饮料制作工艺研究[J].东北农业大学学报,2011,42(5):127-129.
[7] 李冰冰.发芽糙米与稻谷的谷氨酸脱羧酶活力及 γ-氨基丁酸含量比较[J].食品与发酵工业,2006,32(5):28-30.
[8] 顾振新.发芽糙米制备工艺研究[J].食品工业科技,2004,25(1):70-72.
[9] 吴澎,田纪春,王凤成.谷物中植酸及其应用的研究进展[J].中国粮油学报,2009,24(3):137-143.
[10] 潘廷跳,庞杰,刘福林.搅拌型燕麦酸奶的研制[J].中国乳品工业,2010(12):16-18.

