兽疫链球菌荚膜多糖 PCP-I的制备、特性分析及其体外抗氧化活性*
柯春林,曾晓雄
1(蚌埠学院生物与食品工程系,安徽蚌埠,233030)2(南京农业大学食品科技学院,江苏南京,210095)
兽疫链球菌(Streptococcus zooepidemicus)荚膜多糖(capsular polysaccharide)是兽疫链球菌在生长代谢过程中分泌到细胞壁外,与细胞壁相结合的胞外多糖(EPS)。有研究表明,来自链球菌的荚膜多糖的主要成分是透明质酸(HA)[1]。我们前期的研究结果也显示兽疫链球菌荚膜多糖的主要成分是HA[2]。然而,至今为止国内外没有关于兽疫链球菌荚膜多糖其他成分的报道。本研究通过对兽疫链球菌C55129中国分离株菌株发酵液的预处理、乙醇沉淀、脱色和脱蛋白获得了较高糖含量的荚膜多糖,采用DEAE-纤维素柱和Sephadex凝胶柱层析,得到了荚膜多糖组分PCP-I,进行了纯度鉴定和分子质量测定,并通过紫外(UV)、红外(IR)、气相色谱(GC)、液相色谱(HPLC)等手段确定PCP-I的理化特性。据报道有很多活性氧族自由基(ROS),如过氧化氢(H2O2)、超氧阴离子自由基(O2-·)和羟自由基(·OH)等。过多的ROS能毁坏细胞的组分如脂质体、蛋白质和DNA[3]。ROS在机体衰老过程中起重要作用。据报道广泛存在于植物、动物和微生物体内的多糖具有清除自由基并保护机体免受自由基氧化损害的作用[4-6]。有研究显示链球菌荚膜多糖具有抗氧化作用[2,7],兽疫链球菌 C55129 中国分离株菌荚膜多糖组分是否具有抗氧化活性,本文也采用了不同的体外抗氧化实验研究了荚膜多糖纯化组分PCP-I的抗氧化活性。
1 材料与方法
1.1 材料
1.1.1 实验材料
兽疫链球菌C55129菌株,购自中国兽药监察所;脑心浸液(BHI,DIFCO,USA),无菌绵羊全血,杭州新锐生物工程有限公司;L-鼠李糖、L-阿拉伯糖、L-岩藻糖、D-木糖、D-甘露糖、D-葡萄糖、D-半乳糖、D-葡萄糖醛酸,Sigma;DEAE-52、Sephadex G-100,Whatman;多糖标准品 P-82,Japan;吡啶、盐酸羟胺、醋酸酐、肌醇、碘甲烷,均为色谱纯;咔唑、四硼砂钠,三氯乙酸、三氟乙酸、苯酚、浓 H2SO4、无水乙醇、FeCl3、Fe-SO4、Na2H2PO4、NaH2PO4、铁氰化钾、H2O2、FeCl2,均为国产分析纯;考马斯亮蓝G-250、牛血清白蛋白等,均为国产分析纯;1,1-二苯基苦基苯肼(DPPH)、硝基四氮唑蓝(NBT)、吩嗪硫酸甲酯(PMS)、烟酰胺腺嘌呤二核苷酸(NADH)和菲洛嗪(ferrozine),购自 Sigma公司。
1.1.2 实验仪器
高压灭菌锅(LDZX-40BI型),上海申安医疗器械厂;超净工作台(SW-CJ-IBU型),苏净集团安泰公司;隔水式恒温培养箱(GRP-9080型),上海森信实验仪器有限公司;恒温调速摇床柜(HYG-II型),上海新星自动化控制设备成套厂;电热鼓风干燥箱(DHG-9030A型),上海一恒科技有限公司;低速离心机(Anke TDL-5型),上海安亭科学仪器厂;高速台式离心机(MIKRO-2型),HITTACH;紫外-可见分光光度计(UV-2450型),Shimadzu,日本;可见分光光度计(722S型),上海菁华科技仪器有限公司;数显恒温水浴锅(HH-4型),江苏国华电器有限公司;层析柱(2.6×30 cm,2.6×70 cm),上海亚荣生化仪器有限公司;HL-2B数显恒流、BS-100A自动分布收集器,上海沪西分析仪器厂;循环水式多用真空泵(SHB-IIIA型),郑州长城科工贸有限公司;真空旋转蒸发仪(Laborota 4000型),Heidolph,德国;冷冻干燥机(Alpha 1-2型),LABCONCO,英国;AY-120电子精密天平、BL-220H分析天平,Shimadzu,日本;红外光谱仪(MB 154S型),Bomen,加拿大;Agilent 1100 高效液相色谱仪、Agilent 6890N气相色谱仪,美国安捷伦公司。
1.2 方法
1.2.1 PCP-I的制备、分离和纯化
(1)荚膜多糖粗多糖的制备 菌种在5%绵羊BHI血平板37℃培养24 h→种子液37℃培养24 h→发酵培养24 h(装液量为50 mL/500 mL,接种量为5%,37℃,200 r/min)→发酵液。接着用三氯乙酸法杀菌、除菌。再采用CTAB季氨盐络合和乙醇沉淀法提取荚膜多糖粗多糖(CCP),HP-20聚苯乙烯型大孔吸附树脂脱色,Sevag法[8]脱蛋白。
(2)PCP-I的分离和纯化 先采用DEAE-52(2.6×30 cm)纤维素离子交换柱层析。上样时,取脱色和脱蛋白后的CCP液6 mL(浓度为10 mg/mL)。分别采用双重纯蒸水(dH2O)(1~20管)、0.1 mol/mL NaCl(21~40管)和0.5 mol/mL NaCl(41~60管)进行梯度洗脱,流速0.8 mL/min,10 mL/管收集,用咔唑法[9]每隔一管测定酸性糖和硫酸苯酚法[10]测定中性总糖的含量。然后采用Sephadex G-100(2.6 cm×70 cm)凝胶柱层析。上样时,取DEAE-52层析纯化后的PCP-I纯荚膜多糖液2 mL(浓度为10 mg/mL)。均用双重纯蒸水蠕动泵洗脱,流速均为0.5 mL/min,6 mL/管自动收集仪收集,洗脱至苯酚-硫酸法无糖检测出为止。用硫酸苯酚法[10]每隔一管测定中性总糖的含量,多糖纯度用HPLC检测。纯化多糖得率计算公式:
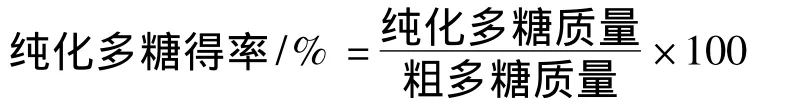
1.2.2 理化性质分析
(1)总糖含量的测定 采用苯酚-硫酸法测定荚膜多糖总糖的含量[10];(2)酸性糖的测定(GlcA含量的测定)咔唑法[9];(3)蛋白质含量的测定-考马斯亮蓝法[11];(4)分子质量的测定(黏度法)用一点法[12]测定荚膜多糖的特性黏度,根据经验公式η=3.6×10-4Mr0.78计算荚膜多糖的分子质量(Mr)。
1.2.3 PCP-I的分子质量及光谱学分析
(1)荚膜多糖组分纯度鉴定和分子质量测定本文采用高效凝胶过滤色谱法(HPGFC)鉴定荚膜多糖组分PCP-I的纯度,同时测定其分子质量。以普鲁兰多糖(P-200,P-100,P-20,P-10和 P-5)平均分子质量的对数(lgMw)对保留时间(tR)作图,得标准曲线。HPGFC检测条件为:色谱柱,TSK-Gel G3000 SW;流动相,含0.1 mol/L Na2SO4的10 mmol/L磷酸盐缓冲液(pH 6.8);流速,1 mL/min;进样体积,20 μL;检测器,示差折光检测器;柱温,25℃;检测器温度,25℃。精确称取样品PCP-I配成1 mg/mL溶液,在同样条件下进行柱层析,记录样品的tR值,对照标准曲线,根据回归方程计算样品的分子质量。
(2)紫外光谱分析利用待测样品在280 nm处有无吸收峰来检测样品中是否含有蛋白质和在260 nm处有无吸收峰来判断是否含有核酸;在206 nm处有无吸收峰来判断是否含有多糖。将多糖样品PCP-I配成0.5 mg/mL的溶液,用紫外分光光度计在波长200~400 nm范围内进行紫外扫描。
(3)红外光谱分析 取干燥的PCP-I 1.0 mg,用KBr压片,在4 000~400 cm-1的范围内进行红外光谱扫描,记录红外光谱图。
1.2.4 PCP-I单糖组成分析
采用完全酸水解法来测定多糖组分PCP-I的单糖组成。多糖样品10 mg溶于2 mL 2 mol/L的三氟乙酸(TFA),置安瓶中封口,120℃水解2 h。水解液旋转蒸发至干,加入5 mL甲醇,蒸干,重复多次,去除TFA后加少量水溶,冻干,得完全酸水解单糖样品。采用糖睛乙酸酯法[10]对单糖样品进行衍生,取水解干燥后的单糖样品5 mg,加10 mg盐酸羟胺和3 mg肌醇,0.5 mL吡啶,封口,90℃下加热反应30 min,间或振荡。取出后冷至室温,加入0.5 mL醋酸酐,90℃下继续反应30 min后得糖睛乙酸酯衍生物。5 000 r/min离心10 min,取上清(若有沉淀,加丙酮溶解或稀释,再离心取上清)。以肌醇六乙酸酯为内标,衍生物直接进行气相色谱分析。色谱柱:弹性石英毛细管柱 HP-5,30.0 m ×320 μm ×0.25 μm;柱温210℃;进样口温度250℃;氢火焰离子化检测器(FID);检测器温度:250℃;载气:N2。程序升温为柱初温120℃,以3℃/min至210℃,保持4 min。根据出峰时间和峰面积比可知样品的单糖组成和摩尔比。计算公式:

其中,Wx为样品中单糖质量,mg;Wi为样品中加入内标的质量,mg;Ax为样品中单糖的峰面积;Ai为样品中内标的峰面积;校正因子K=Wi×As/(Ws×Ai)。
1.2.5 PCP-I的体外抗氧化活性测定
(1)还原力的测定 根据文献[13]的报道,稍做修改。取不同浓度样品溶液1.0 mL于试管中,分别加入1.0 mL磷酸盐缓冲液和1.0 mL K3Fe(CN)6溶液,混匀,50℃水浴20 min,取出后迅速冷却,再加1.0 mL三氯乙酸,混匀,再加0.2 mL FeCl3溶液,混匀,10 min后测A700nm。同时做样品空白实验(以水代替FeCl3溶液)。以吸光度值(A1-A2)表示样品的还原力。A1为样品实验的吸光值;A2为样品空白实验的吸光值。
(2)螯合金属离子的能力 根据Liu等[14]的方法,稍做修改。取不同浓度样品溶液1.0 mL于试管中,分别加入0.05 mL FeCl2溶液、0.2 mL菲洛嗪(ferrozine)溶液和2.75 mL水,混匀,10 min后测A562nm。同时做样品空白实验(以水代替FeCl2溶液)。以水代替样液和FeCl2溶液,做参比实验调零用。
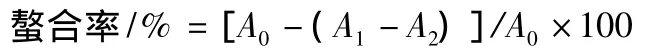
其中:A0-水代替样液时的吸光值;A1-样品实验的吸光值;A2-样品空白实验的吸光值。
(3)对DPPH·的清除作用 采用Ke等[15]的方法,取不同浓度样品溶液1.0 mL于试管中,加入0.2 mL配制的DPPH溶液,再加入2.0 mL水,混合均匀,反应30 min后于A517nm处测其吸光值。同时做样品空白实验(以水代替DPPH溶液)。以水代替样液和DPPH溶液,做参比实验调零用。
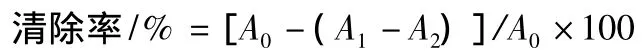
其中:A0-水代替样液时的吸光值;A1-样品实验的吸光值;A2-样品空白实验的吸光值。
(4)对超氧阴离子自由基(O2-·)的清除作用根据文献[16]的报道,稍做修改。取不同浓度样品溶液1.0 mL于试管中,分别加入1.0 mL NBT、1.0 mL NADH和1.0 mL PMS,混匀起始反应,于25℃水浴5 min,测A560nm。同时做样品空白实验(以磷酸盐缓冲液代替NBT)。

其中:A0-水代替样液时的吸光值;A1-样品实验的吸光值;A2-样品空白实验的吸光值。
(5)对羟自由基(·OH)的清除作用根据Zhang等[17]的报道,稍做修改。采用Fenton反应研究多糖对·OH的清除能力。在反应体系中分别加入1 mL邻二氮菲,1.5 mL PBS缓冲液,充分混匀后,加入1.0 mL FeSO4溶液,立即混匀,再向反应体系中加入不同浓度的多糖溶液1 mL,混匀。同时设阴性对照管和正常管,不加糖液。再分别加入1 mL H2O2溶液,正常管不加H2O2溶液,以等体积蒸馏水补充体积。在37℃水浴中反应30 min,测定A536nm,做3次平行实验。
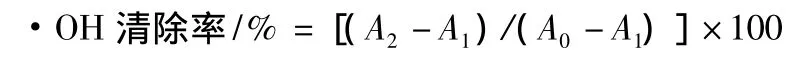
其中,A0-正常管吸光值;A1-阴性对照管吸光值;A2-样品管吸光值。
(6)对脂质过氧化抑制作用 参考文献[18]的报道,稍有调整。取0.5 mL卵磷脂乳浊液,加入1 mL不同浓度的多糖溶液,100 μL的FeSO4溶液,1.5 mL的蒸馏水。正常管和对照管不加多糖液,其他试剂同前。将上述试管37℃下水浴2 h,取出后,加入1.5 mL乙酸溶液,100 μL TCA,静置10min后,加入1.5 mL 0.8%的TBA和1.1%的SDS的混合液(体积比1∶1),正常管不加 TBA,于95℃下反应15min,冰水冷却后,10 000 g离心5 min,取上清液,测A532nm,做3次平行实验。

其中,A0-正常管吸光值;A1-阴性对照管吸光值;A2-样品管吸光值。
2 结果与分析
2.1 PCP-I的分离和纯化
CCP经离子交换层柱洗脱出多个组分,其中蒸馏水洗脱出的中性糖组分如图1A所示。F1组分经凝胶柱层析均只洗脱出单一的峰,即均一组分PCP-I,如图1B所示。
2.2 PCP-I的理化性质
PCP-I为白色粉末,颜色较浅,可溶于水并形成黏性溶液。PCP-I得率、糖醛酸含量、蛋白含量、特性黏度和分子质量(表1)。PCP-I不含糖醛酸,为中性糖。

表1 PCP-I的得率及初步鉴定Table 1 Yield and preliminary characterization of PCP-I
2.3 PCP-I的分子质量及结构特性
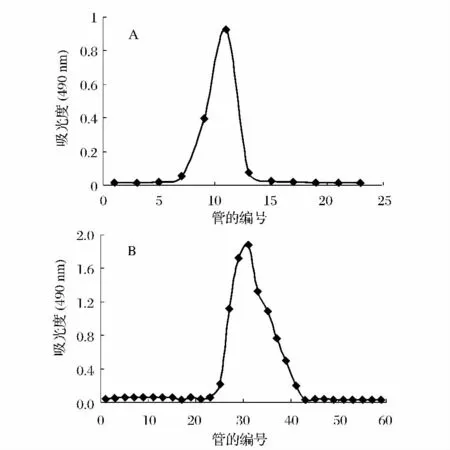
图1 CCP的DEAE-52和G-100层析洗脱曲线Fig.1 Elution curve of CCP by DEAE Cellulose-52 anion-exchange chromatography and by Sephadex G-100 column chromatography
(1)分子质量 HPGFC色谱图如图 2所示。PCP-I组分在色谱柱上显示为峰形对称的单峰,证明这两个多糖样品分子质量分布均一,纯度较高。PCP-I的保留时间(tR)为9.927 min,根据多糖标准品分子质量的标准曲线,计算出荚膜多糖的平均分子质量(Mw)。PCP-I为0.029 2×103kDa,与黏度法推算出的分子质量相差不大。
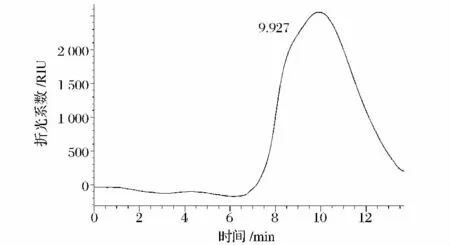
图2 PCP-I的HPGFC洗脱图谱Fig.2 Elution pattern of PCP-I on HPGFC
(2)紫外和红外光谱分析 PCP-I的紫外扫描图谱分别如图3A所示。由图3 A可知荚膜多糖PCP-I在206 nm处有多糖的特征吸收峰,260 nm、280 nm附近曲线平坦,几无核酸和蛋白质的吸收峰,说明PCP-I几乎不含核酸和蛋白质成分。红外扫描图谱如图3B所示,PCP-I具有多糖特征。PCP-I的吸收谱带在3 409.51 cm-1处有一强且宽的吸收峰,系多糖上的O-H形成分子间、内氢键;2 940.55 cm-1附近的肩峰为饱和C-H伸缩振动的信号;814.912 cm-1处有吸收峰,表明PCP-I可能含有甘露吡喃糖[10]。
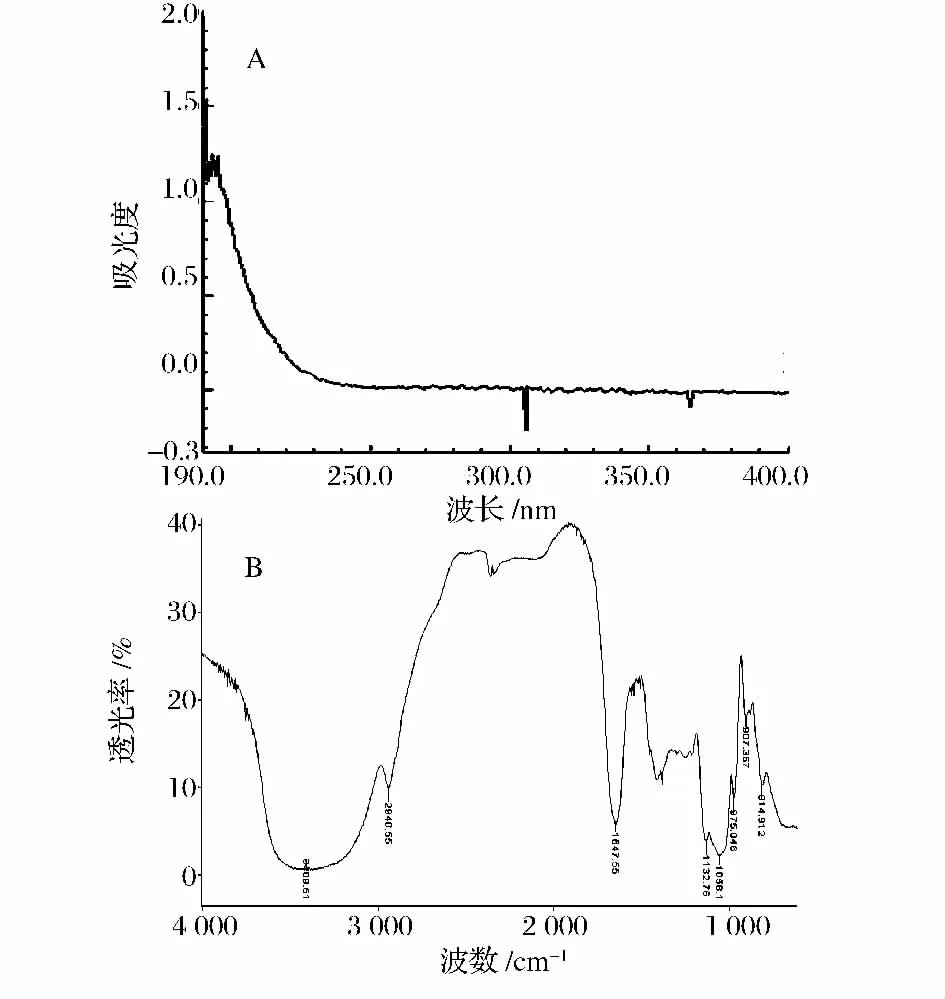
图3 A PCP-I的紫外扫描图谱和红外光谱图Fig.3 UV spectrum and FT-IR spectrum of PCP-I
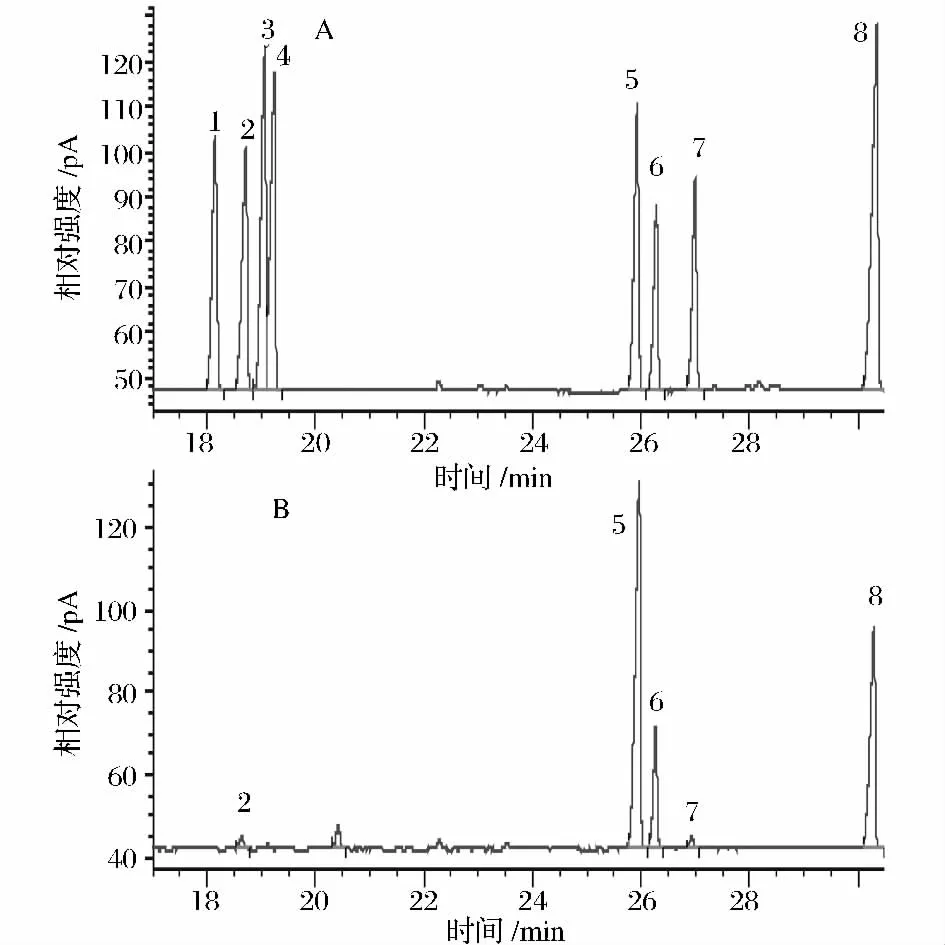
图4 标准单糖衍生物和PCP-I衍生物的气相色谱图Fig.4 GC spectra of derivatives from standard monosaccharides and monosaccharide compositions of PCP-I
(3)单糖组成分析 7种单糖标准品GC图如图4A所示。从左到右分别为:1,L-鼠李糖(tR,18.157);2,L-阿拉伯糖(tR,18.722);3,L-岩藻糖(tR,19.064);4,D-木糖(tR,19.245);5,D-甘露糖(tR,25.933);6,D-葡萄糖(tR,26.287);7,D-半乳糖(tR,27.000);8,肌醇(tR,30.352)。PCP-I 完全酸水解GC图如图4B所示。从左到右分别为:2,阿拉伯糖(tR,18.640);5,甘露糖(tR,25.968);6,葡萄糖(tR,26.271);7,半乳糖(tR,26.937);8,肌醇(tR,30.293)。PCP-I单糖组成及摩尔比为阿拉伯糖∶甘露糖∶葡萄糖∶半乳糖 =0.99∶27.03∶11.84∶1.00。
2.4 PCP-I体外抗氧化活性
(1)还原力。多糖具有抗氧化能力,能阻止链的发生,结合过渡金属离子,解聚过氧化物,防止氢的夺取反应以及自由基的清除[19]。其中多糖的还原力是其潜在抗氧化能力的一个重要的衡量指标[20]。如图5A所示,当荚膜多糖的质量浓度在75~1 200 μg/mL时,其还原力具有剂量依赖关系。荚膜多糖的还原力随着样品浓度的增大而增长,在1 200 μg/mL时达到最大,PCP-I的还原力(ΔA700nm)为0.615,说明荚膜多糖具有较好的还原力作用,而且PCP-I的作用很明显。
(2)螯合金属离子的能力。有机类生物大分子螯合金属离子的能力是其抗氧化活性的一种表现[21]。图5B 显示,在 78 ~1 250 μg/mL 浓度范围内,PCP-I螯合Fe2+的能力逐渐增大。在1 250 μg/mL时,PCP-I螯合金属离子的能力达到 84.62%。由此可见PCP-I有较好的螯合Fe2+的能力。
(3)对DPPH·的清除作用。DPPH·是一种稳定的自由基,是估测抗氧化剂清除自由基活性的有力工具[22]。在所有的测试浓度范围内,荚膜多糖清除DPPH·活性很明显,如图5C所示。随着多糖样品浓度的增加,其清除能力增长显著(P<0.01),在1 600 μg/mL质量浓度时,PCP-I清除 DPPH·活性达到45.57%。
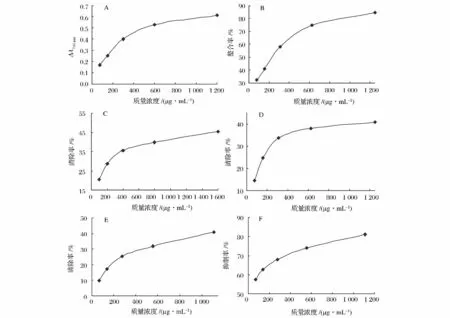
图5 荚膜多糖PCP-I的抗氧化活性Fig.5 The antioxidant activity of capsule polysaccharides PCP-I
(4)对超氧阴离子自由基(O2-·)的清除作用。O2-·是那些具有和生物大分子反应引起组织毁坏自由基的前体[23]。O2-·在活性氧族自由基(ROS)的形成中起很重要作用,这些 ROS如过氧化氢(H2O2)、羟自由基(·OH)和单线态氧(1O2)。过多的ROS能毁坏细胞的组分如脂质体、蛋白质和DNA[24]。如图5D所示,荚膜多糖对 O2-·的清除活性随着多糖浓度的增加而增长,在1 250 μg/mL浓度时,PCP-I清除O2-·活性达到40.84%。由此可见荚膜多糖具有较好的清除O2-·的能力,其机制可能是荚膜多糖被O2-·降解[25]。尽管O2-·本身不能降解荚膜多糖,但它能参与过渡金属离子的离子反应并产生氧化性很强的·OH,·OH能降解荚膜多糖。
(5)对羟自由基(·OH)的清除作用。·OH和其衍生化自由基是破坏性最强的ROS,它的主要作用是引起生物大分子的氧化损伤。图5E显示了荚膜多糖清除·OH的情况。在69~1 120 μg/mL浓度范围内,CCP清除·OH的活性随多糖浓度的增加而增大。在 1 120 μg/mL浓度时,PCP-I清除·OH的活性达到40.94%。说明荚膜多糖PCP-I具有适度的清除·OH的能力。荚膜多糖或许是通过自身的降解[26]来发挥其抗氧化作用的。
(6)对脂质过氧化抑制作用。脂质过氧化是自由基介导的链反应的自然结果,该反应的终端产物如过氧化氢脂质和具有未配对电子或能从其他分子中吸附电子的变化种类。所有的这些终端产物能直接或间接地破坏DNA分子[27]。PCP-I对非酶的脂质过氧化的作用结果如图5F所示,在1 120 μg/mL质量浓度时,PCP-I对脂质过氧化的抑制作用为 81.17%。由此可见荚膜多糖具有很高的脂质过氧化抑制作用,其机制可能是多糖和膜的相互作用的结果[28]。
3 结论
从兽疫链球菌C55129菌株发酵液中提取到荚膜多糖粗品(CCP),通过DEAE-52纤维素阴离子交换柱层析和Sephadex G-100凝胶柱层析从CCP中分离到中性糖组分,命名为 PCP-I,得率为5.989%,PCP-I为白色固体,易溶于水,分子质量为0.029 2×103kDa。.利用气相色谱法分析单糖组成及摩尔比为阿拉伯糖∶甘露糖∶葡萄糖∶半乳糖=0.99∶27.03∶11.84∶1.00。体外抗氧化实验结果表明,PCP-I有较强的螯合金属离子的能力、还原力和抑制脂质过氧化作用,以及清除DPPH·、O2-·和·OH活性的能力。
[1] Woolcock J B.The capsule of Streptococcus equi[J].J Gen Microbiol,1974,85(2):372-375.
[2] KE CL,QIAO DL,GAN D,et al.Antioxidant acitivity in vitro and in vivo of the capsule polysaccharides from Streptococcus equi subsp.Zooepidemicus[J].Carbohyd Poly,2009,75(4):677-682.
[3] Melov S,Ravenscroft J,Malik S,et al.Extension of lifespan with superoxide dismutase/catalase mimetics[J].Science,2000,289:1 567-1 569.
[4] JIANG CX,XIONG QP,GAN D,et al.Antioxidant activity and potential hepatoprotective effect of polysaccharides from Cyclina sinensis[J].Carbohyd Poly,2013,91(1):262-268.
[5] ZHANG L,Koyyalamudi S R,Jeong S C,et al.Antioxidant and immunomodulatory activities of polysaccharides from the roots of Sanguisorba officinalis[J].Int J Biol Macromol,2012,51(5):1 057-1 062.
[6] YOU QH,YIN XL,ZHANG SN,et al.Extraction,purification,and antioxidant activities of polysaccharides from Tricholoma mongolicum Imai[J].Carbohyd Poly,2014,99(3):1-10.
[7] Cleary P P,Larkin A.Hyaluronic acid capsule:strategy for oxygen resistance in group A Streptococci[J].J Bacteriol,1979,140(3):1 090-1 097.
[8] Sevag M G,et al.The isolation of components of Streptococcal nucleoproteins in serologically active form[J].J Biol Chem,1938,124(2):425.
[9] Bitter T,Muir H M.A modified uronic acid carbazole reaction[J].Anal Biochem,1962,4:330-334.
[10] 张惟杰.糖复合物生化研究技术[M].2版.杭州:浙江大学出版社,1999:94-197.
[11] 陈均辉,陶力,李俊,等.生物化学实验[M].北京:科学出版社,2003.
[12] 刘爱华,郭学平,刘丽.透明质酸钠特性黏度的一点法测定[J].中国医药工业杂志,2004,35(3):164-165.
[13] Oyaizu M.Studies on products of browning reaction:antioxidative activities of products of browning reaction prepared from glucosamine[J].Japan J Nutr,1986,44:307-315.
[14] LIU Chun-hui,WANG Chang-hai,XU Zhi-liang,et al.Isolation,chemical characterization and antioxidant activities of two polysaccharides from the gel and the skin of Aloe barbadensis Miller irrigated with sea water[J].Process Biochem,2007,42(6):961-970.
[15] KE CL,SUN LP,QIAO DL,et al.Antioxidant acitivity of low molecular weight hyaluronic acid[J].Food Chem Toxicol,2011,49(10):2 670-2 675.
[16] LI X,ZHOU A,HAN Y.Anti-oxidation and anti-microorganism activities of purification polysaccharide from Lygodium japonicum in vitro[J].Carbohyd Polym,2006,66(1):34-42.
[17] ZHANG EX,YU LJ.Studies on polysaccharide from Sargassum Thunberg II for its ability to scavenge active oxygen species[J].Chin J Mar Drugs,1997,3:1-4.
[18] Smirnoff N,Cumbes Q J.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1 057-1 060.
[19] Diplock A T.Will the‘Good Fairies'please prove to us that vitamin E lessens human degenerative disease?[J].Free Radical Res,1997,26(6):565-583.
[20] Leskovar D I,Cantamutto M,Marinangelli P,et al.Comparison of direct-seeded,bareroot,and various tray seedling densities on growth dynamics and yield of longday onion[J].Agronomie,2004,24(1):1-6.
[21] Oktay M,Gulcin I,Kufrevioglu O I.Determination of in vitro antioxidant activity of fennel(Foeniculum vulgare)seed extracts[J].LWT-Food Sci Technol,2003,36(2):263-271.
[22] HU FL,LU RL,HUANG B,et al.Free radical scavenging activity of extracts prepared from fresh leaves of selected Chinese medicinal plants[J].Fitoterapia,2004,75(1):14-23.
[23] Halliwell B,Gutteridge JMC,editors.Free radicals in biology and medicine[M].Second Edition.Oxford:Clarendon Press,1989.
[24] Wickens A P.Aging and the free radical theory[J].Resp Physiol,2001,128(3):379-391.
[25] Rees M D,Hawkins C L,Davies M J.Hypochlorite and superoxide radicals can act synergistically to induce fragmentation of hyaluronan and chondroitin sulphates[J].Biochem J,2004,381(Pt 1):175-184.
[26] LI M,Rosenfeld L,Vilar R E,et al.Degradation of hyaluronan by peroxynitrite[J].Arch Biochem Biophys,1997,341(2):245-250.
[27] ZHANG Ning,CHEN Haixia,MA Lishuai,et al.Physical modifications of polysaccharide from Inonotus obliquus and the antioxidant properties[J].Int J Biol Macromol,2013,54:209-215.
[28] Vereyken I J,Chupin V,Demel R A,et al.Fructans insert between the headgroups of phospholipids[J],Biochim Biophys Acta,2001,1510(1-2):307-320.

