秦巴山区黑木耳主要栽培种内原生质体分离与融合
陈文强 , 王 进 , 邓百万 , 彭 浩 , 解修超 , 兰阿峰 ,刘开辉 , 丁小维 , 赵娜娜 , 钱雪婷 , 苏晨曦
(1.陕西理工学院 生物科学与工程学院,陕西 汉中723001;2.陕西省食药用菌工程技术研究中心,陕西 汉中723001)
黑木耳(Auricularia auricula)俗称木耳、细木耳、光木耳、云耳,分类上属层菌纲,木耳目,木耳科,木耳属(Auricularia)。木耳属食用菌不仅含有极高的营养价值和药用价值,同时热量很低,是一种健康美味食药用菌[1]。
原生质体及其融合技术是近年来迅速发展的生物工程育种新技术,空间细胞融合技术、非对称细胞融合技术、离子束细胞融合技术等新进展已应用于原生质体育种,在食用菌遗传育种上已取得了可喜的成绩[2-3]。迄今,国内外学者已从杏鲍菇、白灵菇、平菇、双胞蘑菇、美味牛肝菌、冬虫夏草等50多种食用菌中成功制备原生质体,并结合分子生物学技术就食用菌育种进行了大量的研究,取得了令人瞩目的进展[4-12]。近年来,食用菌原生质体融合技术迅速发展,关于种内、种间及属间原生质体融合都不断有新的进展。2010年,郭成金等[13]采用双亲灭活标记法对冬虫夏草和蛹虫草进行原生质体融合的研究,并利用形态学、颉颃实验及分子手段方法对融合子进行鉴定;2011年,江力等[14]采用原生质体融合及再生对茶树菇和鸡腿菇进行融合,并通过菌落表型的比较和颉颃反应验证再生出的为融合子;2012年,全卫丰等[15]采用化学融合方法对两株不同性状的灵芝菌株进行原生质体融合选育,通过酯酶同工酶筛选富硒高产灵芝;2013年,陈建中等[16]采用双亲灭活原生质体融合技术选育耐低温草菇菌株。
目前,木耳属原生质体方面的研究多数还集中在以黑木耳为材料的原生质体制备及再生条件的探究,采用原生质体化学融合技术对木耳属不同的菌种进行融合的实验尚未成功。基于对秦巴山区黑木耳新科、耳 268、秦单 4#、耳 2、耳 913、神农 A8、耳97-2等7个主要栽培菌株形态特征和核糖体转录间隔区(ITS)的序列分析,确定了各菌株之间的亲缘关系[17],在此基础上,作者对秦巴山区黑木耳主要栽培种神农A8与秦单4#的原生质体进行分离与融合。同时,优化黑木耳菌株原生质体制备、再生及融合的条件,为秦巴山区黑木耳优良菌种的选育提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 神农A8与秦单4#黑木耳栽培菌株:由陕西省资源生物重点实验室食药用菌菌种保藏中心提供。
1.1.2 培养基
CPDA综合培养基:马铃薯200.0 g,葡萄糖20.0 g, 蛋白胨 3.0 g,KH2PO45.0 g,MgSO4·7H2O 3.0 g,VB10.01 g,琼脂 20.0 g,加水至 1 000 mL。
液体培养基:CPDA综合培养基(无琼脂)。
液体再生培养基:液体培养基+109.3 g甘露醇。
原生质体再生培养基 (Regeneration Medium,RM):RM1:马铃薯200.0 g,葡萄糖20.0 g,琼脂20.0 g,加水至 1 000.0 mL;RM2:马铃薯 200.0 g,葡萄糖20.0 g,蛋白胨3.0 g,琼脂20.0 g,加水至1 000.0 mL;RM3:马铃薯 200.0 g,葡萄糖 20.0 g,蛋白胨 3.0 g,KH2PO45.0 g, 琼脂 20.0 g, 加水至 1 000.0 mL;RM4:马铃薯 200.0 g,葡萄糖 20.0 g,蛋白胨 3.0 g,KH2PO45.0 g,MgSO4·7H2O 3.0 g,VB1 0.01 g, 琼脂20.0 g,加水至 1 000.0 mL;RM5:CPDA 综合培养基+109.3 g甘露醇。
1.1.3 主要试剂 稳渗剂:KCl、MgSO4、蔗糖和甘露醇 (浓度为 0.4、0.5、0.6、0.7 mol/L), 磷酸盐缓冲液(0.05 mol/L,pH 5.8);酶液:先用 0.05 mol/L pH 5.8的磷酸盐缓冲液配置渗透压稳定剂,再用该稳渗剂配置浓度为1%、1.5%、2%、2.5%、3%的酶液,用0.22 μm微孔滤膜过滤除菌后备用;融合剂:用渗透压稳定剂(0.5 mol/L甘露醇)将PEG聚乙二醇配置成质量浓度为 30、35、40、45、50、55、60 g/dL 的融合剂,且内含0.05 mol/L CaCl2。
1.1.4 主要仪器与设备 恒温振荡器:ZHWY-210 2C,上海智诚分析仪器制造有限公司;超净工作台:SW-CJ-1F,苏州安泰空气技术有限公司;电子天平:BJ100M,上海精科天美科学仪器有限公司;立式圆形压力蒸气灭菌器:LS-B50L,上海医用核子仪器厂;人工气候箱:LRH-800-GS,韶关市明天环保仪器有限公司;恒温水浴锅:DZKW-S-4,惠州市新旭实业有限公司。
1.2 方法
1.2.1 菌丝培养 向长满黑木耳菌丝的试管菌种中加入5.0 mL液体培养基,用接种针刮去菌种表面全部菌丝,将此带有菌丝的培养液倒入装有40.0 mL液体培养基的三角瓶中,28℃静置培养5~9 d,每天轻摇几次。
1.2.2 菌丝收集 无菌条件下用尼龙网布过滤收集菌丝体,无菌水冲洗一次,无菌滤纸吸干水分,再用稳渗剂冲洗,4℃下5 000 r/min离心10 min,去掉上清液,重复一次。
1.2.3 原生质体的制备 向装有菌丝的离心管中分别添加1.5 mL蜗牛酶液、溶壁酶液及果胶酶液,振荡2 min混匀,在20~40℃水浴中酶解2~4.5 h,每隔一段时间振荡混匀一次。吸取少量酶液,40倍光学显微镜下用血球计数板计数。
1.2.4 原生质体的再生 酶解结束后过滤掉菌丝,无菌管收集滤液,用稳渗剂洗涤离心两次,3 000 r/min离心10 min。向滤液中加入等体积的稳渗剂摇匀,吸取0.1 mL原生质体悬液涂布于再生培养基上。25℃下静置培养10~15 d,观察平皿中的再生菌落数,挑取再生菌株备用。
1.2.5 单核原生质体再生菌株的筛选 光学镜检:配置10%的KOH和3%的刚果红,各滴一滴在载玻片上,加18 mm×18 mm的长有黑木耳菌丝的盖玻片。光学显微镜下观察再生菌株的菌丝,鉴定锁状联合的有无,筛选出没有锁状联合的单核再生菌株。荧光镜检:在长满黑木耳菌丝的盖玻片上加入DAPI进行染色,染色时间为40 min,用蒸馏水冲洗,然后加入荧光增白剂染色4~5 min,再次用蒸馏水冲洗。置于荧光显微镜下,观察染色情况,对样品进行快速照相备用。此方法再次确定再生菌株锁状联合的有无,筛选出没有锁状联合的单核再生菌株。
1.2.6 亲本原生质体的灭活 热灭活标记亲本神农A8:将筛选出来的单核再生菌株神农A8制成的原生质体悬液分别置于40~50℃水浴保温10~30 min,结束后涂布于再生培养基上,25℃避光静置培养10~15 d,记录再生菌落数。每个处理3次重复,设置一组未做热处理的原生质体作对照,确定原生质体热灭活致死临界点;紫外灭活标记秦单4#:将筛选出来的单核再生菌株秦单4#制成的原生质体悬液200 uL涂布于再生培养基上,15 W紫外灯下30 cm处开盖,分别照射1~5 min,照射结束后立即盖紧,黑纸包裹好,25℃避光静置培养10~15 d,记录再生菌落数。每个处理3次重复,设置一组未做紫外灭活处理的原生质体作对照,确定原生质体紫外灭活致死临界点。
1.2.7 原生质体的融合 将两个用不同方式灭活标记的亲本原生质体悬液各1.0 mL混匀离心,弃上清液,加入1.5 mL质量浓度为30~55 g/dL内含0.05 mol/L CaCl2,融合温度为25~40℃,融合时间10~40 min。融合结束立即用稳渗剂洗涤离心两次,稀释后涂布于再生培养基上,记录再生菌落数。
融合率=融合子再生菌落数/原生质体总数。
1.2.8 融合子的鉴定 根据撷抗反应对融合子进行筛选,通过观察菌落表型进行初步鉴定。
2 结果与分析
2.1 原生质体的制备
试验在溶壁酶作用下原生质体的释放量效果最好,释放量神农A8为0.94×107个/mL,秦单4#为1.44×107个/mL,其次为蜗牛酶、果胶酶。因此,选用溶壁酶进行试验。
2.1.1 溶壁酶浓度 选择溶壁酶浓度分别为1.0、1.5、2.0、2.5、3.0 mol/L 进行试验。结果见图 1。 2.0 mol/L时原生质体释放量达最大,黑木耳秦单4#和神农A8原生质体释放量分别为1.44×107、0.94×107个/mL。在一定范围内,原生质体释放量随溶壁酶的浓度增加而升高,当溶壁酶浓度为2.0 mol/L时,原生质体释放量最高,随后随着溶壁酶浓度的增加而降低。因此,黑木耳原生质体制备的最佳溶壁酶浓度为2.0 mol/L。

图1 溶壁酶浓度对原生质体释放量的影响Fig.1 Effect of lywallzyme’s concentration on protoplast yield
2.1.2 酶解时间 选择酶解时间分别为2.0、2.5、3.0、3.5、4.0、4.5 h 进行试验,结果见图 2。 酶解时间为3.5 h时原生质体释放量达最大,黑木耳秦单4#和神农A8原生质体释放量分别为1.38×107、0.88×107个/mL。一定时间范围内,原生质体释放量随酶解时间的延长而增加,酶解时间达到3.5 h后反而会导致原生质体释放量下降。因此,黑木耳原生质体制备的最佳酶解时间为3.5 h。

图2 酶解时间对原生质体释放量的影响Fig.2 Effect of digesting time on protoplast yield
2.1.3 酶解温度 选择酶解温度分别为20、25、30、35、40℃进行试验,结果见图3。酶解温度为30℃时原生质体释放量达最大,黑木耳秦单4#和神农A8原生质体释放量分别为 1.38×107、0.88×107个/mL。对于大多数食药用菌,最佳酶解温度范围是28~34℃。在一定温度范围内,原生质体的释放量呈先上升后下降之趋势,在30℃时达到最大值。低于或高于此温度,酶活力均受影响,从而原生质体的释放量也受影响。 因此,黑木耳原生质体制备的最佳酶解温度为30℃。

图3 酶解温度对原生质体释放量的影响Fig.3 Effect of digesting temperature on protoplast yield
2.1.4 出发菌龄 选择出发菌龄分别为5、6、7、8、9 d进行试验,结果见图4。香菇菌株菌龄为7 d时原生质体释放量达最大,黑木耳秦单4#和神农A8原生质体释放量分别达 1.44×107、0.94×107个/mL。 在一定范围内,随着菌龄的延长,原生质体释放量先增加后下降,在第7天原生质体释放量达最高值。培养时间过长,原生质体释放量随之下降,这与菌体细胞老化以及细胞壁上不易被酶解的物质的沉积及发酵后其细胞活力下降,产生很大比例的非活性个体有关[18]。因此,黑木耳原生质体制备的最佳出发菌龄为7 d。

图4 出发菌龄对原生质体释放量的影响Fig.4 Effect of mycelial age on protoplast yield
2.1.5 渗透压稳定剂种类及浓度 选择渗透压稳定剂分别为KCl、MgSO4、蔗糖和甘露醇,再将最佳的渗透压稳定剂配制成 0.4、0.5、0.6、0.7 mol/L进行试验,结果见图5。利用不同渗透压稳定剂制得的原生质体释放量由多到少的顺序依次为:甘露醇>MgSO4>蔗糖>KCl。图6所示,以甘露醇作为渗透压稳定剂,在0.5 mol/L原生质体释放量达最大。在一定范围内,原生质体释放量随浓度的增加而升高,再随着浓度的增加原生质体释放量反而减少。因此,黑木耳原生质体制备的最佳渗透压稳定剂种类及浓度分别为甘露醇和0.5 mol/L。

图5 渗透压稳定剂对原生质体释放量的影响Fig.5 Effect of osmotic pressure stabilizer on protoplast yield

图6 渗透压稳定剂浓度对原生质体释放量的影响Fig.6 Effect of osmotic pressure stabilizer’concentration on protoplast yield
2.2 原生质体的再生
选择原生质体再生培养基分别为RM1、RM2、RM3、RM4、RM5进行试验。表1表明,在最佳条件下得到的原生质体分别在供试的5种培养基中均能再生,在RM5培养基上生长的神农A8和秦单4#菌落数分别为9和11,再生率分别为1.91%和1.53%;在RM1培养基上生长的神农A8和秦单4#菌落数分别为1和2,再生率分别为0.21%和0.28%。因此,黑木耳原生质体再生的最佳培养基为RM5。

表1 再生培养基对原生质体再生的影响Table 1 Effect of different regeneration medium on the regeneration rate of protoplast
2.3 原生质体单核化
2.3.1 光学镜检 取黑木耳原生质体再生菌株在光学显微镜(40×)下观察菌丝锁状联合的有无,结果见图7。黑木耳菌株秦单4#和神农A8菌丝均无锁状联合。

图7 单核菌丝显微镜检Fig.7 Monocyte hyphae by microscope
2.3.2 荧光镜检 由于木耳菌丝极细,普通光镜下很难确定判断锁状联合。通过荧光染色方法对单核再生菌株进行确定,结果见图8。进一步确定黑木耳菌株秦单4#和神农A8菌丝均无锁状联合。

图8 单核菌丝荧光镜检Fig.8 Monocyte hyphae by fluoroscope
2.4 原生质体灭活标记
目前,灭活标记法被认为是最有适用的通用标记方法。热灭活使核糖体16S亚基受损,细胞内功能蛋白、酶蛋白的结构变形或合成受到影响,从而使原生质体失去再生能力,产生致死作用;紫外灭活破坏细胞核,造成DNA分子结构扭曲,使细胞核变形失活,同时保留其细胞质、蛋白质、氨基酸等活性物质。在原生质体融合时,损伤部位不同的双亲原生质体通过遗传互补相结合,从而达到育种选育之目的[13]。
2.4.1 热灭活标记 取神农A8单核再生菌株原生质体进行热灭活试验,灭活温度分别选择40、45、50℃,灭活时间分别为 10、20、30 min,观察不同热灭活温度、不同灭活时间的原生质体的再生。表2结果表明,当温度达到50℃、时间超过20 min时,没有再生菌落萌发,原生质体可达100%致死效果。因此,神农A8单核再生菌株原生质体热灭活致死临界温度和时间分别为50℃、20 min。

表2 热灭活标记原生质体再生菌落数Table 2 Heat inactivated marker of protoplast regeneration strains
2.4.2 紫外灭活标记 取秦单4#单核再生菌株原生质体进行紫外灭活试验,将原生质体悬液暴露于15 W 紫外灯下分别照射 1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 min,结果见图9。当紫外灭活时间超过3.5 min时,原生质体即可全部致死。因此,秦单4#单核再生菌株原生质体紫外灭活致死临界时间为3.5 min。

图9 紫外灭活致死率Fig.9 Death rate of ultraviolet inactivation
2.5 原生质体融合
2.5.1 PEG质量浓度 选择PEG质量浓度分别为30、35、40、45、50、55 g/dL 内 含 0.05 mol/L CaCl2PEG进行试验,研究其对黑木耳神农A8和秦单4#原生质体融合的影响,结果见表3。

表3 PEG质量浓度对原生质体融合的影响Table 3 Effect of PEG concentration on protoplast fusion
表3结果表明,PEG质量浓度为30 g/dL时原生质体融合成功率较高,融合子再生菌落数为78个。PEG质量浓度在30~60 g/dL间,较适合真菌原生质体的融合。在一定范围内,PEG质量浓度过高时,虽然原生质体的融合机会大增,但质量浓度的增加也使得更多的融合子受到毒害,质量浓度过高会导致原生质体皱缩甚至中毒,融合子存活率降低。因此,原生质体融合的最佳PEG质量浓度为30 g/dL。
2.5.2 融合时间 选择融合时间分别为10、20、30、40 min进行试验,结果见表4。

表4 融合时间对原生质体融合的影响Table 4 Effect of fusion time on protoplast fusion
表4表明,PEG融合30 min时,融合子再生菌落数为65个。PEG融合时间是融合的最关键因素之一,尤其是PEG结合高Ca2+、高pH溶液处理时,时间长短非常重要。PEG溶液加入后,原生质体间即强烈地发生黏着,融合能长时间有效进行。由于PEG有一定的毒性,处理时间过长,会导致原生质体失活;时间过短原生质体融合不稳定。因此,在原生质体充分融合后,必须用稳渗剂及时对其进行离心洗涤。因此,原生质体融合的最佳时间为30 min。
2.5.3 融合温度 选择融合温度分别为25、30、35、40℃进行试验,结果见表5。

表5 融合温度对原生质体融合的影响Table 5 Effect of fusion temperature on protoplast fusion
表5表明,35℃时融合子再生菌落数为72个。在一定范围内,细胞膜在较高温度下流动性增加,PEG黏度下降,有利于原生质体融合;温度超过35℃反而会影响原生质体融合[14]。因此,原生质体融合的最佳温度为35℃。
2.6 融合子的鉴定
2.6.1 融合子与亲本的撷抗反应 黑木耳两亲本菌株和融合子于CPDA培养基中,28℃培养,10~15 d后观察菌丝的撷抗反应,结果见图10。
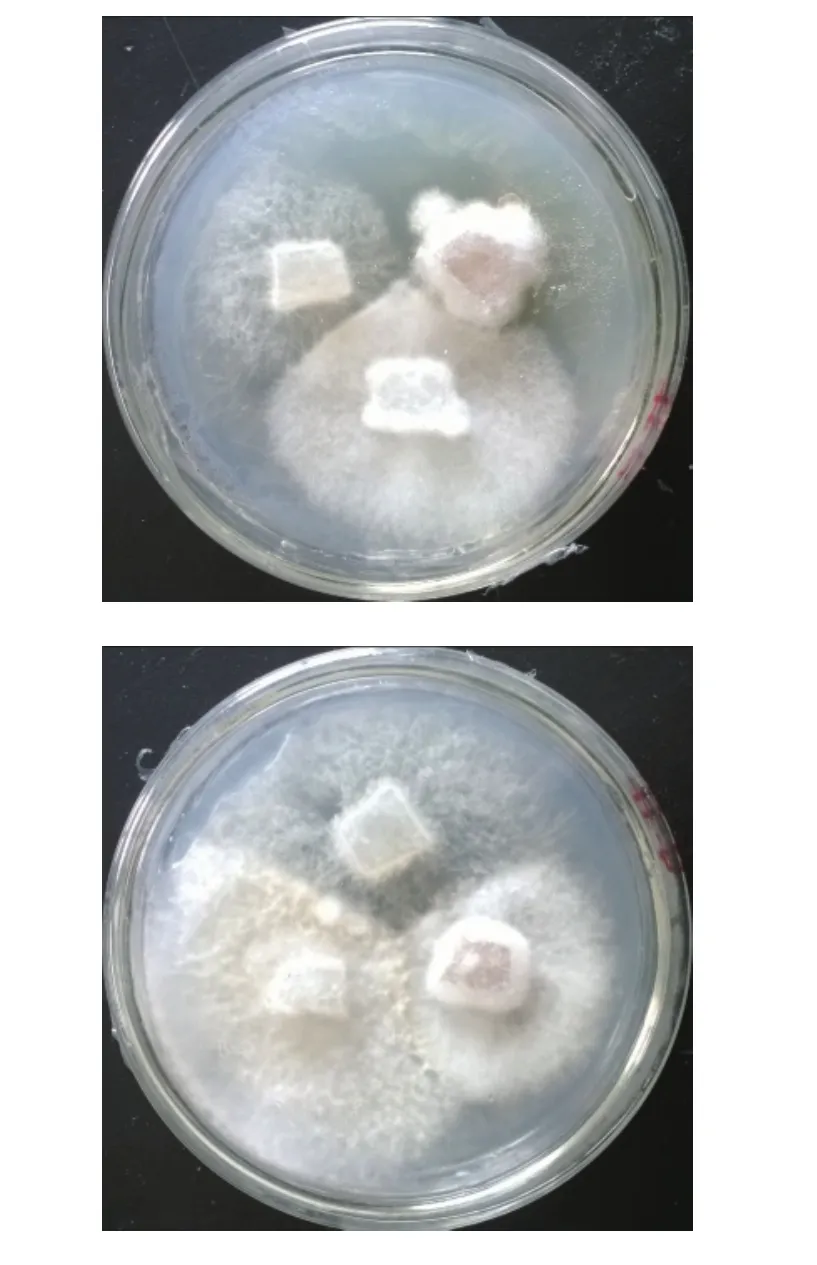
图10 融合子与亲本的撷抗反应Fig.10 Antagonism of fusant and parents
由图10融合子与亲本的撷抗反应可知,融合子与亲本之间产生了明显的撷抗现象,可以确定融合子在原生质体灭活和融合过程中发生了核遗传要素的变异。
2.6.2 融合子再生菌落的表型观察 黑木耳两亲本菌株和融合子于CPDA培养基中,28℃培养,观察菌丝的生长速度、色泽及菌丝密度并记录,结果见表6和图11。

表6 黑木耳菌株菌丝的形态观察Table 6 Mycelia morphology investigation in different Auricularia auricular strains

图11 融合子及两亲本的菌落表型Fig.11 Colonial phynotype observations of the fusant and its parents
表6和图11结果表明,神农A8的菌落边缘较整齐,菌丝较粗,生长速度5.2 mm/d;秦单4#的菌落边缘不规整,菌丝较细,生长速度6.2 mm/d;融合子生长速度6.0 mm/d,介于两者之间。
3 结语
影响原生质体数量的因素很多,包括出发菌龄、溶壁酶浓度、酶解温度及时间、渗透压稳定剂种类及浓度等。研究表明,培养了7 d的黑木耳菌丝体用0.5 mol/L甘露醇做稳渗剂,2.0 mol/L的溶壁酶酶解,30℃下水浴3.5 h所产生的原生质体释放量达最大,神农 A8和秦单 4#分别 0.94×107、1.44×107个/mL。
原生质体的再生受很多因素影响,其中再生培养基组分对其影响最大。研究表明,当再生培养选择RM5时,原生质体再生率达最高。其培养基组分为:马铃薯200.0 g,葡萄糖20.0 g,蛋白胨3.0 g,KH2PO45.0 g,MgSO4·7H2O 3.0 g,VB10.01 g, 琼脂20.0 g,109.3 g甘露醇加水至1 000 mL。
采用双灭活手段对亲本进行遗传标记的关键在于方便挑选融合子和筛选损伤程度最小的临界致死剂量。研究表明,黑木耳原生质体热灭活致死临界温度为50℃,时间为20 min,原生质体紫外灭活致死临界时间为3.5 min。孙露[19]的研究表明,木耳原生质体热灭活致死临界温度为50℃,时间为10 min,原生质体紫外灭活致死临界时间为3 min;贺建超[20]的研究表明,木耳原生质体热灭活致死临界温度为65℃,时间为30 min,原生质体紫外灭活致死临界时间为3 min。这可能是由于黑木耳不同品种的遗传差异所致,所以在应用双亲灭活法进行原生质体融合前要筛选出最适的双亲灭活临界点。
影响原生质体融合的主要因素包括融合剂PEG质量浓度、融合时间及融合温度等。研究表明,使用30%聚乙二醇(PEG4000)和 0.05 mol/L CaCl2溶液 (pH 10)为助融剂,35℃融合30 min效果最好。杨国良采用的电融合法得到毛木耳与黑木耳的融合率为1.7×10-4,是PEG法的50倍左右。但是,电融合法的成本极高,而且操作技术要求比较高,而二者融合的效果基本一致。
根据菌落表现及撷抗反应分析,可得出融合子确系经热灭活标记和紫外灭活标记的黑木耳原生质体融合产物说明,以单核再生菌株原生质体作为亲本,分别采用热灭活和紫外灭活时双亲原生质体进行遗传标记,利用PEG在适宜条件下进行原生质体融合,可得到与双亲遗传性状不同的融合子。作者对秦巴山区黑木耳主要栽培种神农A8和秦单4#进行了原生质体的分离和融合,得到的融合子是否适宜于秦巴山区栽培并表现出优质高产性状有待进一步研究。
[1]陈丽华,章克昌.8味中药对黑木耳发酵的影响[J].食品与生物技术学报,2007,26(5):104-108.CHEN Lihua,ZHANG Kechang.Effects of eight kinds of Chinese traditional medicines on submerged fermentation of Auricularia auricular[J].Journal of Food Science and Biotechnology,2007,26(5):104-105.(in Chinese)
[2]Muralidhar R V,Panda T.Fungal protoplast fusion[J].Bioprocess Engineering,2002,22:429-431.
[3]李守勉,李明,邢蕾,等.食用菌原生质体技术应用的研究[J].安徽农业科学,2007,35(25):7770-7771.LI Shoumian,LI Ming,XING Lei,et al.Application of protoplast technology of edible mushroom [J].Journal of Anhui Agricultural Sciences,2007,35(25):7770-7771.(in Chinese)
[4]刘敏,李娟,周波,等.杏鲍菇原生质体制备与再生条件初探[J].生物技术,2005,15(1):54-55.LIU Min,LI Juan,ZHOU Bo,et al.Separation and regeneration of Pleurotus erygll proto plast[J].Biotechnology,2005,15(1):54-55.(in Chinese)
[5]邓百万,陈文强.美味牛肝菌胞外多糖高产菌株的诱变选育[J].食品与生物技术学报,2006,25(6):49-53.DENG Baiwan,CHEN Wenqiang.Screening of high exopolysaccharide yield strain of Boletus edulis by UV ray[J].Journal of Food Science and Biotechnology,2006,25(6):49-53.(in Chinese)
[6]Yoo Y B,Peerdy,You C H.Studies on protoplast isolation from edible fungi[J].Korean Journal of Mycology,1985,13(1):1-10.
[7]孙溪,郭成金.双孢蘑菇原生质体制备条件的优化[J].天津师范大学学报:自然科学版,2006,26(4):32-35.SUN Xi,GUO Jincheng.Optimizing conditions of preparing Agaricuz bisporus protoplast[J].Tianjin Normal University:College of Chemistry and Life Science,2006,26(4):32-35.(in Chinese)
[8]刘文芳,郭成金.白灵菇原生质体制备与再生研究[J].天津师范大学学报:自然科学版,2012,32(1):88-91.LIU Wenfang,GUO Chengjin.Study on protoplast preparation and regeneration of Pleurtus nebrodensis Lnzenga[J].Tianjin Normal University:College of Chemistry and Life Science,2012,32(1):88-91.(in Chinese)
[9]潘丹丹,肖岩岩,陈超,等.冬虫夏草无性型菌丝体的原生质体制备条件研究[J].安徽农业大学学报,2012,39(5):793-797.PAN Dandan,XIAO Yanyan,CHEN Chao,et al.Conditions for protoplast preparation of Ophiocordyceps sinensis[J].Journal of Anhui Agricultural University,2012,39(5):793-797.(in Chinese)
[10]李省印,李孟楼,胡彩霞,等.平菇种内原生质体分离与融合杂交育种技术及应用[J].西北农业学报,2004,13(14):146-151.LI Shengyin,LI Menglou,HU Caixia,et al.The techniques and application of intraspecific protoplast isolation and fusion crossbreeding in Pleurotus ostreatus[J].Agriculturae Borealioccidentalis Sinica,2004,13(14):146-151.(in Chinese)
[11]范雷法,潘慧娟.食用菌属间原生质体融合研究初报[J].中国食用菌,2005,24(5):21-27.FAN Leifa,PAN Huijuan.Studies on the intergeneric fusion of protoplasts from edible mushrooms[J].Edible Fungi of China,2005,24(5):21-27.(in Chinese)
[12]许美燕,唐传红,张劲松,等.利用SRAP和ISSR建立快速鉴定灵芝属菌株的 SCAR标记[J].菌物学报,2008,27(5):707-717.XU Meiyan,TANG Chuanhong,ZHANG Jinsong,et al.Development of SOAR markers based on SRAP and ISSR for rapid identification of Ganoderma strains[J].Mycosystema,2008,27(5):707-717.
[13]郭成金,赵润,朱文碧.冬虫夏草和蛹虫草原生质体融合初探[J].食品科学,2010,31(1):165-171.GUO Chengjin,ZHAO Rui,ZHU Wenbi.Protoplast Fusion between Cordyceps sinensis and Cordyceps militaris[J].Food Science,2010,31(1):165-171.(in Chinese)
[14]江力,黄健威,慈凌坤,等.茶树菇与鸡腿菇原生质体融合及再生[J].食品科学,2011,32(1):141-144.JIANG Li,HUANG Jianwei,CI Linkun,et al.Protoplast fusion and regeneration of Agrocybe aegerita and Copyinds comatus[J].Food Science,2011,32(1):141-144.(in Chinese)
[15]全卫丰,何静霞,汪洁,等.原生质体融合选育富硒高产灵芝的研究[J].食用菌,2012(3):19-21.JIN Weifeng,HE Jingxia,WANG Jie,et al.Studies on the Ganoderma lucidum rich in selenium by protoplast fusion[J].Edible Fungi,2012(3):19-21.(in Chinese)
[16]陈建中,祝子坪,吴潇,等.双亲灭活原生质体融合技术在草菇耐低温菌株选育上的应用[J].中国农业科技导报,2013,15(5):166-172.CHEN Jianzhong,ZHU Ziping,WU Xiao,et al.Application of inactivated parental strain protoplasts fusion technology in selection of Volvariella volvacea with higher antifreeze capacity[J].Journal of Agricultural Science and Technology,2013,15(5):166-172.(in Chinese)
[17]王进,陈文强,邓百万,等.基于形态特征和ITS序列分析秦巴山区黑木耳主要栽培种的亲缘关系[J].食品与生物技术学报,2014,33(5):535-541.WANG Jin,CHEN Wenqiang,DENG Baiwan,et al.Analysis of the genetic relationships of main Auricularia auricular cultispecies in qinba mountainous area based on ITS sequence[J].Journal of Food Science and Biotechnology,2014,33(5):535-541.(in Chinese)
[18]李楠,许修宏.黑木耳原生质体制备及再生的研究[J].东北农业大学学报,2009,40(7):34-37.LI Nan,XU Xiuhong.Protoplast preparation and regeneration of Auricularia auricula[J].Journal of Northeast Agricultural University,2009,40(7):34-37.(in Chinese)
[19]孙露.木耳属遗传多样性及原生质体育种的研究[D].长春:吉林农业大学,2012.
[20]贺建超,贺榆霞.木耳灭活原生质体融合育种研究[J].中国食用菌,2003,22(5):16-18.HE Jianchao,HE Yuxia.Study on the breeding of Auricularia by inactivated protoplast fusion[J].Edible Fungi of China,2003,22(5):16-18.(in Chinese)

