基于支持向量机和模糊推理的毕赤酵母发酵过程故障诊断
高敏杰 , 丁 健 , 张 许 , 高 鹏
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
甲醇营养型毕赤酵母 (Methylotrophic Pichia pastoris)是一种优良的外源蛋白表达系统,近年来应用十分广泛。此表达系统的优势是它具有强有力的醇氧化酶(AOX1)启动子,可严格调控外源蛋白的表达,但也存在不足之处:一是培养周期相对大肠杆菌较长,二是诱导期对甲醇浓度比较敏感。在诱导阶段,甲醇同时作为碳源、能源和诱导剂,直接影响到细胞生长、氧气消耗、产物生成和外源蛋白的水解[1-5]。将甲醇浓度控制在适宜水平,是目的蛋白高效表达的前提条件。采用气相色谱离线控制甲醇浓度时,虽然检测结果比较准确,但存在检测步骤繁琐、检测时间长和检测结果严重滞后等问题。目前主要采用甲醇电极反馈控制的方法,在线调节发酵罐中甲醇浓度。但甲醇电极容易受环境条件和其他挥发性物质的影响,测量值与实际值会发生偏差,导致发酵液中甲醇偏高或偏低,严重影响发酵过程的稳定性[2]。因此,建立一种有效的过程诊断系统,在线监测甲醇浓度,并在发生故障时采取合适的补救措施,对于提高和稳定目的蛋白的产量非常重要。
主成分分析(PCA)是一种基于线性变换的模式识别和故障诊断方法,应用范围广泛,但是在处理非线性问题上存在明显的局限性。将核函数(Kernel)或自联想人工神经网络 (AANN)与标准PCA相结合,构建的改进型非线性主成分分析方法(NPCA),在处理非线性故障诊断问题时,比标准PCA有更好的效果,但仍存在过度训练,无法识别两种以上故障状态等问题[6-7]。对应上述问题,作者提出了一种基于支持向量机(SVM)和模糊推理的智能型故障诊断系统,用于毕赤酵母发酵生产猪α干扰素(pIFN-α)过程[8]。系统采用SVM的算法构建分类器,并将两个独立的SVM按照二叉树结构组合,用来识别发酵中甲醇浓度的三种状态(过量、适中和匮乏)。采用模糊推理的方法确定报警阈值,可以最终确定发酵状态的类别。随后针对特定故障类型,采取适当的补救措施,可以使得发酵过程恢复正常。
1 材料与方法
1.1 菌株和培养基
巴斯德毕赤酵母Pichia pastoris KM71,MutS菌株:由上海农业科学院畜牧兽医所重点研究室构建,表达载体和外源基因分别为pPICZαA和IFNα cDNA。包括菌株活化培养基、种子培养基、初始培养基、甘油流加培养基和甲醇流加培养基,培养基组成与前期文献报道相同[9]。
1.2 培养方法
发酵过程在5 L发酵罐(Biotech-2002,上海保兴生物设备工程有限公司)中进行,初始装液量为1.5 L,接种体积分数为10%,调节搅拌转速将DO维持在10%以上,发酵过程中温度始终控制在30℃,生长期和诱导期pH分别控制在6.0和5.5。菌体先在发酵初始培养基上生长10~12 h,当甘油耗尽,DO迅速上升时,采用DO-Stat法流加甘油培养基,使菌体继续生长。当菌体浓度达到诱导条件(120~130 g/L左右)后,停止流加甘油,进行1~2 h的“饥饿培养”,使酵母细胞将发酵液中残留的甘油和其他可能充当替代碳源的中间代谢物质全部消耗。之后进入诱导期,开始诱导外源蛋白表达。
1.3 数据采集
利用甲醇电极在线测量发酵液中的甲醇浓度,同时利用尾气分析仪测量发酵尾气中的O2和CO2分压并计算耗氧速率 (OUR)和CO2生成速率(CER)[10],利用电子天平在线记录甲醇的质量变化,通过计算单位时间内甲醇的添加量得到甲醇流加速率 (MFR)。所有数据通过A/D数据转换卡或RS232通信串口传输并保存于工控机中。
1.4 分析方法
1.4.1 细胞浓度的测定 用单位体积发酵液的细胞干重表示,采用比浊法测定[11]。
1.4.2 甲醇浓度的离线测定 采用气相色谱法[9]。
1.4.3 pIFN-α抗病毒活性的测定 pIFN-α抗病毒活性测定参考中国药典,详细步骤见文献[11]。本部分实验在上海农业科学院畜牧兽医研究所进行。
1.5 分类器和故障诊断系统的构建
1.5.1 分类器的构建 支持向量机(SVM)算法是一种性能良好的分类算法,SVM的学习样本可以表示为(Yi,zi),向量Yi表示第 i组样本的输入特征[12]。本文中,Yi是一个5维向量,包括以下五个在线过程参数:发酵时间(T)、搅拌转速(AT)、甲醇流加速率 (MFR)、CER 和 OUR,即 Yi=[T,AT,MFR,CER,OUR]i。这5个参数综合体现了随着发酵时间的进行细胞在诱导期的生理状态变化(甲醇匮乏、适中或者过量),但它们之间的关系非常复杂,需要建立智能模型进行识别。zi表示Yi对应的特征标签,取值为“+1”、“0”或“-1”,表示 Yi的类别,见图 1。
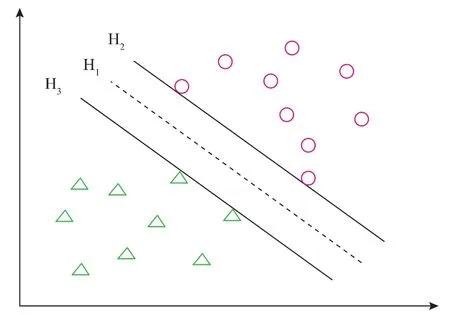
图1 SVM分类Fig.1 SVM classification
如图1所示,超平面H1将样本点分为两类,H1由WX+b=0表示,H2和H3是一对平行的超平面,分别被定义为WX+b=1和WX+b=-1。SVM算法的目的是在保证二者均能对样本点进行正确分类的前提下,最大化它们之间的距离2/‖W‖,即最小化1/2‖W‖2,从而求解出分类超平面H1。若分类正确,则所有的样本 Xi(i=1,2,……,N)均应满足 yi×(WXi+b)≥1,H1的求解过程可以用下述参数优化问题表示:
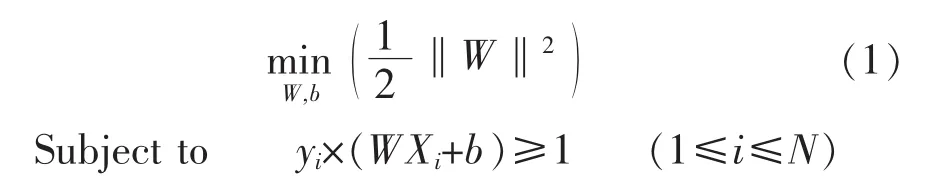
引入松弛变量ξi、惩罚因子C和拉格朗日乘子αi、βi,然后分别对 W、b、αi和 βi并求偏导,并将偏导置零,原问题可转化为:
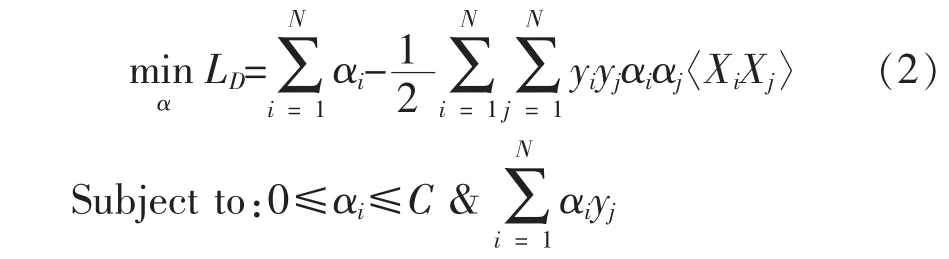
对未知X分类的判别函数如下:
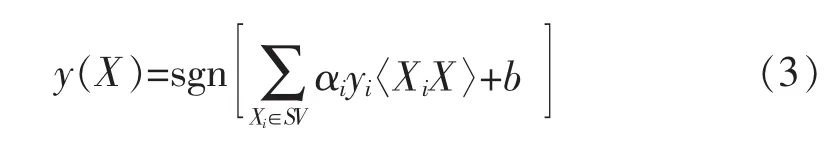
如果X在原有特征空间内不是线性可分的,则可以利用核函数K(Xi,X),将其映射至更高维的特征空间中再进行分类,本文所用的核函数是最常用的径向基(Radial basis function,RBF)核函数。 核函数和映射后的判别函数分别如式4—5所示:
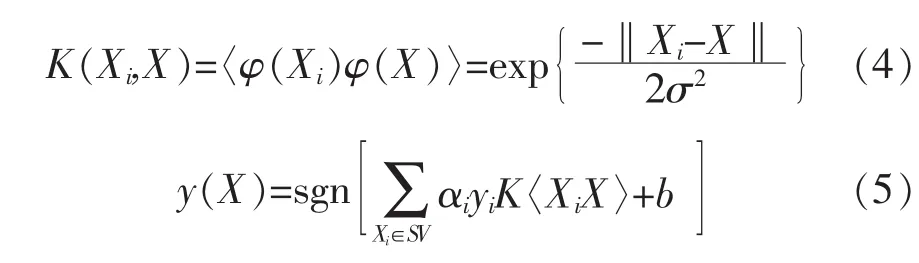
标准SVM分类器只能将样本分为两类,而本文中的分类问题涉及3种发酵状态的判别。因此,需要构建一种由两个单一的SVM子分类器组成的二叉树结构的分类器,用来解决上述多类别分类的问题[8]。 首先将样本特征 Yi=[T,AT,MFR,CER,OUR]i输入第一个子分类器中,可以将样本分为“正常”与“异常”两类,“正常”用“0”表示。 “异常”的样本进入第二个分类器,进一步分为“匮乏”和“过量”两类,分别用“-1”和“+1”表示。
1.5.2 故障诊断系统的构建 通过单一采样点的样本特征判断发酵过程总体状态时,误判的可能性很大,因此选取了一段连续的时间作为时间窗口,包含若干个采样点。将整个时间窗口输入上述分类器,可以返回等同于采样点个数的标签,但由于存在外部干扰,3个标签(-1、0和+1)各占一定比例。于是又引入了模糊推理技术,为报警界限/阈值的选择提供理论依据,解决多个分类标签判别发酵状态的问题[12]。具体判别过程如下:首先,利用三角型模糊成员函数将“-1”、“0”和“+1”所占的比例分为“低(Low)”和“高(High)”两个水平,再根据“-1”、“0”和“+1”所占的百分比,计算出输入变量模糊成员函数的隶属度。将甲醇浓度设为模糊推理的输出,取值范围为-1~+1,并用3个三角型的模糊成员函数表示 其 3 个 水 平 :“匮 乏 (Shortage,S)”、“适 中(Medium,M)”和“过量(Excess,E)”,然后采用传统Min-Max法则解模糊化。构建如下的模糊规则:
Rule#1:If label “-1” is High&label “+1” is Low&label“0” is Low,Then biotin is in Shortage(-1);
Rule#2:If label“-1” is Low&label“+1” is High&label“0”is Low,Then biotin is in Excess(+1);
Rule#3:If label “-1”is Low&label “+1”is Low&label“0” is High,Then biotin is Medium(0).
该故障诊断系统的构建过程全部使用Matlab软件编写程序实现,该系统的运行流程见图2。
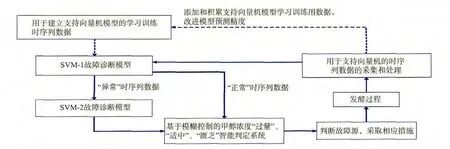
图2 基于SVM和模糊推理的故障诊断系统运行流程Fig.2 Diagram of the fault diagnosis system incorporating SVM model and fuzzy logic reasoning
2 结果与分析
2.1 诱导期不同甲醇浓度控制水平下毕赤酵母的发酵模式
毕赤酵母发酵过程通常分为3个阶段:甘油分批培养阶段、甘油流加阶段和甲醇诱导阶段,前两个阶段总称为细胞生长期,目的是为了得到高密度的酵母细胞,甲醇诱导阶段向发酵罐中流加甲醇培养基,诱导外源蛋白表达[13]。已有文献报道表明,甲醇浓度是影响外源蛋白表达的一个非常重要的因素。在诱导阶段,无论重组毕赤酵母的甲醇利用表型如何,甲醇浓度都需要严格加以控制。浓度过低则诱导强度不够,目标蛋白分泌量少;而浓度过高则会对细胞产生毒害作用,抑制细胞生长,最终影响外源蛋白表达[14]。
一般情况下,OUR和生物量(的变化)可以看成是反映细胞代谢活性的重要状态参数,在改变甲醇浓度控制水平的同时,对OUR及生物量的变化模式也进行了跟踪监测[15]。在甲醇浓度匮乏、适中以及过量的条件下,pIFN-α抗病毒活性和OUR的变化模式见图3。当甲醇质量浓度适中时,细胞适应甲醇诱导环境后,整个诱导阶段OUR和生物量均相对高而且稳定,分别为 250 mmol/(L·h)和 120 g/L,发酵液中的pIFN-α蛋白活性最高,达到5.0×106IU/mL。甲醇浓度匮乏的批次中,细胞代谢活性较低(OUR在 200 mmol/(L·h)左右的低水平徘徊),导致诱导强度严重不足,生物量呈现缓慢下降趋势,整个诱导期的pIFN-α抗病毒活性较低,最高抗病毒活性只有1.6×104IU/mL。甲醇浓度过量的条件下,OUR在经历了一个高峰期(12 h)后便开始逐渐下降、最后在 130 mmol/(L·h)左右的低水平上波动,生物量也逐渐降低,最终达到90 g/L左右。这说明在高甲醇质量浓度下,细胞代谢活性受到较大损坏,pIFN-α抗病毒活性也未能得到提高,最高值停留在8.6×104IU/mL 的水平。
由此可见,在诱导表达阶段,甲醇质量浓度对pIFN-α抗病毒活性影响很大,不同甲醇质量浓度下细胞的代谢活性也存在着很大差异。在诱导阶段,控制甲醇质量浓度于一适中的水平(约10 g/L)是实现pIFN-α高效表达的关键。在此甲醇质量浓度下,细胞代谢活性强、OUR高且稳定。诱导过程中甲醇质量浓度过低(0~5 g/L)或者过高(15~20 g/L)均不利于pIFN-α的表达,细胞的代谢活性较弱。
2.2 基于SVM-BTA/FUZZY模型的毕赤酵母发酵在线故障诊断结果
将SVM-BTA/FUZZY故障诊断系统用于毕赤酵母发酵过程的故障诊断。设定时间窗口长度为1 h,数据采集间隔为1 min,每个移动时间窗口中含有60组发酵在线数据。每次采集后,都会将最新的数据添加入时间窗口中,而将其中最早的一组数据去除,之后将更新后的移动时间窗口输入故障诊断系统中判断当前的发酵状态。
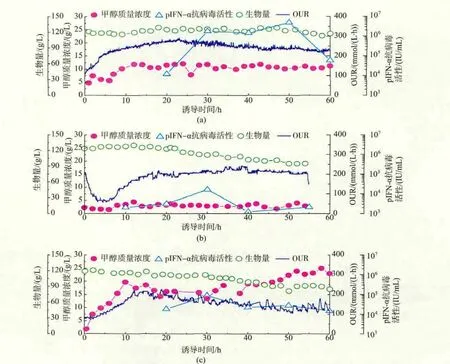
图3 诱导阶段不同甲醇质量浓度控制水平下的pIFN-α活性、生物量和OUR变化趋势Fig.3 Changing patterns of pIFN-α antiviral activity,biomass,OUR during induction phase,when setting methanol concentration at different predetermined levels
设计了3个批次诱导阶段甲醇质量浓度控制水平各不相同的毕赤酵母发酵实验用来检验上述故障诊断系统的性能。批次1中,甲醇质量浓度控制在10 g/L左右,处于一适中水平。批次2是故意造成的诱导强度严重不足的批次,甲醇质量浓度处于较低的0~5 g/L水平。批次3中,甲醇质量浓度较高,平均质量浓度超过15~20 g/L,是典型的甲醇“过量”的发酵批次。这3个批次中pIFN-α抗病毒活性及生物量变化情况如图 4(b)、4(d)、4(f)所示,发酵正常的批次(批次1)pIFN-α抗病毒活性强,生物量高且稳定,达到120 g/L。而发酵异常的批次无论是pIFN-α抗病毒活性还是生物量的情况均与正常批次有明显的差异,批次2和批次3的pIFN-α抗病毒活性最终只达到 8.9×103IU/mL和 2.3×104IU/mL。 如图 4 (a)、4 (c)、4 (e) 所示,SVM-BTA/FUZZY故障诊断系统能够快速准确地识别出3个批次毕赤酵母发酵的状态。批次1中,SVM-BTA/FUZZY故障诊断系统的输出值在整个诱导期内(0~60 h)始终维持在-0.224 4~+0.224 4的范围内,这表示发酵状态的识别结果为甲醇浓度“适中”。在批次2中,诊断程序开始运行后,SVM-BTA/FUZZY系统的输出值在1 h内迅速上升,并最终稳定在+0.673 3的范围内,一直维持到60 h发酵结束,表明该批次的诊断结果为甲醇质量浓度 “过量”。在批次3中,发酵0 h开始运行诊断程序后,SVM-BTA/FUZZY系统的输出结果很快下降至-0.673 3,并一直维持至60 h发酵结束,这表明该批次的诊断结果为甲醇质量浓度 “匮乏”。通过比较SVM-BTA/FUZZY故障诊断系统在上述3个发酵批次中的诊断性能,可以得出结论:由于SVM-BTA/FUZZY系统响应速度快,状态识别准确,鲁棒性强,可以作为识别毕赤酵母发酵故障的有效工具。以该系统为基础,可以进一步研究毕赤酵母发酵的故障排除系统。
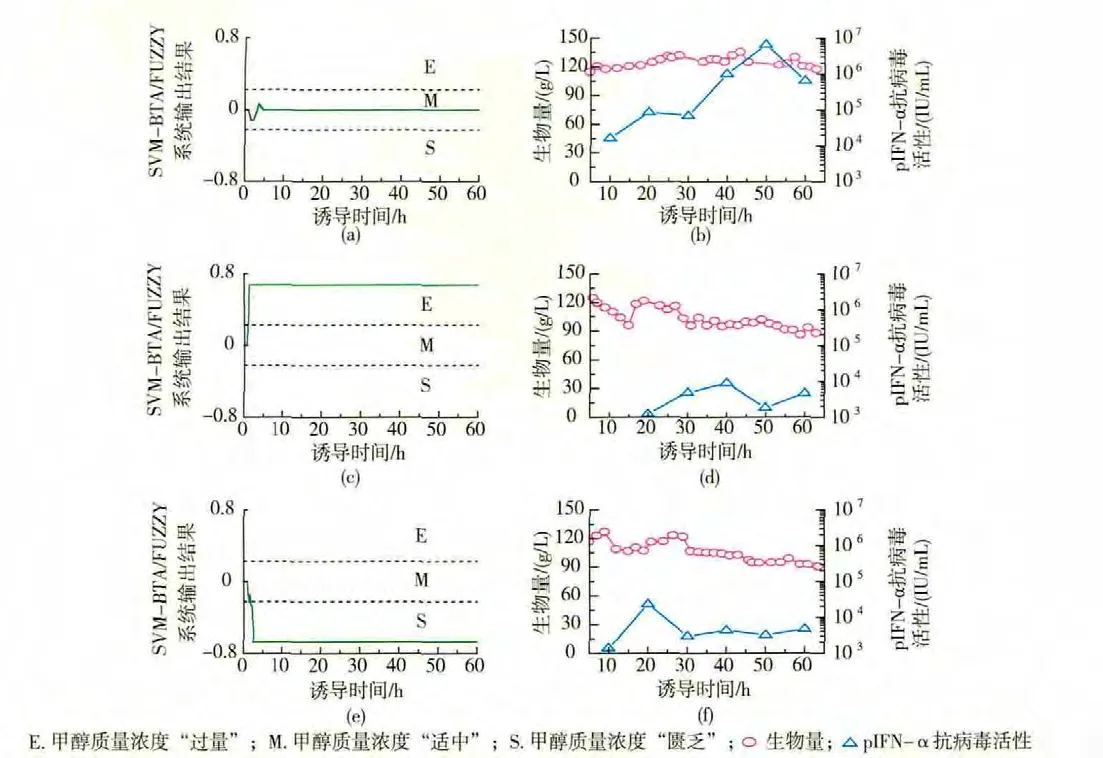
图4 利用SVM-BTA/FUZZY故障诊断系统在线识别诊断毕赤酵母发酵故障Fig.4 On-line diagnosis results when using SVM-BTA/FUZZY diagnosis system for different fermentations with/without faults
2.3 利用SVM-BTA/FUZZY故障诊断系统挽救“错误”发酵,稳定发酵性能
一个良好的在线发酵故障诊断和排除系统应当具备如下特点:1)能够在发酵早期检测出故障;2)在检测出故障的同时能够识别故障的种类;3)能够采取适当的补救措施使得发生故障的发酵批次恢复正常。在下面的实验中,人为设计了两个具有不同故障的发酵批次(批次4和批次5),并将上述的SVM-BTA/FUZZY故障诊断系统用于这两个批次的在线诊断,根据诊断结果及时采取相应的补救措施,以检验SVM-BTA/FUZZY系统在故障诊断以及故障排除过程中的性能。在批次4中,故意制造甲醇质量浓度控制水平“匮乏”的故障,甲醇质量浓度处于较低的0~5 g/L水平。在诱导0 h启动故障诊断系统,诱导1 h故障诊断系统的输出值收敛于-0.673 3,即输出的类别标签为“S”。 发酵3 h,故障诊断系统已经连续输出类别标签“S”超过1 h,有理由相信发酵确实处于甲醇质量浓度“匮乏”的状态,因此向发酵液中添加适量的甲醇以提高甲醇质量浓度。如图5(a)所示,在加入甲醇之后,故障诊断系统的输出值开始迅速上升并最终稳定于0.000 0,输出的类别标签也转变为“M”,这一诊断结果一直持续至发酵结束。如图5(c)所示,在加入甲醇后,pIFN-α抗病毒活性明显提高,最高达到2.0×106IU/mL的正常水平。
在批次5中,故意制造甲醇质量浓度“过量”的故障,平均质量浓度为15~20 g/L。仍然在诱导0 h启动故障诊断程序,发酵故障在6 h被诊断出。直至诱导7 h,SVM-BTA/FUZZY系统的输出值稳定于+0.673 3的水平超过1 h,可以确认发酵状态确实被诊断为甲醇质量浓度“过量”。因此,在这一时刻采取相应的补救措施,暂停流加甲醇,同时为了增强细胞活性,开始以 2 g/(L·h)速度添加甘油,使得发酵恢复正常的有效补救措施。如图5(b)所示,在暂停流加甲醇之后,SVM-BTA/FUZZY系统的输出值快速下降,重新回到并稳定在0.00 00,发酵状态的识别结果转变为甲醇质量浓度“适量”,并持续至诱导结束。该批次pIFN-α抗病毒活性变化情况见图5(d)。在停止流加甲醇之后,pIFN-α抗病毒活性逐渐升高,最高达到3.2×106IU/mL的较高水平。这说明如果能及时采取补救措施,原本可能失败的发酵批次仍然可以恢复正常。从这两个批次的验证实验中可以看出,SVM-BTA/FUZZY发酵故障诊断/排除系统能够及时发现甲醇质量浓度不适宜的故障,并采取有效的补救措施使得发酵过程恢复正常,提高了毕赤酵母发酵生产的稳定性。
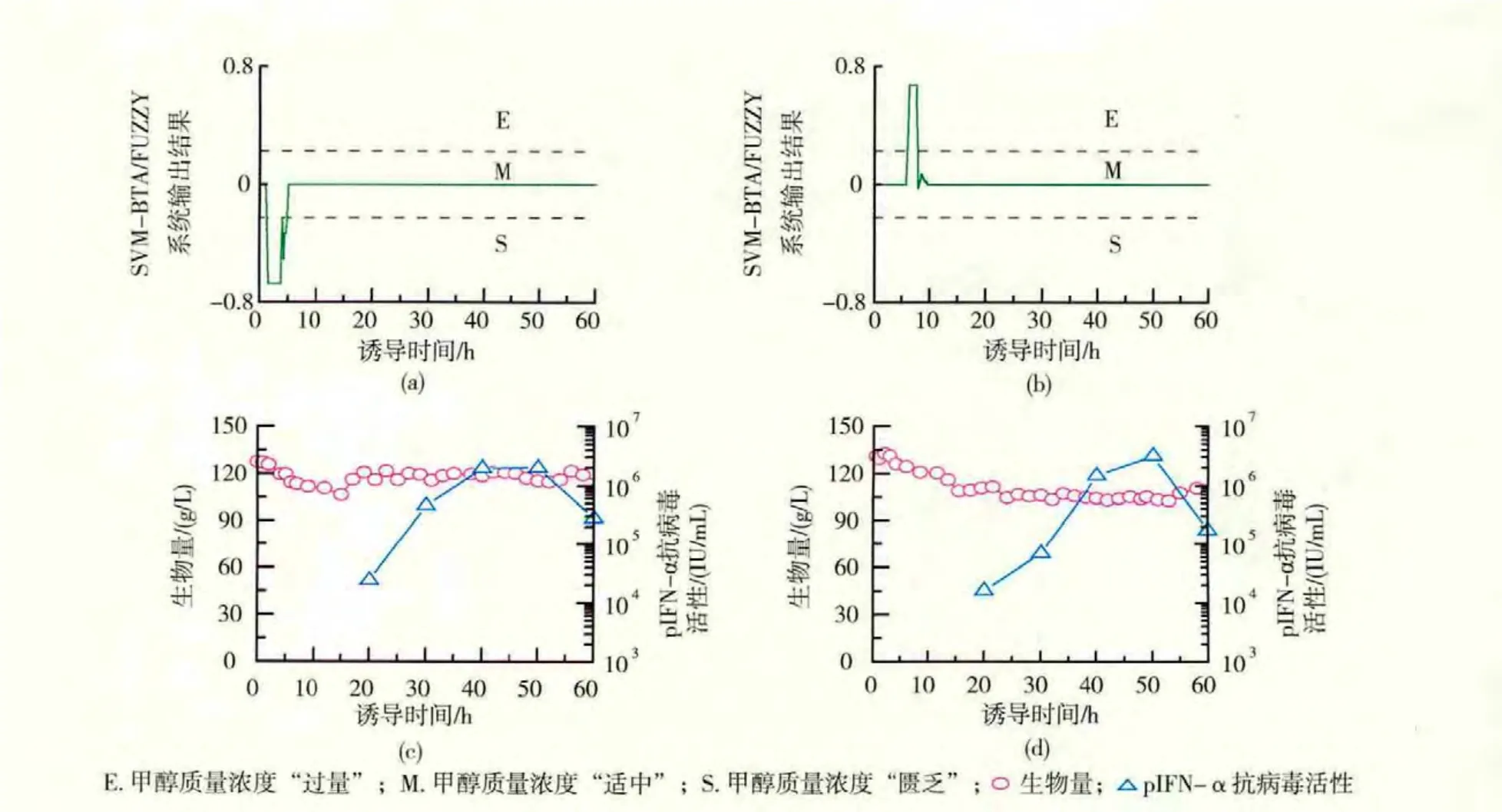
图5 发酵故障的在线诊断及排除Fig.5 On-line fermentation faults diagnosis and rescue
图3所示的甲醇质量浓度“适中”、“匮乏”以及“过量”的状态下的发酵过程参数具有明显的差异,甚至仅仅通过观察OUR的大小就可以判断发酵状态,但利用智能型故障诊断系统识别并排除发酵故障仍是十分有必要的。原因如下:1)图3中所包含的发酵异常条件下的数据均是在故障极其严重的极端条件下采集得到的,这才会导致各发酵状态下过程参数的差异如此明显。在实际的发酵生产中,大多数异常批次的过程参数所表现出的特点并没有图3中所示的那样明显,而是处于一个中间状态,通过简单的观察很难发现其中的规律。2)在诱导初期,故障批次和正常批次过程参数的差异不大,即便是发生了极其严重的故障,也很难通过直接观察来判断。当操作人员通过观察发现故障时,说明故障的现象已经很明显,已错过了采取补救措施的最佳时机。3)由于发酵过程参数对外部操作(例如添加消泡剂、酸、碱等)的干扰十分敏感,因此仅依靠某个单独的过程参数的高低来判断发酵状态是不可靠的。4)某一个参数或多个参数的大小关系很容易确定,但是要获得这些参数变化模式的信息,仅仅依靠简单的观察很难实现。综上所述,本研究中所提出的SVM-BTA/FUZZY智能型故障诊断系统能够增强故障判断的准确性和鲁棒性,对于那些故障信息以及菌体生理状态不是很明显的中间状态的识别十分有效。
2.4 不同甲醇质量浓度控制水平对代谢途径关键酶AOX的影响
醇氧化酶 (AOX)是催化甲醇代谢和外源蛋白合成表达的第一个关键酶,其活性高低直接影响甲醇的消耗速率、细胞代谢活性以及外源蛋白(pIFN-α)抗病毒活性[16]。甲醇质量浓度是影响AOX活性和发酵生产性能的重要操作参数。研究表明,合适的甲醇质量浓度水平是实现pIFN-α高效表达的前提。分别控制甲醇质量浓度在“适中”、“过量”以及“匮乏”的条件下,所得关键酶AOX的活性变化见图6。结果表明,诱导期甲醇质量浓度的控制水平高低会对AOX酶的活性造成显著的影响。在发酵过程中,甲醇质量浓度“适中”条件下的AOX酶活性明显高于另外两个条件,在40 h时达到最高为16.3 U/g。甲醇浓度“匮乏”和“过量”条件下AOX酶活性都很低,即使达到的最高值也处于甲醇质量浓度“适中”时的最低水平。分析结果发现,由于甲醇质量浓度控制水平不当,细胞遭遇到长时间的高质量浓度或低质量浓度的甲醇环境,使得AOX酶的活性受到强烈的抑制,AOX无法正常启动。甲醇质量浓度“匮乏”和“过量”条件下,pIFN-α无法正常表达、发酵性能不稳定的根本原因就在于此。
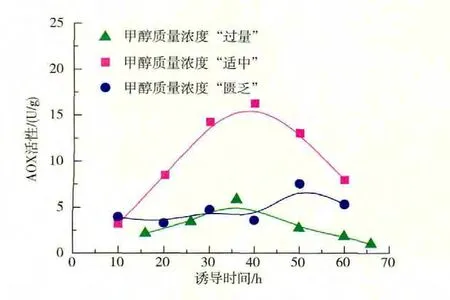
图6 不同甲醇质量浓度控制水平对AOX活性的影响Fig.6 Effects of methanol concentrations at different predetermined levels on the activities
3 结语
构建基于SVM和模糊推理的智能型故障诊断系统,用于识别毕赤酵母发酵诱导期甲醇质量浓度“匮乏”、“适中”和“过量”3种发酵状态模式。该系统可以在诱导初期准确识别故障的发生和类型,根据诊断结果对故障批次采取补加甲醇或停止流加甲醇、补加甘油的补救措施。通过有效的补救,上述故障诊断系统的识别结果逐渐返回到甲醇质量浓度“适中”的范围内,所有发酵批次的pIFN-α抗病毒活性均达到2.0~5.0×106IU/mL的正常水平,发酵稳定性显著提高。
[1]Cos O,Ramon R,Montesinos J L,et al.Operational strategies,monitoring and control of heterologous protein production in the methylotrophic yeast Pichia pastoris under different promoters:A review[J].Microb Cell Fact,2006,5:17-36.
[2]Katakura Y,Zhang W H,Zhuang G Q,et al.Effect of methanol concentration on the production of human β2-glycoprotein I domain V by a recombinant Pichia pastoris:a simple system for the control of methanol concentration using a semiconductor gas sensor[J].J Ferment Bioeng,1998,86(5):482-487.
[3]Wu D,Yu X W,Wang T C,et al.High yield rhizopus chinenisis prolipase production in Pichia pastoris:impact of methanol concentration[J].Biotechnol Bioprocess Eng,2011,16(2):305-311.
[4]Wu D,Chu J,Hao Y Y,et al.High efficient production of recombinant human consensus interferon mutant in high cell density culture of Pichia pastoris using two phases methanol control[J].Process Biochem,2011,46(8):1663-1669.
[5]Qureshi M S,Zhang D,Du G,et al.Improved production of polygalacturonate lyase by combining a pH and online methanol control strategy in a two-stage induction phase with a shift in the transition phase[J].J Ind Microbiol Biotechnol,2010,37(4):323-333.
[6]Kramer M A.Nonlinear principal component analysis using auto-associative neural networks[J].AIChE J,1991,37:233-243.
[7]Webb A R.An approach to nonlinear principal component analysis using radially symmetric kernel functions[J].Statics Comput,1996,6:159-168.
[8]Cheong S.Support vector machines with binary tree architecture for multi-class classification[J].Neural Inform Process,2004,2(3):47-51.
[9]Gao M J,Li Z,Yu R S,et al.Methanol/sorbitol co-feeding induction enhanced porcine interferon-α production by P.pastoris associated with energy metabolism shift[J].Bioprocess Biosyst Eng,2012,35(7):1125-1136.
[10]Shi H D,Shimizu K.On-line metabolic pathway analysis based on metabolic signal flow diagram [J].Biotechnol Bioeng,1998,58:139-148.
[11]Yu R,Dong S,Zhu Y,et al.Effective and stable porcine interferon-α production by Pichia pastoris fed-batch cultivation with multi-variables clustering and analysis[J].Bioprocess Biosyst Eng,2010,33(4):473-483.
[12]Ding J,Cao Y,Mpofu E,et al.A hybrid support vector machine and fuzzy reasoning based fault diagnosis and rescue system for stable glutamate fermentation[J].Chem Eng Res Des,2012,90(9):1197-1207.
[13]Calik P,Inankur B,Soyaslan E S,et al.Fermentation and oxygen transfer characteristics in recombinant human growth hormone production by Pichia pastoris in sorbitol batch and methanol fed-batch operation[J].J Chem Technol Biotechnol,2010,85(2):226-233.
[14]Gao M J,Shi Z P.Process control and optimization for heterologous protein production by methylotrophic Pichia pastoris[J].Chinese J Chem Eng,2013,21(2):216-226.
[15]Gao M J,Zhan X B,Zheng Z Y,et al.Enhancing pIFN-α production and process stability in fed-batch culture of Pichia pastoris by controlling the methanol concentration and monitoring the responses of OUR/DO levels[J].Appl Biochem Biotechnol,2013,171(5):1262-1275.
[16]Jin H,Liu G Q,Ye X F,et al.Enhanced porcine interferon-α production by recombinant Pichia pastoris with a combinational control strategy of low induction temperature and high dissolved oxygen concentration[J].Biochem Eng J,2010,52(1):91-98.

