南方鲇饲用嗜酸乳杆菌微囊化研究
许青莲, 邢亚阁*, 车振明, 蒋 丽, 张丽珠, 蔡义民
(1.西华大学生物工程学院食品生物技术重点实验室,四川成都 610039;2.日本农业科学国际研究中心,日本筑波 30528686)
嗜酸乳杆菌(Lactobacillus acidophilus)是动物肠道有益微生物之一,可以维持肠道正常菌群的生态平衡,增强机体免疫力,促进消化,合成氨基酸和维生素等。嗜酸乳杆菌还可阻止病原菌对肠道的入侵和定植,防止多种疾病和不良反应的发生,在机体中发挥着重要的生理作用。但是,由于嗜酸乳杆菌对环境因素(氧、水分和高温)、机械挤压、热激以及胃酸等都非常敏感,稳定性较差,极大地限制了它的广泛应用(赵瑞香,2007)。
微囊化技术是用特殊手段将固体、液体、气体等物质包埋在一个微小封闭的胶囊内的技术,改变物质的色泽、形状、耐热性和储藏性等(吴晓,2011)。目前,利用微囊化制备技术保护益生菌是国内外研究的热点之一,它能显著提高益生菌抗热、抗压和抗胃酸能力,使其以活性状态到达肠道,发挥功效。该技术还能保护益生菌免受噬菌体的侵害,提高其在冷冻干燥过程中的存活,增加贮藏过程中的稳定性(张志焱,2012)。
本研究以多孔淀粉、甘油、葡萄糖、甘露醇四种不同物质作为保护剂,利用真空冷冻干燥技术制成微胶囊,研究这四种不同保护剂对制作微生态制剂的影响,并对其外观形态和稳定性能等进行了研究。
1 材料与方法
1.1 主要试验材料、试剂与仪器 嗜酸乳杆菌,购于中国工业微生物菌种保藏管理中心(CICC 6075);多孔淀粉由辽宁立达生物科技有限公司提供;甘油由常州市无明化工有限公司提供;葡萄糖由常州市金文化工有限公司提供;甘露醇由郑州康源化工有限公司提供;Heto lyolab3000型冷冻干燥机 (丹麦Heto公司);JSM-7500F扫描电镜(日本电子株式会社)。
1.2 试验方法
1.2.1 嗜酸乳杆菌微生态制剂制备工艺 取样品菌粉1 g,溶于100 mL 2%葡萄糖溶液(已灭菌)中,37℃静置活化30 min,然后以无菌方式按5%的接种量接种于MRS液体培养基(已灭菌)中,摇匀,(37±1)℃恒温培养 18 h。将离心后的菌体用灭菌后的生理盐水适当稀释,调整活菌浓度至108cfu/mL,以备用。在无菌操作条件下,称取一定量的保护剂于烧杯中,加入浓度为108cfu/mL菌悬液50 mL,用氢氧化钠和盐酸调整pH值为6.0后,在20℃无菌条件下振荡40 min,至完全吸附,加入2%海藻酸钠溶液(无菌),搅拌均匀。用胶头滴管将制作好的保护剂溶液挤入2%的氯化钙溶液(无菌)中,固化30 min成膜。用3.5%氯化钙溶液浸泡10 min进行硬化。过滤取得样品,用清水漂去表面的氯化钙残液,再用灭菌的生理盐水(0.85%)洗涤微胶囊表面菌体。在-40℃的超低温冰箱中预冻4 h以上,然后在温度为-58℃的冷冻干燥机进行冷冻干燥24 h,使其水分含量小于3%,即得嗜酸乳杆菌微生态制剂,将冻干后的微胶囊进行真空包装,在4℃冰箱中保藏。
1.2.2 单因素试验 多孔淀粉用量对包埋率的影响:配制活菌浓度为108cfu/mL 50 mL的菌液于250 mL烧杯中,调pH为6.0,加入无菌的多孔淀粉作为保护剂,加入量分别为2.0、3.0、4.0、5.0、6.0 g,然后按1.2.1所述工艺制备微生态制剂,分析不同淀粉加入量对包埋率的影响。
葡萄糖用量对包埋率的影响:配制活菌浓度为108cfu/mL 50 mL的菌液于250 mL烧杯中,调pH为6.0,加入无菌的葡萄糖作为保护剂,加入量分别为 2.0、3.0、4.0、5.0、6.0 g, 然后按 1.2.1 所述工艺制备微生态制剂,分析不同葡萄糖加入量对包埋率的影响。
甘油用量对包埋率的影响:配制活菌浓度为108cfu/mL 50mL的菌液于250 mL烧杯中,调pH为6.0,加入无菌的甘油作为保护剂,加入量分别为 1.0、2.0、3.0、4.0、5.0 mL, 然后按 1.2.1 所述工艺制备微生态制剂,分析不同的甘油加入量对包埋率的影响。
甘露醇用量对包埋率的影响:配制活菌浓度为108cfu/mL 50 mL的菌液于250 mL烧杯中,调pH为6.0,加入无菌的甘露醇作为保护剂,加入量分别为 1.0、2.0、3.0、4.0、5.0 mL, 然后按 1.2.1 所述工艺制备微生态制剂,分析不同的甘露醇加入量对包埋率的影响。
1.2.3 正交试验 根据单因素试验结果,选择多孔淀粉、葡萄糖、甘油、甘露醇用量4个因素分别设置了3个水平,并特设了一个零水平,因素与水平见表1。

表1 因素与水平
1.2.4 包埋率测定 包埋的活菌数与原始活菌数的比率即为包埋率。微胶囊包埋效果的测定采用曹永梅等(2002)的方法进行。活菌计数依据GB 4789.35-2010标准进行。
1.2.5 形态表征 在扫描电镜样品台上贴上双面胶,均匀粘贴少量微生态制剂粉末。然后喷金,采用JSM-7500F SEM观察,电压为12kV,观察微生态制剂的形貌。
1.2.6 贮存稳定性分析 将冻干的微生态制剂分别置于0、4、25、37℃的条件下贮存6周,每隔一周取样,测定微生态制剂中的活菌数,以此来评价其贮存稳定性和最佳贮存温度。
2 结果与分析
2.1 单因素试验
2.1.1 多孔淀粉用量对微胶囊化的影响 由图1可知,随着多孔淀粉用量的增加,包埋率先增加后降低,当多孔淀粉用量在5 g时,制剂的包埋效果最好。多孔淀粉颗粒的孔洞对嗜酸乳杆菌有一定的容纳数量,即饱和度,当达到该饱和度时,多孔淀粉添加量的增加不会引起包埋率的增加。另外当多孔淀粉用量较低或较高时,会使制成的微囊粒径过小或过大,造成微胶囊的收集困难,使包埋率降低。因此,添加多孔淀粉作单一保护剂时,选择4 g较适宜。

图1 多孔淀粉用量对微胶囊化的影响
2.1.2 葡萄糖用量对微胶囊化的影响 由图2可知,随着葡萄糖用量的增加,包埋率先增加后降低。当葡萄糖用量为5 g时,此时的包埋率最高,为52.5%,当葡萄糖的用量增加时,包埋率随着用量的增加而降低。因此,单一添加葡萄糖作为保护剂时,选择4 g较适宜。

图2 葡萄糖用量对微胶囊化的影响
2.1.3 甘油用量对微胶囊化的影响 由图3可知,当加入甘油小于4.0 mL时,随着甘油量的增加,微生态制剂中的活菌数也相应的增加,包埋率呈现增高的趋势。其主要原因在于:甘油在溶液中易结合水分子,发生水合作用,使溶液的黏性增加,从而弱化了水的结晶过程,减轻了细胞外溶质浓度升高所造成的细胞损伤,达到了保护的目的。在载体中加入细胞保护剂甘油,加强了冷冻干燥和复水后微囊中细胞的活性(Favaro-Trindade等,2011)。因此,添加甘油作为单一保护剂时,选择4.0 mL较适宜。

图3 甘油用量对微胶囊化的影响
2.1.4 甘露醇用量对微胶囊化的影响 由图4可知,当加入的甘露醇用量小于3.0 mL时,随着甘露醇量的增加,微胶囊中的活菌数也相应的增加,包埋率也有所增加,当加入甘露醇用量大于3.0 mL时,随着甘露醇量的增加,微胶囊中的活菌数反而减小,包埋率也随之下降。因此,添加甘露醇作单一保护剂时,选择3.0 mL较适宜。

图4 甘露醇用量对微胶囊化的影响
2.2 正交试验结果与分析
2.2.1 试验结果直观分析 由表2可见,零水平所代表的单因素试验的最优值即A2B2C3D1所得的包埋率值最大,为63.1%,而通过极差分析所得的最适条件是A3B2C2D1,即正交试验中的第5组,包埋率为62.5%。利用正交试验所选用的4种壁材制备微胶囊,在包埋过程中,溶液中的嗜酸乳杆菌菌体先到达多孔淀粉颗粒周围,然后在通过甘油、葡萄糖和甘露醇等保护剂的作用下,再通过吸附力进入颗粒内部的孔洞中,对嗜酸乳杆菌起到很好的保护作用(Nag等,2011)。

表2 正交试验结果直观分析
2.2.2 方差分析 通过对试验结果的极差分析可以看出,4种因素的主次顺序依次是:多孔淀粉用量(A)> 甘油用量(C)>甘露醇用量(D)>葡萄糖用量(B)。通过对试验结果进行二次方差分析,结果如表3所示,可以明显看出,因素A和C对结果具有显著性影响,也就是说制备微胶囊所选用的4种壁材中,多孔淀粉用量和甘露醇用量对微胶囊的包埋率影响最大。
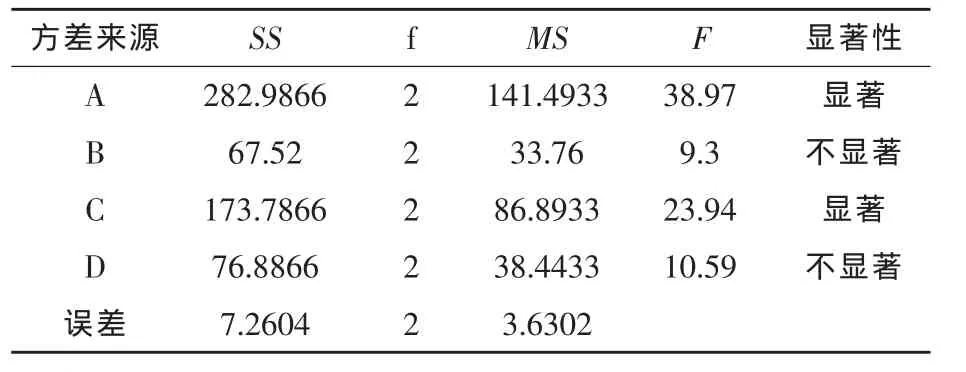
表3 方差分析结果
2.2.3 验证性试验 为了优选出制备微胶囊的最佳因素组合,分别以单因素试验的最优值即A2B2C3D1和通过极差分析所得的最优条件即A3B2C2D1进行3次重复性试验,所得包埋率结果如表4所示。

表4 微胶囊化壁材工艺验证 %
由表4可以看出,因素组合为A3B2C2D1的方案可行,所以制备微胶囊所选用壁材的最佳工艺条件为:50 mL菌悬液中,采用多孔淀粉用量为6 g、葡萄糖5 g、甘油3.0 mL、甘露醇3.0 mL,此种方案所制备的微胶囊包埋率相对最高。
2.3 扫描电镜 对嗜酸乳杆菌微生态制剂样品进行形态观察,发现嗜酸乳杆菌被保护剂包覆而形成球状颗粒,且微胶囊大小均匀,其表面比较致密,微生态制剂颗粒表面上有很多小孔,多孔淀粉上的这些小孔具有吸附作用,对嗜酸乳杆菌起到了很好的保护作用。但在扫描照片中仍出现了少量的团聚。这应该是在微胶囊的制作过程中搅拌速率过小、或壁材量稍多、或保护剂之间的粘连作用等,造成微胶囊有一定的团聚。
2.4 贮存稳定性分析 将制得的微生态制剂样品[活菌数为(2.5±0.5)×108]和裸菌[活菌数为(1.0±0.5)×108] 分别放在 0、4、25、37 ℃的环境中(环境无特殊要求)保存,每隔一定时间对两种样品的活菌数进行计算,试验结果如表5和表6。由表5可知,制剂组中,随着储藏时间的延长所有制剂样品的活菌数均逐渐下降,但在4℃下贮存时,所计数得到的活菌数下降较为缓慢,相比于其他温度下的保存结果,要适于保存。由表6可知,裸菌组中,所有样品计数得到的活菌数下降剧烈,各温度下3周后基本无存活,在25℃和37℃下,2周就基本无存活。因此,制剂的稳定性明显高于裸菌,在4℃的环境中,嗜酸乳杆菌的活性保存的比较好。

表5 微生态制剂的贮存稳定性 cfu/g
3 结论
目前,微生态制剂已经在食品加工及各种养殖业中得到广泛应用,但南方鲇饲用微囊化嗜酸乳杆菌微生态制剂的研究少见。壁材选择和制备工艺参数的优化是决定微胶囊性能的关键因素。因此,本研究重点优化选择适宜的壁材和浓度,利用真空冷冻干燥技术制备微胶囊,优化工艺参数,通过扫描电镜照片分析表明,嗜酸乳杆菌被均匀的包裹,且大小均匀,有着很好的包裹率,经过稳定性分析,表明制剂的贮藏稳定性明显高于裸菌,且所制得的微生态制剂在4℃下贮存时,稳定性较好。

表6 裸菌的贮存稳定性 cfu/g
[1]曹永梅,许时婴,张灏,等.肠溶性双歧杆菌微胶囊的制备[J].食品与发酵工业,2002,25(2):71 ~ 77.
[2]吴晓.微胶囊技术及其在食品工业中的应用[J].食品工程,2011,1:3~6.
[3]张志焱,李伟,李金敏,等.微胶囊技术在益生菌保护中的应用研究[J].畜牧与饲料科学,2012,33(9):33 ~ 34.
[4]赵瑞香.嗜酸乳杆菌及其应用研究[M].北京:科学出版社,2007.
[5]Favaro-Trindade C S,Heinemann R J B,Pedroso D L.Developments in probiotic encapsulation[J].CAB Reviews:Perspectives in Agriculture,Veterinary Science,Nutrition and Natural Resources,2011,6(4):1 ~ 8.
[6]Nag A,Han K S,Singh H.Microencapsulation of probiotic bacteria using pH-induced gelation of sodium caseinate and gellan gum[J].International Dairy Journal,2011,21(4):247 ~ 253.

