超声波提取含羞草种子中总黄酮工艺条件优化研究*
郭莎,叶伶菊,闫正
(河北大学化学与环境科学学院,河北保定 071002)
含羞草为豆科多年生草本或亚灌木,主要分布在我国华东、华南、西南等地,具有清热利尿、化痰止咳、安神止痛、凉血止血之功效。含羞草中含有大量对人体有益的活性物质,包括黄酮类、酚类、生物活性多糖、氨基酸类、有机酸类和其它微量元素。其中黄酮类化合物具有显著的生理活性,如抗衰老、清除自由基、抗肿瘤、抗菌抑菌、增强免疫力等[1]。
含羞草中黄酮类物质的提取方法主要有索氏提取、回流提取、微波提取及超声波提取等。索氏提取和回流提取因提取时间较长、溶剂用量较大及溶液长时间受热导致黄酮成分可能发生变化并流失等问题,现在已经很少使用;微波提取虽有快速高效的优点,但微波辐射所引起的高温同样会对其中的热敏性黄酮成分产生影响[2–3];超声提取法提取效率较高,节省溶剂和能源,提取的黄酮成分不易被破坏。已有文献报道含羞草总黄酮的提取工艺[1],笔者在此基础上对提取工艺条件进行优化研究,并且消除了超声时温度升高对提取效率带来的影响。方法改进后操作简单,提取效率高。
1 实验部分
1.1 主要仪器与试剂
紫外可见分光光度计:4802型,上海尤尼克仪器有限公司;
超声波清洁器:SK5200H,上海科导清洁有限公司;
自动双重纯水蒸馏器:SZ–93型,上海亚荣生化仪器厂;
粉碎机:规格为10 000 r/min,北京中兴伟业仪器有限公司;
标准检验筛:规格为250 μm (60目),浙江上虞市华丰五金仪器有限公司;
架盘药物天平:精度为0.1 g,上海精密科学仪器有限公司;
移液器:规格为1 000~5 000 μL;
循环水式真空泵:巩义市予华仪器有限公司;
微型布氏漏斗;
含羞草种子采自海南三亚;
芦丁对照品:中国药品生物制品鉴定所;
乙醇、亚硝酸钠(质量分数5%)、硝酸铝(质量分数10%)、氧氧化钠溶液(1 moL/L):分析纯,天津华东试剂厂;
实验用水为二次蒸馏水。
1.2 实验方法
(1)含羞草种子的预处理。将含羞草种子自然烘干后于10 000 r/min粉碎机下粉碎,然后过标准检验筛,备用。
(2)提取过程。称取处理好的含羞草种子3.0 g,分别加入体积分数为40%,50%,60%,70%,80%的乙醇溶液,浸泡后分别在30~34,40~44,50~54,55 ~58,58~60℃下超声,然后真空抽滤,洗涤2次,合并洗涤液,定容至25.00 mL,摇匀,待测。
(3)标准曲线绘制。芦丁是黄酮化合物中比较有代表性的一种,因此本实验选择芦丁作为对照品。
芦丁对照品标准溶液的配制:准确称取烘干至恒重的芦丁对照品,用甲醇配制成质量浓度为0.122 0 g/L的芦丁对照品标准溶液。分别移取芦 丁 对 照 品 标 准 溶 液0.00,1.00,2.00,3.00,4.00,5.00 mL于6支10 mL容量瓶中,各加30%乙醇至5 mL,加入0.3 mL 5%亚硝酸钠,摇匀,放置6 min后,然后加入10%硝酸铝0.3 mL,摇匀,放置6 min后,再加入1 mol/L的氧氧化钠溶液4 mL,混匀,用蒸馏水稀释至标线。15 min后,于510 nm下测定吸光度。以芦丁质量浓度(X)为横坐标,吸光度(Y)为纵坐标绘制标准曲线,得线性回归方程:Y=10.772 83X+0.057 78,线性相关系数r=0.999 8,线性范围为0.012 2~0.073 2 g/L。
2 结果与讨论
2.1 溶剂组成对黄酮提取率的影响
分别称取5份处理好的含羞草种子样品于100 mL具塞锥形瓶中,每份3.0 g,分别加入40%,50%,60%,70%,80%乙醇溶液各18 mL,浸泡1 h,在30~40℃水温下超声30 min,抽滤,用相应溶剂洗涤,余同1.2(2),平行测定3次,结果见表1。
由表1可知,随着乙醇体积分数的增加,黄酮提取率先增加后减小,当乙醇体积分数为50%时,提取率最大,之后随着乙醇体积分数的增加,黄酮类化合物溶解度变小,提取率降低。因此初步选择乙醇的体积分数为50%。

表1 溶剂组成对黄酮提取率的影响
2.2 配料比对黄酮提取率的影响
分别称取4份处理好的含羞草种子样品于100 mL具塞锥形瓶中,每份3.0 g,分别加入50%乙醇溶液18,21,24,27 mL,配料比(g∶mL)分别为1∶6,1∶7,1∶8,1∶9,浸泡1 h,在30~40℃水温下超声30 min,抽滤,用50%乙醇洗涤,余同1.2(2),平行测定3次,结果见表2。
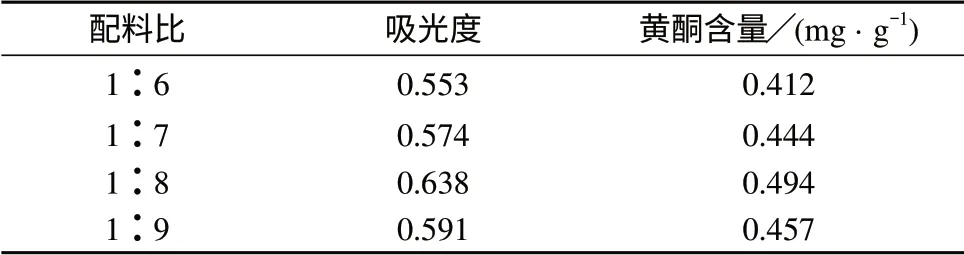
表2 配料比对黄酮提取率的影响
由表2可知,随着溶剂量的增加,黄酮提取率先增加后减小,当配料比为1∶8时,提取率最大,之后提取率减小,这可能因为已达到了黄酮提取率的最大限度。
2.3 浸泡时间对黄酮提取率的影响
分别称取4份处理好的含羞草种子样品于100 mL具塞锥形瓶中,每份3.0 g,各加入50%乙醇24 mL,分别浸泡1,2,3,4 h,在30~40℃水温下超声30 min,抽滤,用50%乙醇洗涤,余同1.2(2),平行测定3次,结果见下表3。
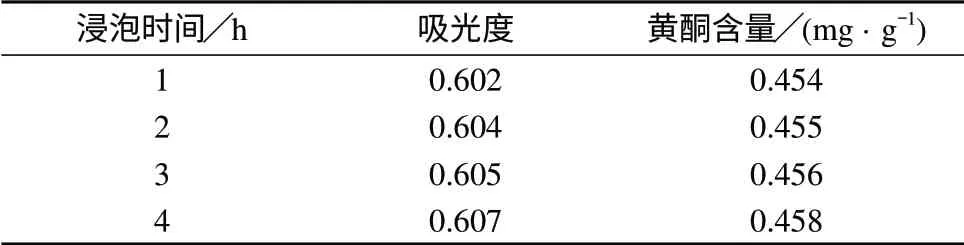
表3 浸泡时间对黄酮提取率的影响
由表3可知,随着浸泡时间的增长,黄酮提取率并未提高,即浸泡时间长短,对黄酮提取率影响不大。为提高黄酮提取效率,实验选择浸泡时间为1 h,且此因素不参与后面的正交试验。
2.4 超声温度对黄酮提取率的影响
分别称取5份处理好的含羞草种子样品于100 mL具塞锥形瓶中,每份3.0 g,各加入50%乙醇24 mL,浸泡1 h,分别在30~34,40~44,50~54,55~58,58~60℃(因无法精确控制水温,本试验选择在一定温度范围内测定黄酮的提取率)水温下,超声30 min,抽滤,用50%乙醇洗涤,余同1.2(2),平行测定3次,结果见表4。
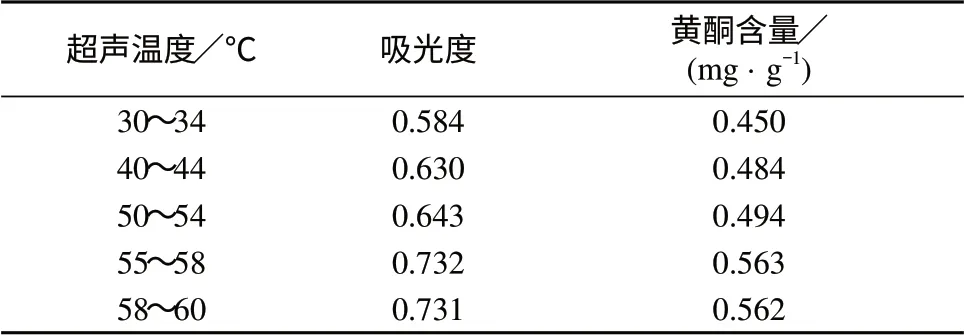
表4 超声温度对黄酮提取率的影响
由表4可知,随着温度的上升,黄酮的提取率逐渐增加,最后趋于一定值,已达到黄酮提取的最大限度。
2.5 超声时间对提取率的影响
分别称取5份处理好的含羞草种子样品于100 mL具塞锥形瓶中,每份3.0 g,各加入50%乙醇24 mL,浸泡1 h,在30~34℃水温下超声,为避免温度对试验的影响,本试验采用先分别超声10 min,加入冷却水,待温度回到始温时,进行第2次超声,以此类推,待5次超声完毕后,抽滤,用50%乙醇洗涤,余同1.2(2),平行测定3次,结果见表5。
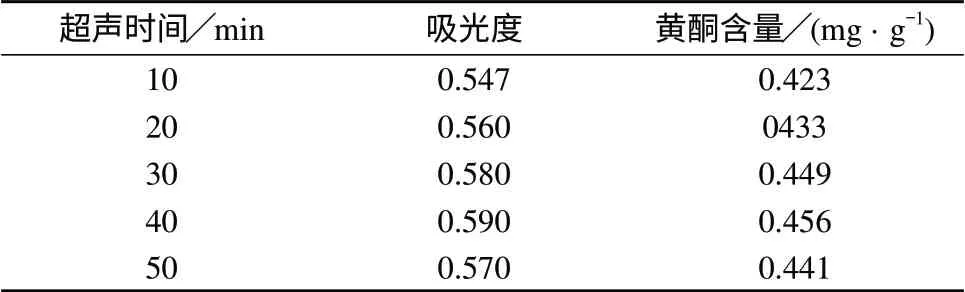
表5 超声时间对黄酮提取率的影响
由表5可知,随着超声时间的增加,黄酮提取率先增加后减小,当超声时间为40 min时,提取率达到最大,之后提取率下降。此方法可以消除温度对提取率带来的影响,但过程较繁琐,若采用恒温循环水式超声波清洁器,效果会更佳。
2.6 正交试验
在上述单因素试验基础上,选择4因素3水平进行正交试验[4],结果见表6。
对表6中正交试验数据分析,得知影响含羞草种子中黄酮提取率的因素主次顺序为A>D>B>C,从提取黄酮的含量考虑,提取条件A3B2C1D3效果最佳,即乙醇体积分数为60%,配料比为1∶8,超声温度为40~44℃,超声时间为50 min。
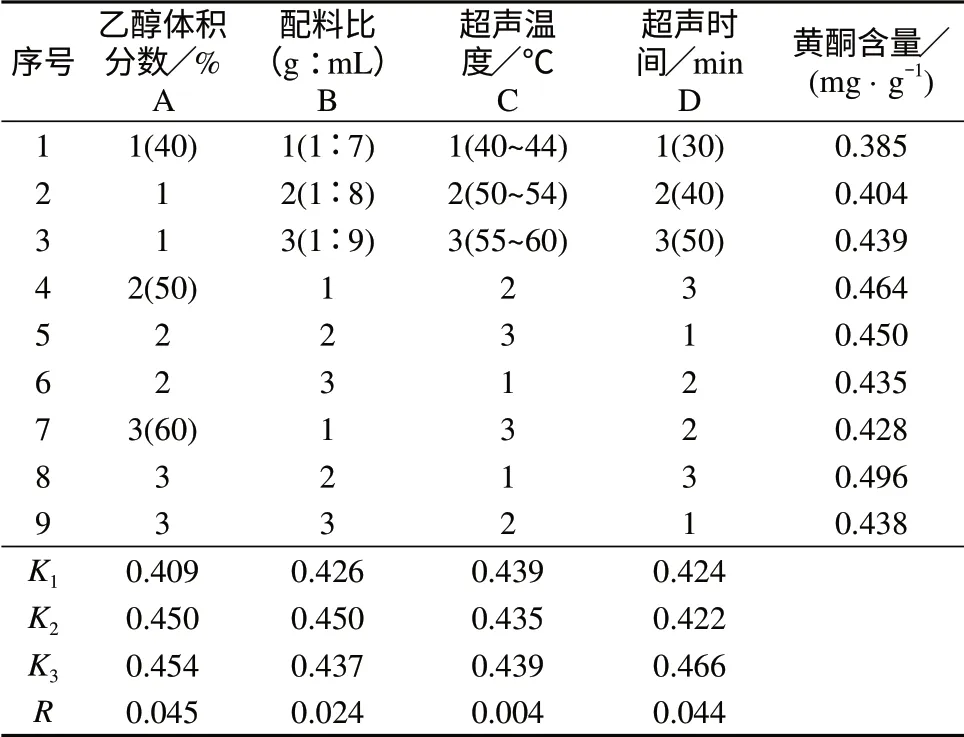
表6 提取工艺条件正交试验结果
3 结语
通过对含羞草种子中黄酮类物质的超声提取工艺研究,得出了最佳提取工艺条件,该提取方法操作简单,提取时间短,提取效率较高。
[1]乔文涛,张静,俞凌雁,等.含羞草中总黄酮提取纯化工艺研究[J].时珍国医国药,2009,20(8): 1 986–1 987.
[2]吴崇珍,李玉贤,袁珂,等.含羞草总黄酮不同提取方法的比较[J].郑州大学学报(医学版),2013,48(4): 560–561.
[3]刘翀,杨洋.生物类黄酮提取研究进展[J].中外食品,2004(10): 48–49.
[4]金锋.超声波提取竹叶挥发油优化工艺研究[J].粮油加工,2009(8): 54–55.
[5]袁珂,吕洁丽,殷明文.海南含羞草中黄酮碳苷类化学成分的研究[J].药学学报,2006,41(5): 435–438.
[6]吴洋博,巩江,倪士峰,等.含羞草药学研究进展[J].安徽农业科学,2010,38(15): 7 874–7 875.
[7]吴崇珍,王艳坤,李玉贤,等.含羞草组成成分药学研究进展[J].河南教育学院学报,2013,22(1): 2–7.
[8]杨伟球,王晖,蒋宝南.索氏提取法与超声波提取法测定土壤中六六六残留的比较[J].农业环境与发展,2006(6): 67–69.

