粗叶悬钩子无性扦插繁殖技术的优化
王业社,段林东,周双
(邵阳学院城市建设系,湖南邵阳422000)
粗叶悬钩子(Rubus alceaefolius)为蔷薇科(Rosaceae)悬钩子属(Rubus)多年生常绿攀援灌木[1]。单叶,花为白色,果熟时红色。常生于村边、路旁、灌丛中,分布于福建、广东、广西、湖南、贵州等地[2]。粗叶悬钩子含有人体所需的多种氨基酸,可作为中草药治疗多种疾病,其根和叶入药,有活血祛瘀、清热止血之效[3]。同时,其叶形别致,果色艳丽,生长迅速,繁殖容易,覆盖力强,具有较强的适应性和抗性。作为新优地被植物植于树下、林缘、绿化隔离带、假山岩石旁、溪边、岸边、池塘边阴湿处等,颇具景观价值。因此,粗叶悬钩子不仅是药用价值较高的药用藤本植物,而且还是观赏价值较高的园林地被植物,综合效益显著,发展潜力巨大。
近年来,我国越来越重视对地被植物的研究与应用,其中新优地被植物的引种和乡土地被植物的驯化已成为当前研究的热潮[4-8]。作为一种药用价值和观赏价值较高的乡土地被植物粗叶悬钩子。药用成分和药用功效方面目前国内有较多的研究[9-13],而在生物特性、栽培育种[14]和园林应用等方面相关研究甚少,还未见其无性繁殖方面的报道。为优化粗叶悬钩子无性繁殖技术,进一步提高粗叶悬钩子无性繁殖的成活率,改善生根质量,推动粗叶悬钩子产业的发展,本研究于2012年对粗叶悬钩子的无性繁殖进行多因子正交试验研究,探索其人工繁育的可行性技术和措施。
1 材料与方法
1.1 试验设计
采用4因素3水平的L9(34)正交试验设计方案,以影响粗叶悬钩子无性扦插繁殖生根质量的4个主要因子为试验因子:A(NAA浓度)、B(扦插基质)、C(插穗类型)、D(处理时间)。各因子的水平分别为:A1为 100 mg·L-1,A2为 200 mg·L-1,A3为300 mg·L-1;B1为红黄壤,B2为河沙,B3为菜园土;C1为一年生带顶芽茎段,C2为一、二年生茎段,C3为一年生带叶茎段;D1为1 h,D2为2 h,D3为4 h。正交方案设计见表1。

表1 L 9(34)正交试验Table 1 L 9(34)orthogonal experiment
1.2 试验材料
试验于2012年3月3日在邵阳学院园林实践教学基地苗圃进行。扦插材料采自湖南云山森林公园仙人桥附近的自然居群,并放入装有苔藓的塑料袋内喷水保湿带回。扦插基质:红黄壤采集于邵阳市大祥区城南乡深耕塘,菜园土采集于邵阳市大祥区邵阳学院七里坪校区附近,河沙采集于邵阳市大祥区城南乡采沙场。
1.3 试验方法
试验前用5%的KMnO4溶液对3种扦插基质进行消毒,并按试验设计要求填入各扦插床(高20 cm、内空80 cm、长5 m),基质厚度为18 cm,整平,浇透水,准备扦插繁殖。从生长健壮、无损伤、无病虫害的粗叶悬钩子植株上剪取一年生和一、二年生粗叶悬钩子枝条,分别剪取以下3种插穗。1)带顶芽茎段:选取一年生嫩枝顶芽段,按保留4~5个节、长7 cm左右的标准剪取插穗,且每个插穗保留顶芽,保留成熟小叶1~2片。2)一年生带叶茎段:选取一年生枝条(取带顶芽茎段后的枝条),按保留3个节、长8 cm左右的标准剪取插穗,且保留插穗上芽处1个腋芽、半个或1个小叶片,插穗上切口距插穗上芽约1 cm处剪成平角。3)一、二年生茎段:选取一年生和二年生交界处的枝条进行修剪,按保留3~4个节(最下方的节点为二年生节点)、长8 cm左右的标准剪取插穗,且每个插穗保留生长前端的1个腋芽,插穗上切口距插穗腋芽约1 cm处剪成平角。3种插穗下切口一般在插穗最下芽下部1~1.5 cm处剪成锐角斜面,除去倒钩刺,50枚一扎。用不同NAA浓度的溶液浸泡处理,按10 cm×10 cm株行距插入各扦插床,每处理50条插穗,用木棍打孔法,将插穗置于孔内,插穗以2/3没入土中为宜,然后用手压实,使基部与基质密切接触,然后浇透水,并在床面上安放拱形支架,上覆农用塑料薄膜,再加盖透光度率为40%遮阳网。根据天气状况,每天向床内喷雾2~3次,以保持床内相对湿度。在高温高湿的条件下,注意适当通风。在日常管理上,经常检查并记录生根状况,随时除草,及时防治病虫害并拔除病株。
于2012年6月11日统计生根数量、生根长度、生根率等生根情况,进行极差分析和方差分析,确定各试验因素对生根率、平均生根数、平均根长的影响。综合评价粗叶悬钩子无性繁殖生根质量Q值[15]。Q=生根率×50%+平均生根数×25%+平均根长×25%。
试验数据用SAS8.1统计软件进行方差分析。
2 结果与分析
2.1 各试验因素对生根率的影响
极差的大小反映了各因素对试验结果影响的主次。各试验因素对粗叶悬钩子无性扦插繁殖生根率影响效应的大小排序为B(108)>D(54)>A(32)>C(26),扦插基质对生根率影响最大,其中以菜园土最佳,红黄壤和河沙稍差;处理时间对生根率影响次之,以处理时间为2 h的影响最大,处理时间为1和4 h的影响较小;NAA浓度对生根率的影响排第3,当 NAA 浓度为 100 mg·L-1时,生根率较好,而其他两种NAA浓度对生根率的影响较小;插穗类型对生根率影响最小,其中以带顶芽茎段插穗影响最大,一、二年生茎段和一年生带叶茎段插穗的影响较小(表2)。经方差分析(表3),各试验因素对粗叶悬钩子无性扦插繁殖生根率的影响均未达到显著水平(P >0.05)。
2.2 各试验因素对平均生根数的影响
极差分析结果表明,各试验因素对粗叶悬钩子无性扦插繁殖平均生根数影响效应的大小排序为A(18.5)>B(17.62)>D(10.29)>C(9.32),NAA 浓度对平均生根数的影响最大,以浓度为100 mg·L-1时其平均生根数最佳;扦插基质对平均生根数的影响次之,其中以河沙影响最显著,菜园土和红黄壤影响偏小;处理时间和插穗类型对平均生根数的影响较小,分别以处理时间为2 h和一、二年生茎段插穗时其平均生根数最大(表2)。方差分析表明(表3),各试验因素对粗叶悬钩子无性扦插繁殖平均生根数的影响均未达到显著水平(P>0.05)。

表2 正交试验结果Table 2 Results of Orthogonal Tests
2.3 各试验因素对平均根长的影响
极差分析结果表明,各试验因素对粗叶悬钩子无性扦插繁殖平均根长影响效应的大小排序为B(19.95)> A(16.21)> D(4.54)> C(2.39),扦插基质对平均根长的影响最大,其中以菜园土最好,河沙和红黄壤稍差;NAA浓度对平均根长的影响次之,以浓度为400 mg·L-1时影响最大,浓度为100 mg·L-1和浓度为 200 mg·L-1时影响较小;处理时间排第3,以处理时间为1 h其平均根长最大 ,处理时间为2和4 h时,其平均根大较小;插穗类型对平均根长的影响最小,其中以带顶芽茎段插穗影响最大,一、二年生茎段和一年生带叶茎段插穗的影响较小(表2)。方差分析表明(表3),在各试验因素中,NAA浓度和扦插基质对粗叶悬钩子无性扦插繁殖平均根长的影响均达到显著水平(P<0.05),而插穗类型和处理时间对粗叶悬钩子无性扦插繁殖平均根长的影响均未达到显著水平(P>0.05)。
2.4 各试验因素对生根质量的影响
极差分析表明各试验因素对粗叶悬钩子无性扦插繁殖生根质量影响效应的大小排序为B(58.05)>D(28.98)> A(18.00)> C(11.10),说明扦插基质对粗叶悬钩子无性繁殖生根质量的影响最大,其次为处理时间,NAA浓度排第3,插穗类型的影响最小。经方差分析(表3),结果表明扦插基质对粗叶悬钩子生根质量的影响达到显著水平(P<0.05),其他各试验因素对粗叶悬钩子生根质量的影响均未达到显著水平(P>0.05)。
9种组合中,A2B3C1D2的生根质量最好,Q平均值为52.17。综合各因素对生根质量的影响,当NAA浓度为100 mg·L-1、扦插基质为菜园土、插穗类型为一年生带顶芽茎段、处理时间为2 h时,粗叶悬钩子生根质量效果的最佳,用该组合(A1B3C1D2)进行扦插验证试验,结果表明,粗叶悬钩子生根质量平均Q值为63.88,明显高于正交试验表中的9种组合试验,从而验证了组合A1B3C1D2为粗叶悬钩子无性扦插繁殖处理的适宜方法。
3 讨论与结论
开展无性繁殖特别是扦插无性繁殖技术研究,不仅是加速粗叶悬钩子种苗繁殖,建立迁地保护基地的重要举措和有效途径,也是实施早花、矮化技术的重要措施,对粗叶悬钩子种质资源的保存、发展和利用具有重要的意义[16]。
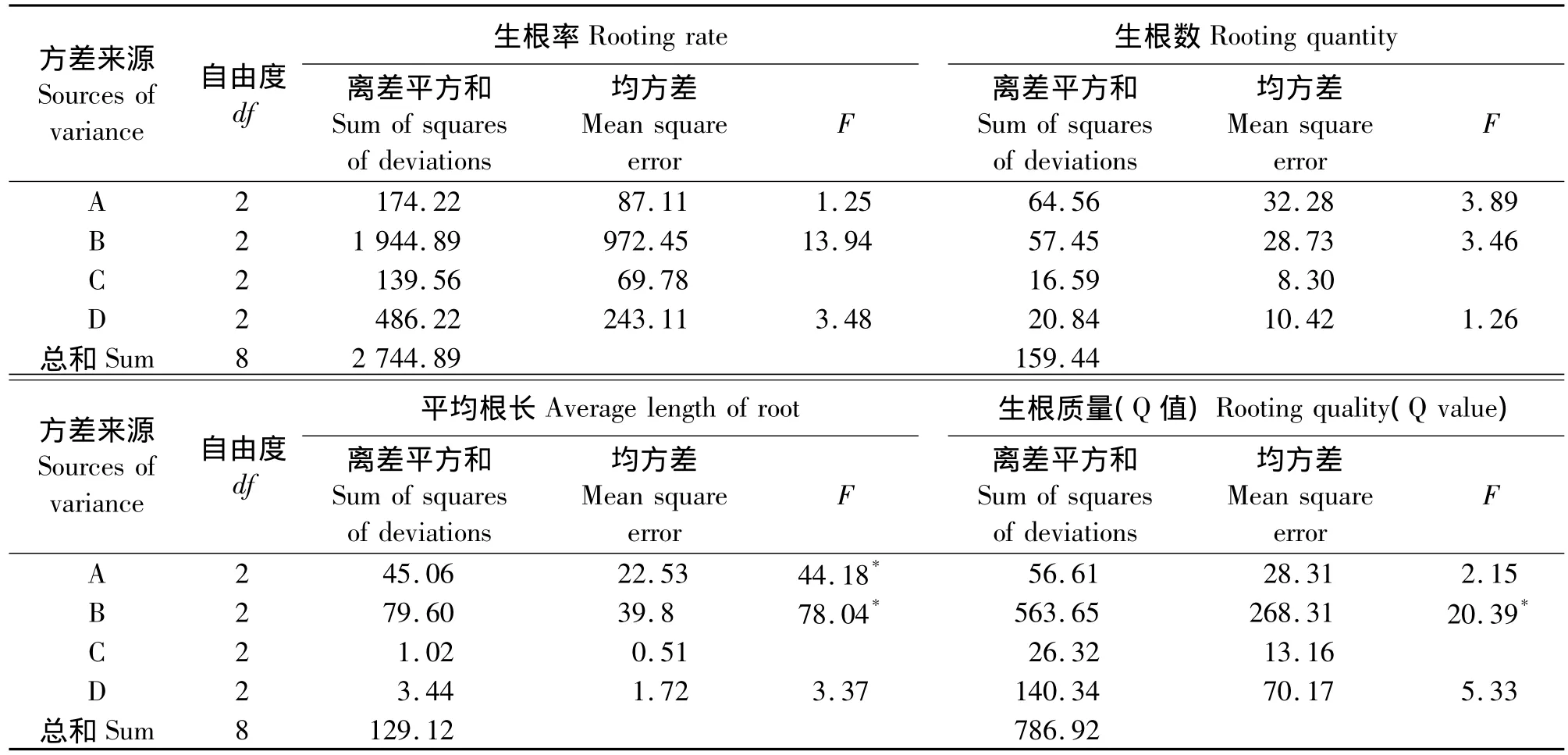
表3 各试验因素对生根率、平均根数、平均根长和生根质量的影响Table 3 Effects of each testing factors on rooting rates,average amount of roots,average length of roots and rooting quality
在NAA浓度、扦插基质、插穗类型和处理时间4个因素中,扦插基质对粗叶悬钩子生根质量的影响最大,处理时间次之,NAA浓度排第3,插穗类型的影响最小,其中扦插基质对粗叶悬钩子生根质量的影响达到显著水平。从总的生根质量来看,A1B3C1D2为最优组合,即当 NAA浓度为 100 mg·L-1、扦插基质为菜园土、插穗类型为一年生带顶芽茎段、处理时间为2 h时,粗叶悬钩子无性扦插繁殖的生根效果最好。在本试验的3种扦插基质中,以菜园土最好,其生根数量最多,生根长度最长,生根率最高;其次是黄红壤;最差的是河沙。因为河沙透气性最好但保水性最差,红黄壤基质的保水性较好但透气性较差,而菜园土有机质较多,呈酸性,与其自然居群的土壤pH相似,且保水性和透气性较平衡,从而更适宜粗叶悬钩子的生根生长。
在本试验中,从NAA不同的浸泡时间对粗叶悬钩子生根质量指数的影响效果来看,当NAA浓度处理时间为2 h时,粗叶悬钩子无性扦插繁殖的生根效果最好,生根率最高,平均生根数较高和平均根长较长。处理时间超过2 h时,生根效果、生根率、平均生根数等各项指标没有随时间延长而明显提高。这可能与粗叶悬钩子的生理特性、扦穗所处的生理状态以及激素的特性有关[17]。一般情况下,激素浓度大浸泡时间短,激素浓度小浸泡时间长。因此,在使用不同浓度NAA处理粗叶悬钩子插穗时,其浸泡的时间范围应合理控制在一个最佳时间节点。NAA激素浓度对粗叶悬钩子生根质量有较大的影响作用。在本试验中,当NAA浓度由100 mg·L-1增大到200 mg·L-1时,生根率随浓度的增加而降低,NAA 浓度由200 mg·L-1增大到300 mg·L-1时,生根率随浓度的增加而提高,说明NAA具有促进生长和抑制根生长的二重作用。因此,在使用NAA处理粗叶悬钩子插穗时,其溶液浓度应合理控制在一个最佳数值。带顶芽茎段插穗对粗叶悬钩子生根效果最好,去除顶芽后的插穗其生根质量明显降低,表明顶叶在插条生根中起着非常重要的作用,这可能是由于顶叶能进行光合作用,产生营养物质——糖,积累于枝下部有利于生根。此外,顶芽的存在加速了蒸腾作用,也促进了枝条从基质中吸收水分和营养物质,从而促进了插条生根及根的生长[18]。
[1]中国科学院植物研究所.中国高等植物图鉴 补编(第二册)[M].北京:科学出版社,1985:96.
[2]中国科学院植物研究所.中国高等植物图鉴(第二册)[M].北京:科学出版社,1983:265.
[3]李维林,贺善安,顾姻.中国悬钩子属植物的利用价值概述[J].武汉植物学研究,2000,18(3):237-243.
[4]江泽慧.国际林联第22届世界大会论文选编[C].北京:中国林业出版社,2006:195.
[5]杜路平.园林地被植物应用现状的几点思考[J].北方园艺,2009(8):229-231.
[6]韩德梁,刘春霞,韩烈保.野生地被植物在园林绿化中的应用[J].北方园艺,2009(3):122-126.
[7]张祖群,李敏,赵荣,杨新军.近年来我国地被植物研究进展及述评[J].湖北农学院学报,2004(4):267-271.
[8]田福平,武高林,时永杰,杨志强.我国园林地被植物研究现状[J].草业科学,2006,23(9):111-115.
[9]洪振丰,徐伟,李天骄,周建衡,胡娟.粗叶悬钩子根部总生物碱的含量测定[J].福建中医学院学报,2008,18(5):28-30.
[10]叶蕻芝,洪振丰,王玉华,陈艳华.粗叶悬钩子对实验性肝损伤的治疗作用研究[J].中医药学刊,2005(5):829-831.
[11]刘艳,李天骄,赵锦燕,洪振丰.粗叶悬钩子粗多糖对模型大鼠急性肝损伤药物代谢酶的影响[J].福建中医学院学报,2008(5):13-15.
[12]徐丹丹,周洪波,房志坚.粗叶悬钩子的化学成分研究[J].广东药学院学报,2012(1):83-85.
[13]赵锦燕,吴志生,陈旺,洪振丰.粗叶悬钩子总生物碱不同部位对肝损伤的保护作用研究[J].时珍国医国药,2010,21(9):2186-2188.
[14]王鹏霄.河南省悬钩子属植物资源调查与良种选育研究[D].郑州:河南农业大学,2012.
[15]周贱平,卢俊鸿,廖伟清.基质和植物生长调节剂对九重葛插条生根的影响[J].园艺学报,1994,21(2):205-206.
[16]柴胜丰,史艳财,陆宗游,王代容,文香英,宁世江.珍稀濒危植物毛瓣金花茶扦插繁殖技术研究[J].种子,2012,31(6):118-121.
[17]汪仁,孟祥静,何丽斯,彭峰,夏冰.双瓣茉莉扦插繁殖技术研究[J].江苏农业科学,2011,39(5):260-262.
[18]吴庆华,董青松,胡秀月,林伟.何首乌嫩枝扦插繁殖研究[J].特产研究,2011(4):20-22.

