非标记适体-金纳米检测尿中痕量腺苷
赵慧,王爱芝,王永生
(南华大学 公共卫生学院,湖南 衡阳 421001)
研究表明,肿瘤细胞的快速增殖可导致腺嘌呤核苷酸降解,使腺苷的产生和排出增多,尿中腺苷可以作为潜在的肿瘤标志物[1-2]。因此,检测尿液中腺苷含量对恶性肿瘤早期诊断、预后监测等方面具有重要意义。
目前测定尿中痕量腺苷的方法有高效液相色谱法[3]、毛细管电泳法[4]、液相色谱-质谱联用法[5]、共振光散射法[6]、荧光分光光度法[7]等,这些方法虽然各有优点,但都存在或多或少的不足。
本文基于腺苷与未标记的腺苷适体特异性结合,金纳米不被腺苷适体保护而在高盐浓度下聚集,导致共振光散射增强的原理,建立RLS 测定腺苷的新方法,已用于尿样中腺苷的测定。
1 实验部分
1.1 试剂与仪器
腺苷、氯金酸、柠檬酸三钠、氯化钠等均为分析纯;腺苷适体为色谱纯(序列号为5'-ACCTGGGGGAGTATTGCGGAGGAAGGT-3',临用前需95 ℃5 min处理后,缓慢冷却至室温);实验用水为灭菌双蒸水;金纳米,按参考文献[8]制备。
F-4500 荧光分光光度计;UV-2550 紫外-可见分光光度计;AB204-S 电子分析天平;PB-21 型精密酸度计。
1.2 实验方法
于2 mL EP 管中依次加入pH 4.6 BR 缓冲溶液35 μL,1.0 μmol/L 腺苷适体20 μL 和不同体积的1.0 ×10-10mol/L 腺苷溶液,漩涡混匀,于37 ℃恒温水浴箱中孵育30 min。加入金纳米粒子40 μL,加入适量灭菌双蒸水,混匀,室温孵育25 min。加入0.5 mol/L NaCl 溶液50 μL,混匀后立即在荧光分光光度计上以λex=λem进行同步扫描,获取RLS 光谱,记录λmax=540 nm 处溶液RLS 强度(I)和试剂空白RLS 强度(I0),计算ΔI=I-I0。激发和发射狭缝宽度分别为5.0,10.0 nm,光电倍增管电压为400 V。同时在紫外-可见分光光度计上扫描吸收光谱。
2 结果与讨论
2.1 光谱特征
图1 为适体-AuNPs-腺苷体系的吸收光谱图和RLS 图谱。
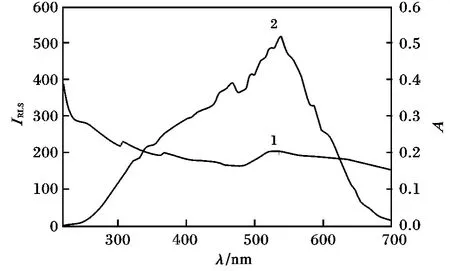
图1 适体-AuNPs-腺苷体系的吸收光谱(1)和RLS 光谱(2)Fig.1 Absorption and RLS spectra of aptamer-AuNPs-adenosine system
由图1 可知,适体-AuNPs-腺苷体系的最大RLS峰位于540 nm,处于体系的最大吸收峰附近。由于RLS 作用包括散射-吸收-再散射过程,根据Miller、Anglister 和Steinberg 的RLS 理论,体系增强的散射光谱可以认为是共振光散射。
图2 为适体-AuNPs-腺苷体系在pH 4.6 BR 缓冲液中的RLS 图谱。
由图2 可知,在pH 4.6 BR 缓冲液中,单独的AuNPs 的RLS 强度很弱(图2a),加入NaCl 溶液之后,AuNPs 在高盐溶液中发生聚集,体系的RLS 强度显著增强(图2b)。在AuNPs 溶液中加入腺苷适体,再加入NaCl 后,AuNPs 被腺苷适体保护,体系的RLS 强度减弱(图2c)。在适体-AuNPs 复合物中加入腺苷,腺苷与腺苷适体特异性结合,金纳米不被腺苷适体保护而在高盐浓度下聚集,体系的RLS 强度增强(图2d),且随着腺苷浓度增加,体系的RLS 依次增强,在λmax=540 nm 处,腺苷浓度与ΔI 在一定范围内呈良好线性关系。

图2 适体-AuNPs-腺苷体系的RLS 光谱Fig.2 RLS spectra of aptamer-AuNPs-adenosine system
2.2 实验条件的优化
2.2.1 体系酸度及用量的影响 选用PBS、MES 和BR 3 种缓冲溶液进行实验,结果表明,在BR 缓冲液中,体系的RLS 强度的变化值最大。在BR 缓冲液中,随着pH 增加,ΔI 值也不断的上升,在pH 4.4~4.8 范围内相对稳定,且在pH 4.6 时,ΔI 值最大,故本实验选择pH 4.6 的BR 缓冲溶液35 μL 控制体系的酸度。
2.2.2 AuNPs 用量的影响 实验了AuNPs 用量对体系ΔI 值的影响。结果表明,当AuNPs 用量在25~40 μL 时,体系的ΔI 值逐渐增大;继续增加AuNPs 用量,体系的ΔI 值降低。因此,本实验选择AuNPs 的用量为40 μL。
2.2.3 NaCl 用量的影响 固定已优化的实验条件,探讨了0.5 mol/L NaCl 溶液的用量对反应体系的影响。结果表明,随着NaCl 溶液用量增加,体系ΔI 值不断变大,NaCl 溶液用量为50 μL 时,ΔI 达到最大值。因此,本实验选择适体用量为50 μL。
2.2.4 反应时间的影响 研究了反应时间在5 ~60 min 范围内体系的RLS 强度的变化。实验表明,反应25 min 时,体系的ΔI 达到最大值,随着时间继续增加,体系的ΔI 值恒定不变,体系的稳定性良好。故本实验选择反应时间为25 min。
2.3 干扰实验
在最佳实验条件下,腺苷浓度为1.5×10-11mol/L,实验了可能共存的多种离子或物质对体系的影响。结果表明,当相对标准偏差≤5%时,1 000 倍的葡萄糖;260 倍的尿素;223 倍的;200 倍的Na+、K+、Ag+、Cl-、NO3-;100 倍的Pb2+、Hg2+、Al3+、Ca2+、Mg2+、Fe2+、、F-、Br-、;82 倍的草酸;67 倍的EDTA 二钠、Zn2+、Fe3+、Ba2+、尿苷、胸苷;47 倍的鸟苷;45 倍的I-、Cu2+;9 倍的胞苷等对测定没有影响,可见该法有较好的选择性。
2.4 标准曲线、检出限及精密度
按照实验方法,加入不同体积腺苷标准溶液,绘制标准曲线。结果表明,腺苷的浓度在1.9 ×10-12~2.0×10-11mol/L 范围内,与体系ΔI 有良好的线性关系,其回归方程为ΔI =71.3 +17.0c(×10-12mol/L),相关系数r=0.994 8。根据11 次空白样品的平行测定,按公式LOD=3Sb/k(Sb和k 分别为空白管的标准差和直线回归方程的斜率)计算,可得本方法的检出限为5.7 ×10-13mol/L。平行配制11 管浓度分别为1.0 ×10-12,1.5 ×10-11,2.0 ×10-11mol/L的腺苷标准溶液进行精密度实验。结果相对标准偏差(RSD)分别为1.48%,3.70%和2.52%。
2.5 样品分析
采集南华大学学生尿样1 和南华大学附属第一医院糖尿病病人尿样2 和脑梗阻病人尿样3 各1 mL,以3 500 r/min 的 速 度 离 心10 min,用0.22 μm 针头式过滤器过滤,取上清液,按实验方法进行操作,测定样品中的腺苷含量和加标回收率,结果见表1。

表1 样品中腺苷检测结果(n=6)Table 1 Determination results of adenosine in the samples(n=6)
3 结论
在优化的实验条件下,腺苷与腺苷适体特异性结合,AuNPs 失去适体的保护而聚集,导致体系的RLS 强度显著增强,且在一定的浓度范围内,体系的ΔI 与腺苷的浓度有良好的线性关系,据此建立了尿样中痕量腺苷的检测新方法。本方法应用于实际尿样中腺苷的检测,简单、快速、选择性好、检出限低。
[1] Zhang J Q,Wang Y S,Xue J H,et al. A gold nanoparticles-modified aptamer beacon for urinary adenosine detection based on structure-switching/fluorescence-“turning on”mechanism[J]. Journal of Pharmaceutical and Biomedical Analysis,2012,70:362-368.
[2] Hsu W Y,Chen C J,Huang Y C,et al. Urinary nucleosides as biomarkers of breast,colon,lung,and gastric cancer in taiwanese [J]. PLoS One,2013,8(12):e81701.
[3] Contreras-Sanz A,Scott-Ward T S,Gill H S,et al.Simultaneous quantification of 12 different nucleotides and nucleosides released from renal epithelium and in human urine samples using ion-pair reversed-phase HPLC[J].Purinergic Signal,2012,8(4):741-751.
[4] Chen M L,Wei S S,Yuan B F,et al.Preparation of methacrylate-based monolith for capillary hydrophilic interaction chromatography and its application in determination of nucleosides in urine[J].Journal of Chromatography A,2012,1228:183-192.
[5] Hsu W Y,Chen W T,Lin W D,et al.Analysis of urinary nucleosides as potential tumor markers in human colorectal cancer by high performance liquid chromatography/electrospray ionization tandem mass spectrometry[J].Clin Chim Acta,2009,402(1):31-37.
[6] Zhang J Q,Wang Y S,He Y,et al.Determination of urinary adenosine using resonance light scattering of gold nanoparticles modified structure-switching aptamer[J]. Analytical Biochemistry,2010,397(2):212-217.
[7] Lin J H,Tseng W L.A method for fluorescence sensing of adenosine and alkaline phosphatase based on the inhibition of S-adenosylhomocysteine hydrolase activity[J].Biosensors and Bioelectronics,2013,41:379-385.
[8] Qian Q M,Wang Y S,Yang H X,et al. Colorimetric detection of metallothioneins using a thymine-rich oligonucleotide-Hg complex and gold nanoparticles[J].Anal Biochem,2013,436(1):45-52.

