糖耐量减低者尿中三种蛋白质排泄率的3 年动态监测
杨文杰,柯振符,梁美妹,吴如琳
(茂名石化医院检验科,广东 茂名 525000)
糖耐量减低(IGT)是2 型糖尿病(DM)发展过程中的一个重要阶段。近年来,我国IGT 患病率明显上升,某大型企业在职职工糖尿病前期患病率调查显示,IGT 的患病率为2.09%,并有随着年龄增高患病率随之上升的趋势[1]。糖尿病肾病(DN)是糖尿病最严重的微血管病并发症之一,是终末期肾病的重要原因,严重威胁到患者的生命。针对此种不可逆的肾损害防治的最有效办法是早发现、早诊断、早治疗。当尿白蛋白含量达到30~299 mg·24 h-1或30~299 μg·mg-1肌酐时,即可被临床上界定为微量白蛋白尿,由此推断肾小球基底膜受到损害,当达到300·24 h-1或300 μg·mg-1肌酐时,即可诊断为临床白蛋白尿[2]。目前,尿中的微量白蛋白(mAlb)、β2-微球蛋白(β2-MG)和α1-微球蛋白(α1-MG)的检测已被广泛应用于糖尿病患者早期肾损害的监测[3-5]。为了进一步认识IGT 与早期肾损害的关系,本研究通过动态监测正常人、IGT 及DM 患者尿中的mAlb、β2-MG 和α1-MG 含量,来评估IGT 与肾损害的关系,报告如下。
1 对象与方法
1.1 研究对象
选择2012 年1—12 月来自茂名石化公司职工及离退休健康体检中自愿参加糖尿病流行病学检查的体检人群及门诊糖尿病患者265 例。根据WHO 1999 年DM 分型标准 分为3 组,IGT 组102例(空腹血糖<7.0 mmol·L-1和口服75 g 葡萄糖2 h血糖7.8~11.1 mmol·L-1),男66 例,女36 例,年龄34~72 岁;DM 组93 例(空腹血糖>7.0 mmol·L-1,2 h血糖>11.0 mmol·L-1),男69 例,女24 例,年龄38~72 岁;NGT 组70 例(BGF<6.1 mmol·L-1和2 h<7.8 mmol·L-1),男48 例,女22 例,年龄29~73 岁。受试者均排除肾病、高血压等疾病。
1.2 试验方法
受试对象要求禁食8~12 h,同时正常饮水,第2 天早晨空腹采血后口服75 g 葡萄糖2 h 再次采血检测血糖,同时随机留取尿液检测白蛋白、α1-MG、β2-MG 及尿肌酐,计算各蛋白质排泄率。
1.3 仪器与试剂
尿微量白蛋白、α1-MG 和β2-MG 检测试剂由上海景源医疗器械有限公司提供,均采用免疫比浊法测定。肌酐试剂由广州标佳提供,采用苦味酸法。仪器采用OLIYPUS AU-640 型全自动生化分析仪。
1.4 统计学方法
应用SPSS11.0 统计软件及Microsoft Excel 进行统计学分析,计量资料以均数±标准差()表示,三组间同一时点比较采用单因素方差分析,组内不同时点比较采用重复测量设计两因素多水平的方差分析,均数间两两比较采用SNK-q 检验;计数资料比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
1)在开始确诊为IGT 的137 例调查对象中,有23 例发展为DM,有12 例恢复为NGT,102 例保持IGT 状态、各组尿mAlb、β2-MG 和α1-MG 3 年动态检测结果见表1。
2)3 种尿蛋白排泄率各组3 年变化趋势图,见图1-3。
表1 IGT、DM 及NGT 组尿mAlb、β2-MG 和α1-MG 3 年动态检测结果 ,(mg·mmol-1)
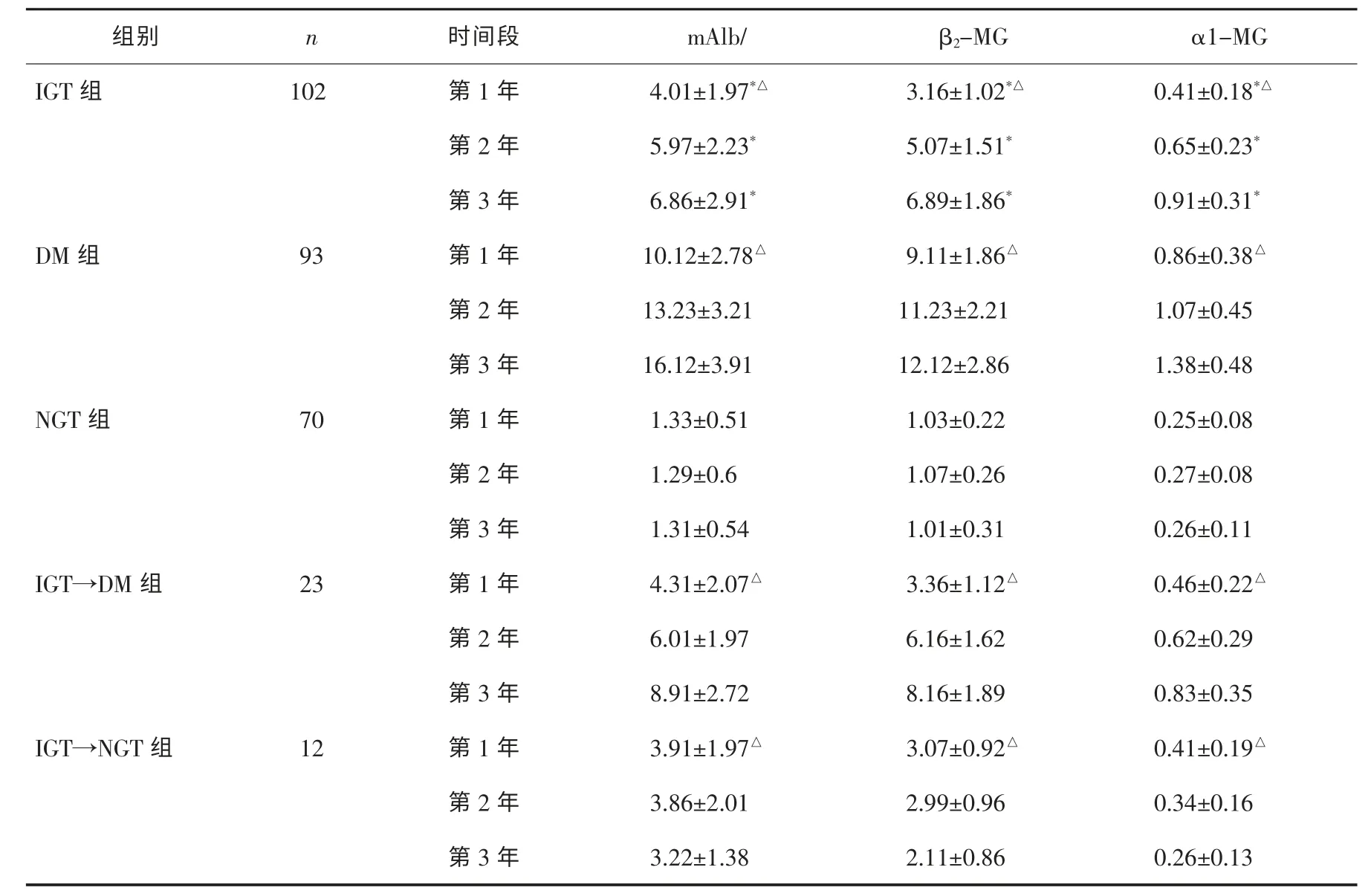
表1 IGT、DM 及NGT 组尿mAlb、β2-MG 和α1-MG 3 年动态检测结果 ,(mg·mmol-1)
* P<0.05 与NGT 组同一时段比较,△P<0.05 同组内第1 年与第3 年比较。
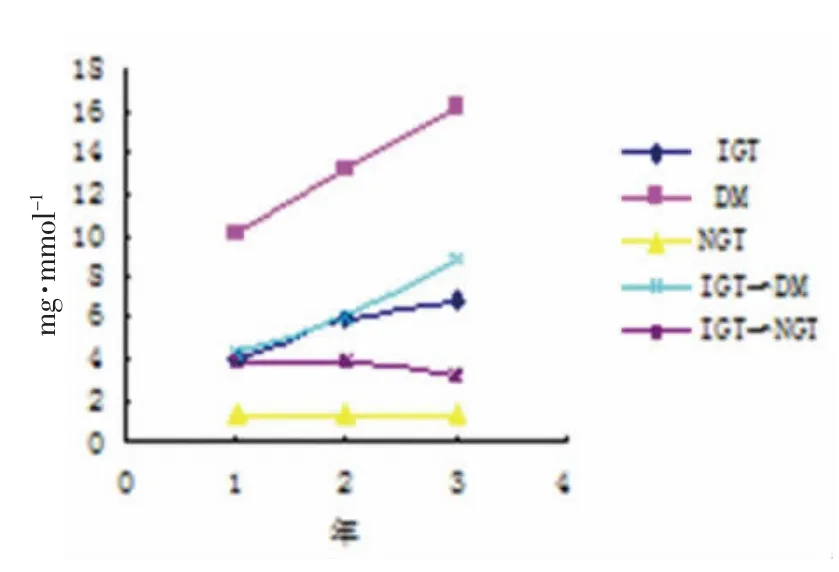
图1 各组病例尿mAlb 排泄率3 年变化趋势图
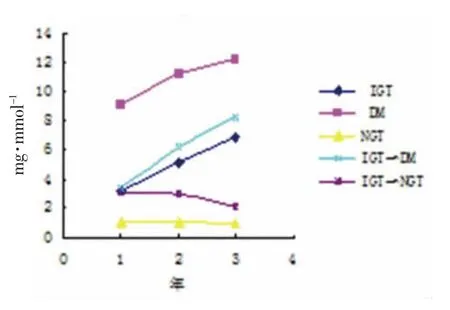
图2 各组病例尿β2-MG 排泄率3 年变化趋势图
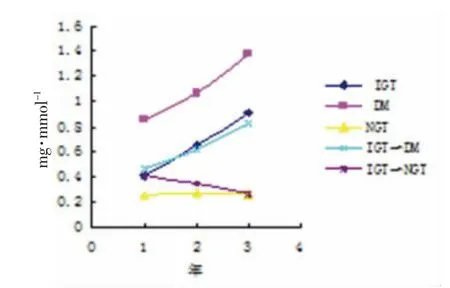
图3 各组病例尿α1-MG 排泄率3 年变化趋势图
3 讨论
2 型糖尿病肾病起病隐匿,从诊断DM 到出现临床蛋白尿,一般需5~10 年,而此时肾脏的病理改变已不可逆,即是严格控制代谢指标也不能控制肾病的发展进程。其病变机制是肾小球连续阴离子滤过屏障是由富含硫酸乙酰肝素、酸性氨基酸和唾液酸白蛋白多糖构成,长期高血糖可使这些成分合成及含量减低,使基底膜上的阴电荷丢失,对尿蛋白分子的电荷选择性下降而出现微量蛋白尿。同时长期高血糖可使肾小球毛细血管基底膜糖蛋白和糖基化蛋白增多,从而影响基底膜多肽的连结,使肾小球通透性增高,血浆蛋白滤过增加[6]。
糖耐量减低患者的转归有3 种:其一是进一步发展为糖尿病,其二仍保持糖耐量减低状态,此外就是恢复为正常糖耐量状态。佛山地区对糖耐量减低患者10 年的调查显示,IGT 转变为DM 的年转变率为5.43%,由IGT 发展为DM 的发病率达到54.3%,远高于IGT 保持者(37%)及恢复糖耐量正常者(8.7%)[7]。1 062 名朝阳市高市区居民的糖尿病的普查显示,在糖调节受损的人群中3 年后糖尿病累计发病率为33.8%[8],说明了IGT 转变为DM 的高风险。糖耐量受损向2 型糖尿病的转化主要表现为餐后血糖的持续升高,如果糖耐量受损状态未得到治疗,餐后血糖愈来愈高,则会通过“葡萄糖毒性作用”加重胰岛素的分泌缺陷。当胰岛素分泌缺陷加重时,机体处理餐后高血糖的能力进一步降低,葡萄糖不耐受的状况日趋严重,导致随机血糖或负荷后2 h血糖大于11.1 mmol·L-1,即进入糖尿病阶段患者。由于IGT 患者主要表现在餐后高血糖,尤其是部分患者在不知自身糖耐量异常的情况下,未进行饮食控制或其他方式的干预,其餐后血糖升高就更明显,持续时间更长,长期如此,同样可以导致肾小球基底膜上的阴电荷丢失和糖蛋白、糖基化蛋白的增多,使肾小球通透性增高而出现微量蛋白尿。
研究发现,糖尿病并发肾脏病变时并非局限于肾小球,而且常伴有或仅存在肾小管的病损[9],尿微量白蛋白测定主要是反映肾小球的受损,对肾小管的损伤预报不敏感,而α1-MG 和β2-MG 属小分子蛋白,且生成量较恒定,可自由通过肾小球滤过膜,并在肾近曲小管几乎全部被重吸收而分解。当肾近曲小管上皮受损时,α1-MG 和β2-MG 重吸收减少,其排泄率明显增加。因而尿α1-MG 和β2-MG 排泄率是反映肾近曲小管受损的敏感指标。
本实验数据显示,IGT 组任一时段的3 种尿蛋白排泄率均高于NGT 组,差异有统计学意义(P<0.05),与文献[10-16]报道相一致,说明IGT 患者存在早期肾损害的情况,其变化趋势是随着患病时间的推延而逐渐增高,与DM 患者或IGT 转化为DM 患者的变化相似,而IGT 转化为NGT 者其变化趋势刚好相反,3 种尿蛋白排泄率逐渐减低,说明早期肾损害的可逆性。
综上所述,肾损害在IGT 期就已经发生,因此在IGT 阶段就应加强开展对DN 的防治。对IGT 患者应进行正规的糖尿病知识教育,进行饮食控制和运动干预,控制高血压,降低体质量,治疗高血脂,消除各种危险因素,使IGT 患者的0GTT 检查恢复正常,减低微血管病变的发生。
[1]彭艳英,杨健,高霞,等.1817 名某大型企业在职职工糖尿病前期患病率调查[J].现代 预防医学,2008,(35)17:3391-3393.
[2]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006:355-358.
[3]王永斌.多项指标联合检测在糖尿病肾病早期诊断价值[J].现代医药卫生,2009,25(1):41-42.
[4]宋俊杰,陈艳露,李建忠.尿mALB α1-MG NAG 联合检测对糖尿病肾病早期诊断的价值[J].长治医学院学报,2008,22(1):66-67.
[5]袁静,王丽红.mALB、β2-MG、NAG 联合监测对糖尿病肾病的早期诊断价值[J].临床和实验 医学杂 志,2009,8(7):113.
[6]王佳懿.糖耐量减低患者血压、尿微量白蛋白等测定的临床意义[J].哈尔滨医药,2000,20(2):5-6.
[7]魏爱生,陈苹,王甫能,等.佛山市成人糖耐量减低患者十年转归追踪调查[J].中国糖尿病 杂志,2006,14(6):427-428.
[8]张海光,王岩,王旭辉.空腹血糖受损、糖耐量受损人群3年自然转归及其影响因素的研究[J].中国临床新医学,2009,2(7):706-710.
[9]Hong C Y,Chia K S.Markers of diabetic nephropathy[J].J Diabets Complications,1998,12 :43-60.
[10]彭赛蛟,闻树群.糖耐量减低者尿中β2-微球蛋白、α1-微球蛋白、转铁蛋白和微量白蛋白的变化[J].检验医学,2004,19(3):245-246.
[11]周忠,王新华,李龙平,等.糖耐量减低患者尿微量白蛋白排泄的探讨[J].医药世界,2006,8(6):83-84.
[12]徐骏,王露,钱才风.空腹血糖受损与糖耐量减低患者血清高敏C-反应蛋白和尿微量白蛋白变化的临床意义[J].中国实用医药,2008,3(24):123-124.
[13]陆菊明,潘长玉,田慧.糖耐量低减患者的尿白蛋白排出率观察[J].中国糖尿病杂志,1995,3(4):210-213.
[14]刘惠玲,安静琴,赵丽敏.糖耐量异常者尿微量白蛋白的观察[J].中国实验诊断学,1998,2(3):124.
[15]宗成国,杜怀东,王 敏.糖耐量减低患者尿中白蛋白、转铁蛋白、N-乙酰-β-D 葡萄糖苷酶和β2-微球蛋白的分析[J].中国检验医学与临床,2002,3(3):112-114.
[16]唐炳群,陈桂明,戴荣祥.糖尿病前期尿微量白蛋白检测对早期肾损伤防治的意义[J].中国卫生产业,2012,9(22):21.

