非遗传因素(年龄、性别)对肾移植患者他克莫司药物浓度影响的研究
魏筱华,段舟萍,b,温金华,邹德琴,郑雪莲
(南昌大学a.第一附属医院药剂科;b.研究生院医学部2012 级,南昌 330006)
他克莫司(tacrolimus,FK506)是从土壤真菌发酵液中提取的一种23 元大环内酯类免疫抑制剂,属钙调磷酸酶抑制剂,为与环孢素一样的防治肾移植术后排斥反应的常用药。因其治疗窗狭窄、药代动力学/药效学个体差异大,给临床应用带来了较大的困难,临床上常需要通过血药浓度监测及时调整用药剂量。目前,FK506 药代动力学差异的具体机制仍尚未完全明确,诸多的学者针对遗传因素如CYP3A5 和CYP3A4 基因多态性对肝、肾移植患者药物浓度的影响展开研究[1-3]。但导致药代动力学/药效学的个体差异还受到诸多其他非遗传因素(年龄、性别)的影响。本研究对86 例(804 例次)不同年龄、性别的肾移植患者FK506 药物浓度进行分析,探讨年龄和性别对肾移植患者药物浓度的影响。
1 对象与方法
1.1 研究对象
选择2009 年1 月至2012 年12 月在南昌大学第一附属医院接受肾移植1~12 个月的患者86 例,共监测804 例次。其中男62 例,年龄21~70 岁,监测589 例;女24 例,年龄18~71 岁,监测215 例次。
1.2 仪器与试剂
ARCHITECTi1000 化学发光免疫分析系统、离心机、复合质控及FK506 试剂均为美国雅培制药有限公司生产。
1.3 用药方案
患者肾移植术后均采用FK506+霉酚酸酯(MMF)+泼尼松龙(Pred)三联免疫抑制治疗方案。FK50 于术后第1 天起服用,0.1~0.15 mg·kg-1·d-1,分2 次给药,剂量随术后时间、血药浓度和患者的临床情况进行调整。建议空腹服用,或者至少在餐前1 h或餐后2~3 h 服用。必要时,可将胶囊内容物悬浮于水,经鼻饲管给药。
1.4 样本采集及测定
样本采集时间为服用FK506 12 h 后,空腹抽静脉血1~2 mL 置EDTA-K2 抗凝管中待测。86 例患者的采血情况:第1 个月每周采血2~3 次,第2-3个月采血4~8 次,第4-6 个月每2 周采血1 次,第7-12 个月每月采血1 次。
采用化学发光免疫分析法测定FK506。主要步骤:精确吸取样本全血200 μL,加入离心管中,精确加入200 μL 前处理液,振摇10 s,10 000 r·min-1离心5 min,取上清液于ARCHITECTi1000 全自动化学发光免疫分析仪内检测分析。
1.5 统计学方法
2 结果
随着年龄逐渐增大,FK506 血药浓度也有所增高,但差异无统计学意义(P>0.05);不同性别的患者对FK506 的血药浓度均不产生影响(P>0.05)。手术后2 个月,女性患者的血药浓度略低于男性患者,但在3 个月后的血药浓度却高于男性患者,并无呈现规律性的差异。见表1。
表1 肾移植术后不同性别患者不同年龄各时间段FK506 浓度的变化 ,μg·L-1
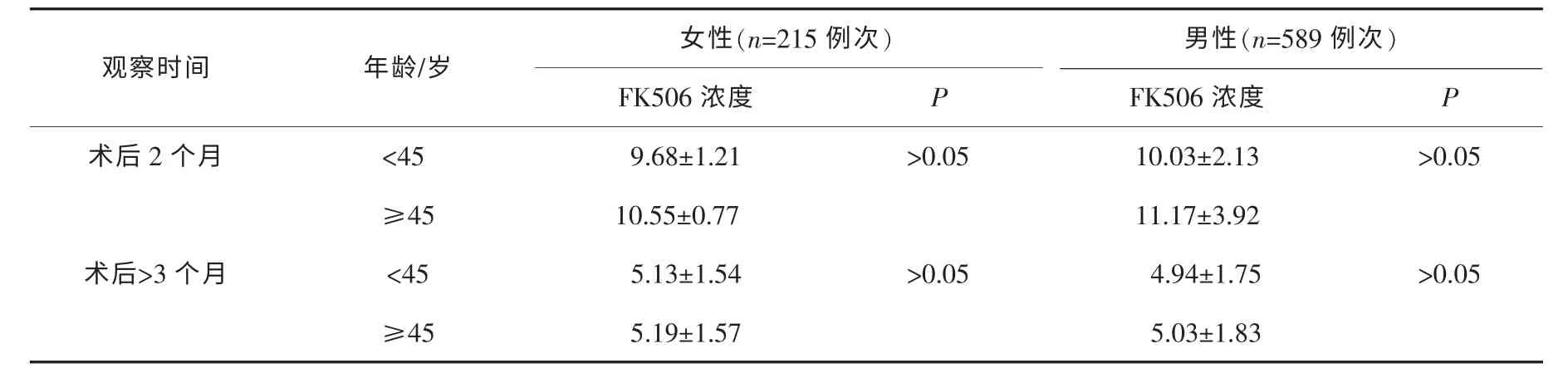
表1 肾移植术后不同性别患者不同年龄各时间段FK506 浓度的变化 ,μg·L-1
3 讨论
肾衰竭患者进行肾移植治疗是目前最有效的方法,但术后的排斥反应是导致肾移植失败的主要原因,因此免疫抑制剂能否合理应用成为肾移植患者预后的关键[1]。FK506 是目前防治肾移植术后免疫排斥反应的一线免疫抑制剂,广泛应用于肝、肾移植患者术后的治疗。但其生物利用度差异大、治疗窗窄,个体药代动力学差异明显。有研究[1]结果显示:不同个体在口服相同剂量的FK506 后血药浓度相差10 倍以上,仅有23.79 %的患者不经剂量调整可到达有效浓度范围,大部分患者需要经过较长时间的调整,易发生排斥反应或不良反应。FK506 个体差异的原因是什么? 随着遗传药理学和药物基因组学的发展,认为个体间遗传背景的不同可能是导致FK506 个体差异的主要原因之一。目前有较多针对CYP3A4 和CYP3A5 基因多态性与FK506 药物浓度的关联展开研究,发现肾移植患者术后服用FK506 C/D 值(血药浓度/剂量比)与CYP3A4、CYP3A5基因多态性具有显著相关性,并且肝CYP3A5 的基因多态性是FK506 药代动力学个体差异的主要原因[1-5],但CYP3A4*18 B 和CYP3A5*3 基因多态性与不良反应和排斥反应间差异无统计学意义[1]。
毋庸置疑,遗传因素是导致FK506 药物浓度差异的主要原因,但非遗传因素对其药物浓度及疗效的影响同样需要认真考虑。因为导致FK506 疗效与药代动力学个体化差异的原因除CYP 的基因多态性之外,还与肾移植患者自身的性别、年龄、身高,肝、肾功能,白蛋白、红细胞比容及合并用药等临床因素相关[6]。本研究针对肾移植患者的FK506 血药浓度和年龄、性别的关联进行了研究分析,结果显示:随着年龄增大,血药浓度也有所增高,但差异无统计学意义(P>0.05);不同性别的患者对血药浓度均不产生影响(均P>0.05)。笔者在研究过程中没有剔除CYP3A4、CYP3A5 基因突变型患者对研究结果的影响,因此,该研究结果还有进一步拓展的空间。同时,其他的非遗传因素如肝功能、合并用药等对FK506 的全血药物浓度的影响亦需要进一步的探讨,以期为临床合理用药提供更全面及更可靠的信息。
[1]朱琳,宋洪涛,王庆华,等.CYP3A4*18B 和CYP3A5*3 基因多态性对肾移植患者他克莫司剂量及浓度的影响[J].药学学报,2012,47(7):878-883.
[2]何霞,童荣生.CYP3A4 和CYP3A5 基因多态性对汉族肾移植患者他克莫司血药浓度的影响[J].2013,16(4):497-501.
[3]李洋,姜楠,郭宇,等.供受体CYP3A5 和MDR1 基因 多态性与肝移植术后患者他克莫司浓度/剂量比的关系[J].中山大学学报:医学科学版,2012,33(1):49-53.
[4]侯明明,宋洪涛,王庆华,等.肾移植患者CYP3A5*3 基因多态性对他克莫司血药浓度/剂量比和疗效的影响[J].中国医院药学杂志,2010,30(4):313-316.
[5]朱琳,华之卉,宋洪涛.他克莫司的药物基因组学与个体化用药[J].中国临床药理学与治疗学,2011,16(6):710-715.
[6]付绍杰,王彦斌,于立新,等.肾移植受者他克莫司剂量/浓度个体差异影响因素及其变化规律[J].南方医科大学学报,2008,28(12):2161-2164.

