麻疯树籽壳总黄酮的提取及其羟基自由基清除作用
马 博 张婷婷 黎远成 仝海娟
(百色学院化学与生命科学系,广西 百色 533000)
麻疯树(JatrophacurcasL.)为大戟科麻疯树属多年生灌木或小乔木植物,别名膏桐、小桐子等。因其种子油脂组成与其它植物油脂相似,且含油量高而成为一种重要的生物能源树种,加上麻疯树抗逆性强,广泛分布于热带、亚热带地区,成为一种备受青睐的非粮木本油料作物[1]。据报道[2,3],到2015年全球麻疯树种植面积将达1 280万hm2,中国将达800万hm2,那么届时将生产大量的麻疯树种子。此外,麻疯树在民间可全株入药[4,5]。目前,国内外学者已从麻疯树的根茎叶等部位分离得到包括黄酮类在内的多种生物活性物质。其中,已报道的麻疯树叶中黄酮类物质有牡荆素、异牡荆素、芹素、5,4′-二羟-6,7葡萄糖苷黄酮及5-羟-3,7,4′-鼠李糖苷黄酮;根中黄酮类物质有5-羟基吡咯-2-酮,嘧啶-2,4-酮及川皮苷;茎皮中黄酮类物质有5,4′-二甲羟基-3,7,3′-三甲氧基黄酮,5,3′,4′-三羟基-3,7-二甲氧基黄酮及槲皮素-3-甲醚;籽粕中黄酮类物质有嘧啶-2,4-酮,3′-甲氧基黄酮及胡萝卜苷[6-8]。此外,范树国等[9]用3种不同方法测定了麻疯树中的总黄酮含量,并比较了根茎叶的黄酮含量;Zhang等[10]利用响应面法优化了麻疯树叶中总黄酮的提取工艺,并对其抗菌活性进行了研究。麻疯树籽壳为其种子硬化的外种皮,当前有关其黄酮的研究还未见有报道。本研究拟针对麻疯树籽壳中的总黄酮,通过正交试验优化其提取条件,并研究其提取物(JCF)的羟基自由基(·OH)清除能力,旨在为今后麻疯树籽壳的资源化利用提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
麻疯树籽:FD-8号,广西南宁富民达生物能源科技有限公司;
2,6-二 叔 丁 基-4-甲 基 苯 酚 (butylated hydroxytoluene,BHT):色谱纯(>99.0%),阿拉丁化学试剂有限公司;
芦丁标准品:纯度>98.0%,国药集团化学试剂有限公司;
抗坏血酸(Vc):分析纯,国药集团化学试剂有限公司;
邻菲啰啉和硫酸亚铁:分析纯,天津市光复科技发展有限公司;
硝酸铝:分析纯,广东光华科技股份有限公司;
亚硝酸钠:分析纯,天津市福晨化学试剂厂;
无水乙醇:分析纯,西陇化工公分有限公司;
石油醚(30~60℃):分析纯,天津市富宇精细化工有限公司。
1.1.2 主要仪器设备
紫外可见分光光度计:UV-2700型,日本岛津公司;
电子分析天平:FA2004型,上海舜宇恒平科学仪器有限公司;
高速冷冻离心机:TGL-16M型,湘仪离心机仪器有限公司;
旋转蒸发仪:RE-52型,上海亚荣生化仪器厂;
真空泵:SHB-Ⅲ型,郑州世纪双科实验仪器有限公司;数显恒温水浴锅:HH-S2型,金坛市医疗仪器厂;
鼓风干燥箱:DHG-9146A型,上海精宏实验设备有限公司;
中药粉碎机:LD-200型,长沙常宏制药机械设备厂。
1.2 方法
1.2.1 样品预处理 种子去杂除尘后脱仁,籽壳置于电热鼓风干燥箱内50℃干燥72h,粉碎、过60目筛,石油醚索氏回流脱脂12h、挥干石油醚,将其4℃保藏、备用。
1.2.2 总黄酮提取 取适量麻疯树籽壳粉末,置于圆底烧瓶中,在一定温度下用不同浓度和体积的乙醇溶液回流提取一段时间后,抽滤、定容。
1.2.3 总黄酮含量测定 采用亚硝酸钠—硝酸铝—氢氧化钠显色法[11]。修改如下:分别精密量取0.2mg/mL芦丁溶液(30%乙醇制)0,1.0,2.0,3.0,4.0,5.0mL,置入25mL容量瓶中,各加1.0mL 5%的NaNO2溶液,混匀后静置6min;再各加1.0mL 10%的 Al(NO3)3溶液,混匀,静置6min;最后各加10mL 4%的NaOH溶液,混匀,30%乙醇溶液定容,静置15min。以空白试剂为对照,在510nm处测定各自吸光度,再以吸光度为纵坐标、以芦丁的不同质量浓度为横坐标,绘制标准曲线,所得回归方程为Y=0.439 7x-0.000 5,R2=0.999 8,线性范围为0.2~1.0mg/mL。
1.2.4 总黄酮得率计算 取1.0mL麻疯树籽壳总黄酮提取液,置入25mL容量瓶中,按照1.2.3方法测定总黄酮提取液的吸光度,并代入回归方程,求出麻疯树籽壳提取液中总黄酮的质量浓度。代入式(1)计算麻疯树籽壳中总黄酮的含量。

式中:
R——总黄酮得率,%;
c——提取液中黄酮浓度,mg/mL;
v——黄酮提取液体积,mL;
n——稀释倍数;
m——麻疯树籽壳质量,g。
1.2.5 单因素试验设计
(1)乙醇浓度对麻疯树籽壳总黄酮得率的影响:在料液比1∶30(m∶V),乙醇浓度40%,50%,60%,70%,80%,7 0℃回流提取2.0h的条件下,考察提取溶剂乙醇浓度对麻疯树籽壳总黄酮得率的影响。
(2)提取时间对麻疯树籽壳总黄酮得率的影响:在料液比1∶30(m∶V),乙醇浓度60%,70℃回流提取0.5,1.0,1.5,2.0,2.5,3.0h的条件下,考察提取时间对麻疯树籽壳总黄酮得率的影响。
(3)料液比对麻疯树籽壳总黄酮得率的影响:在料液比1∶10,1∶20,1∶30,1∶40,1∶50(m∶V),乙醇浓度60%,7 0℃回流提取时间2.5h的条件下,考察料液比对麻疯树籽壳总黄酮得率的影响。
(4)提取温度对麻疯树籽壳总黄酮得率的影响:在料液比1∶30(m∶V),乙醇浓度60%,分别于40,50,60,70,80,85,90,95℃回流提取2.5h的条件下,考察提取温度对麻疯树籽壳总黄酮得率的影响。
1.2.6 正交试验设计 在单因素试验结果的基础上,确定正交试验所用因素的3个水平,按照L9(34)正交试验表进行设计,每个条件组合平行3次试验。
1.2.7 羟基自由基(·OH)清除试验 采用邻二氮菲—Fe2++H2O2氧化法[12]。0.75mmol/L的邻二氮菲 溶液1.0mL,加入0.2mol/L的PBS 2.0mL和不同质量浓度的麻疯树籽壳总黄酮溶液1.0mL,混匀,加入0.75mmol/L的F eSO4溶液1.0mL,立即混匀。再加入0.01%(V/V)H2O2溶液1.0mL启动反应,37℃恒温水浴1.0h后,于536nm处测定吸光度,记录为A样,用1.0mL蒸馏水代替不同质量浓度麻疯树籽壳总黄酮溶液,其余步骤同上,测得吸光度记录为A损,用2.0mL蒸馏水分别代替H2O2和不同质量浓度麻疯树籽壳总黄酮溶液,其余步骤同上,测得吸光度记录为A未,平行3次。按式(2)计算·OH清除率(η1):

2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇浓度对麻疯树籽壳总黄酮得率的影响 随着乙醇浓度增加,溶剂渗透力增强,弱极性黄酮得率也随之增加;当乙醇达到一定浓度后,弱极性黄酮溶出达到动态平衡,而极性黄酮得率却不断减少,加上色素、鞣质等脂溶性杂质与弱极性黄酮竞争溶剂,致使其向主体溶剂扩散速度减慢,致使黄酮总得率降低。由图1可知,乙醇浓度为60%时,黄酮提取得率达到最大,故选择乙醇浓度60%作为后续单因素试验条件。
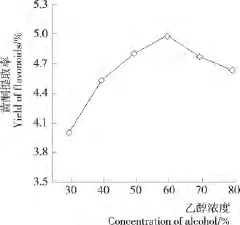
图1 乙醇浓度对麻疯树籽壳总黄酮得率的影响Figure 1 Effect of alcohol concentration on the total flavonoids yield of Jatropha curcus L.seed shell
2.1.2 提取时间对麻疯树籽壳总黄酮得率的影响 黄酮提取是一个传质过程,平衡需要一定时间。如果时间过短,传质平衡未达到,黄酮提取得率就偏低;当传质过程基本平衡后,再延长提取时间,黄酮得率也不会有显著增加,而热稳定性较差的黄酮却一直在降解。由图2可知,随着提取时间的增加,黄酮得率也不断上升;但超过2.5h后,麻疯树籽壳总黄酮的得率有所下降,故选择提取时间2.5h作为后续单因素试验条件。

图2 提取时间对麻疯树籽壳总黄酮得率的影响Figure 2 Effect of extraction time on the total flavonoids yield of Jatropha curcus L.seed shell
2.1.3 料液比对麻疯树籽壳总黄酮得率的影响 由图3可知,随着料液比的增加,黄酮提取得率不断增加,达到1∶30(m∶V)后,黄酮得率增加不明显。这是因为料液比增加,物料与溶剂之间黄酮浓度差增大,传质阻力变小,有利于黄酮的溶出;但料液比达到一定比例后,黄酮基本溶出,再增加料液比,黄酮得率变化不大,且物耗和能耗增加,不利于黄酮后续精制。故选择料液比1∶30(m∶V)作为后续单因素试验条件。
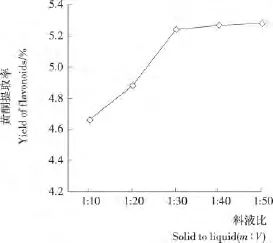
图3 料液比对麻疯树籽壳总黄酮得率的影响Figure 3 Effect of ratio of solid to liquid on the total flavonoids yield of Jatropha curcus L.seed shell
2.1.4 提取温度对麻疯树籽壳总黄酮得率的影响 温度升高,分子运动加剧、溶剂黏度降低、传质过程加快,有利于溶质扩散和溶剂渗透,进而有助于麻疯树籽壳总黄酮的提取。由图4可知,麻疯树籽壳总黄酮提取得率随着提取温度上升而增加,90℃时达到最大,为6.576%。试验过程中发现,60%乙醇在85~90℃时核状沸腾,95℃时膜状沸腾,溶剂损失大、杂质溶出较多,不利于黄酮溶出,黄酮得率减少。故选取85℃作为后续试验优化的条件。
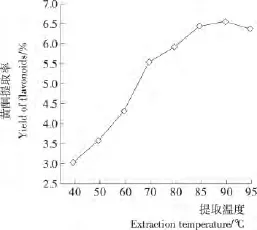
图4 提取温度对麻疯树籽壳总黄酮得率的影响Figure 4 Effect of extraction temperature on the total flavonoids yield of Jatropha curcus L.seed shell
2.1.5 提取次数对麻疯树籽壳总黄酮得率的影响 由图5可知,第1次黄酮提取得率为6.379%,占3次黄酮提取得率之和的89.5%。考虑到试验可行性,以及减小试验误差,故确定后续正交试验提取1次。
2.2 正交试验优化结果与分析
根据单因素试验结果,确定了乙醇浓度、提取时间、料液比及提取温度4个因素的水平(表1),进行L9(34)正交试验。正交试验结果见表2。
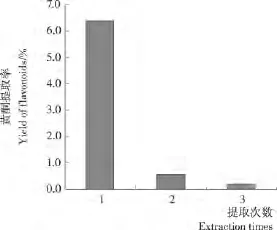
图5 提取次数对麻疯树籽壳总黄酮得率的影响Figure 5 Effect of extraction times on the total flavonoids yield of Jatropha curcus L.seed shell

表1 正交试验因素水平Table 1 Levels of orthogonal test factors
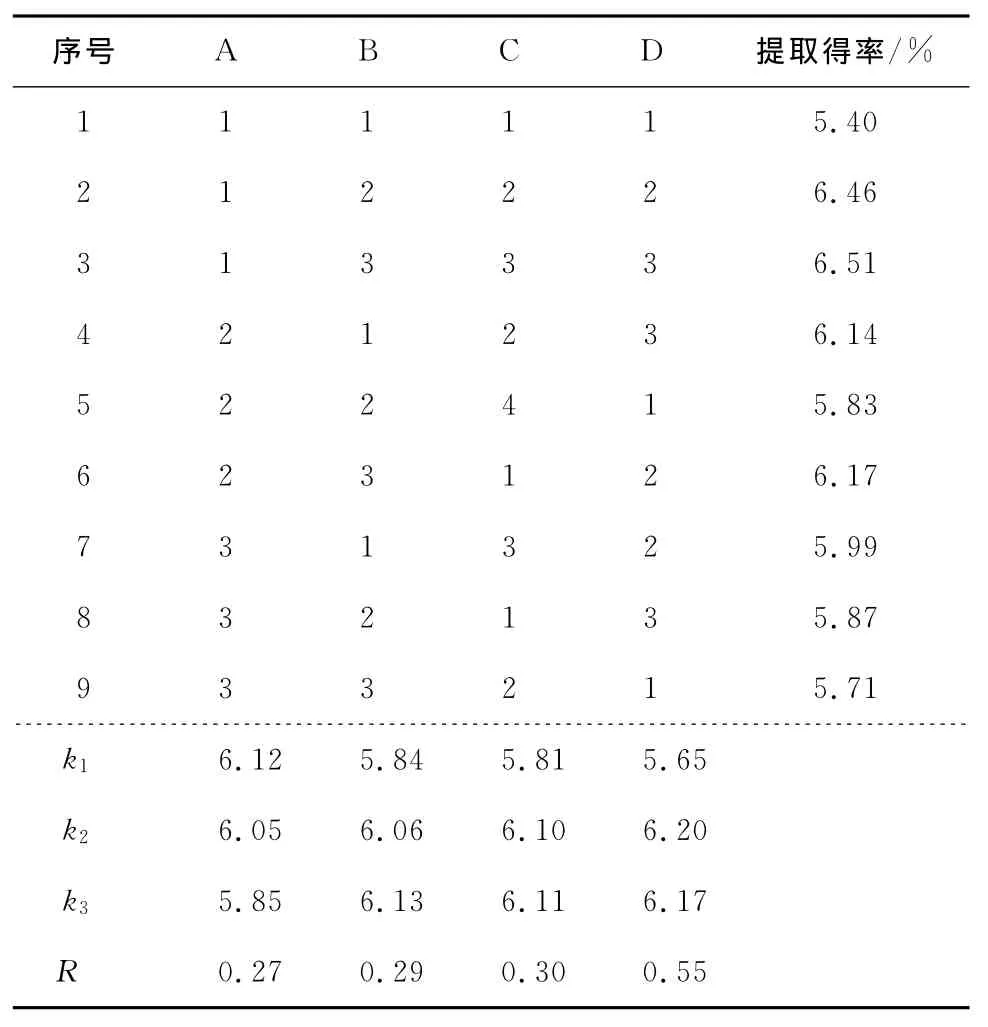
表2 正交试验结果与分析Table 2 Results of orthogonal test
由正交试验结果的极差R可以看出,麻疯树籽壳的总黄酮提取得率影响因素大小依次为提取温度、料液比、提取时间和乙醇浓度。最佳的因素组合为A1B3C3D2,即乙醇浓度50%、提取时间3.0h,料液比1∶40(m∶V),提取温度85℃。
2.3 验证实验
在最佳的提取因素组合(A1B3C3D2)条件下,进行3次平行试验,麻疯树籽壳的总黄酮平均得率为6.61%,RSD为1.9%,大于L9(34)正交试验表所有因素组合的试验结果,表明本试验优化的提取条件较为可靠,重现性好,达到了优化的目的。
2.4 羟基自由基清除作用
·OH作为一种得电子极强的活性氧,能够使脂质过氧化、核酸断裂及其它生物大分子降解等,对生物机体危害极大。麻疯树籽壳总黄酮的·OH清除作用见图6。在测定的质量浓度范围内,麻疯树籽壳提取物与对照Vc和BHT的·OH清除能力均随着质量浓度的上升而增强,且存在剂量依赖关系;但在相同质量浓度下,麻疯树籽壳乙醇提取物的·OH清除率均比Vc和BHT大,其黄酮半数抑制浓度(IC50)为0.130mg/mL,分别大于 Vc和BHT的0.164mg/mL和0.462mg/mL。当麻疯树籽壳提取物中的黄酮质量浓度为0.3 mg/mL时,其·OH清除率达89.95%,说明麻疯树籽壳提取物具有很强的·OH清除能力。
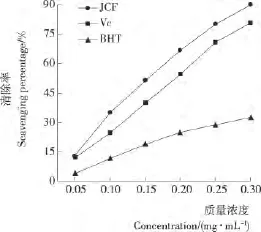
图6 麻疯树籽壳乙醇提取物对羟基自由基的清除作用Figure 6 Scavenging activity of ethanol extract from Jatropha curcus L.seed shell on hydroyxl radicals
3 结论
本试验利用回流法优化了麻疯树籽壳中的总黄酮提取工艺,提取因素乙醇浓度、提取时间、料液比及提取温度对麻疯树籽壳总黄酮得率的影响依次增大,最佳提取工艺组合为乙醇浓度50%、提取时间3.0h,料液比1∶40(m∶V),提取温度85℃;在此条件下总黄酮提取平均得率为6.61%,高于文献[9]报道的麻疯树根、茎、叶的3.055 0%,0.422 0%,4.874 5%。另外,麻疯树籽壳黄酮提取物具有较强的·OH清除力,其IC50为0.130mg/mL,分别高于抗氧化剂Vc和BHT。鉴于以上结果,麻疯树籽壳可以作为天然抗氧剂的生产原料。但今后还有必要对麻疯树籽壳中的黄酮进行分离纯化与结构表征,通过体内与体外方法更为全面评价其抗氧化性能,以便更深入的了解麻疯树籽壳黄酮与其抗氧化性能之间的构效关系。
1 马博,兰翠玲,李力,等.麻疯树籽粕饲用品质改良及其深加工技术研究进展[J].中国油脂,2011,36(5):26~30.
2 Richard Brittaine,NeBambi Lutaladio.Jatropha:a smallholder bioenergy crop:the potential for pro-poor development,integrated crop management[M].Rome:Food and Agriculture Organization of the United Nations,2010:12.
3 Meng Ye,Caiyan Li,George Francis,et al.Current situation and prospects of Jatropha curcas as a multipurpose tree in China[J].Agroforest systems,2009,76(2):487~489.
4 江苏新医学院.中药大辞典[M].上海:上海科技出版社,1993.
5 中国科学院云南植物研究所.云南植物志[M].北京:科学出版社,2006.
6 范菊娣.麻疯树根基种子的化学成分研究[D].贵阳:贵州大学,2006.
7 徐俊驹,谭宁华.麻疯树酚性成分研究[J].中国中药杂志,2012,37(20):3 074~3 077.
8 夏咸松,严胜骄,林军.小桐子油粕的化学成分研究[J].云南民族大学学报(自然科学版),2011,20(2):96~98.
9 范树国,陈安林,邱璐,等.3种方法测定麻疯树中总黄酮的含量[J].江苏农业科学,2010(2):290~292.
10 Shengtan Zhang,Guohua Cheng,Jingming Lin,et al.Optimization of Jatropha curcas for total flavonoids by response surface methodology and antibacterial activity[J].Journal of Medicinal Plants Research,2011,5(14):3 329~3 334.
11 王艳丽,何煜波,曹晓宁,等.辣椒叶中总黄酮提取工艺的优化[J].食品与机械,2013,29(3):138~140,168.
12 谢贞建,焦士荣,唐鹏程.枳实类黄酮体外抗氧化作用研究[J].林产化学与工业,2009,29(4):33~36.

