日本鳗鲡脾脏抗菌肽抗菌活性检测方法的比较
梁 英 黄文树 关瑞章
(1.集美大学水产学院,厦门 361021;2.集美大学鳗鲡现代产业技术教育部工程研究中心,厦门 361021)
抗菌肽是普遍存在于生物体内一类广谱抗微生物的小分子多肽的总称,通常其分子质量小于10 ku。抗茵肽不仅具有广谱抗细菌的能力,对真菌、病毒以及寄生虫等均有杀伤作用,是先天性免疫防御系统的重要组成部分[1-3]。抗菌肽的作用及应用效果是有目共睹的。然而,大多数内源性抗菌肽在动物体内的含量极其微少,难以获得大量的样品[4]。特别是在分离纯化的后期,获得的一些珍贵的单一蛋白质样品,其质量仅为微克级,能用于检测抗菌活性的蛋白质的量则更少。因此,建立微量而敏感的抑菌试验方法在内源性抗菌肽的开发研究中极为重要。
关于抗菌肽抗菌活性测定的方法有很多,其中扩散法是最常规的方法,目前国内外学者多采用此方法进行抗菌肽活性的检测[5-6]。96孔细胞培养板稀释法在检测抗菌肽最低抑菌浓度的同时,可得到不同浓度抗菌肽对指示菌生长抑制作用的变化曲线[7-8]。生物自显影法在达到活性跟踪目的的同时还可以初步验证单一抗菌活性组分[9]。这些方法都有各自的优缺点,目前尚无统一的标准方法用于抗菌活性的检测,基于分离材料、方法和阶段的不同,关键是要选择一种简单易行、灵敏度高的方法。马瑜等[10]比较了两栖类皮肤抗菌肽抗菌活性检测技术。邬晓勇等[11]建立了一种在蛙皮抗菌肽分离纯化过程中简单、快速、灵敏的检测抗菌活性的方法。齐珂珂等[12]建立了鸡白细胞中抗菌肽的分离纯化及活性鉴定方法。李秀兰等[13]研究了家蚕抗菌肽琼脂糖孔穴扩散法与比浊法测定抗菌活性的差异及其相关性。在鱼类抗菌肽的分离过程中多采用抑菌圈法和微孔液体稀释法检测抗菌活性。Zhang等[14]采用抑菌圈法跟踪分析大黄鱼肾脏抗菌肽分离纯化过程中纯化蛋白质抗菌活性的检测。Lauth等[1]采用微孔液体稀释法检测抗菌肽moronecidin的抗菌活性。Fernandes等[15]采用双层琼脂扩散法检测组蛋白H2A的抗菌活性。但目前专门针对鱼类抗菌肽活性检测技术比较研究的报道较少。Birkemo等[16]采用琼脂板孔穴扩散法和微孔液体培养法2种方法检测了hipposin和pleurocidin的抗菌活性,发现微孔液体培养法比琼脂板孔穴扩散法更灵敏。因此,即使对同一种检测对象而言,检测方法不同表现出来的抗菌活性也不尽相同。本研究以日本鳗鲡脾脏小于10 ku的蛋白质为抗菌肽样品,探讨了琼脂板孔穴扩散法、微孔液体培养法及微量液体培养法这3种方法用于检测抗菌肽抗菌活性的灵敏度,旨在建立一种比较灵敏、快速的抗菌活性检测方法,为日本鳗鲡脾脏中新型抗菌肽的分离纯化和鉴定奠定基础。
1 材料与方法
1.1 主要药物和试剂
10 ku切向流中空纤维柱购自Amersham公司。冰醋酸、牛肉膏、蛋白胨、琼脂、氯化钠等购自上海化学试剂公司,均为分析纯。
1.2 试验菌株及菌液制备
迟钝爱德华菌(Edwardsiella tarda,编号B09)、气单胞菌(Aeromonas sp.,编号 B18)、嗜水气单胞菌(Aeromonas hydrophila,编号 B27)均由本实验室分离至患病鳗鲡,-80℃保存于本实验室菌种库,细菌编号为本库编号。将3株菌分别接种于牛肉膏蛋白胨培养基平板,30℃恒温培养24 h,挑取平板上单菌落接种于牛肉膏蛋白胨培养基斜面。用0.85%生理盐水将斜面上的细菌苔洗脱,用酶标仪调节菌液浓度至1×108CFU/mL左右备用。
1.3 日本鳗鲡脾脏醋酸粗提物的制备及切向流超滤
选择体重约500 g的日本鳗鲡,外观无明显病变和损伤,剖取鳗鲡脾脏,加入10倍体积的10%醋酸,用组织匀浆机匀浆后,用磁力搅拌器在4℃搅拌过夜,沸水浴10 min,迅速置冰上保存,设置离心温度为4℃,8 000×g离心60 min,取上清液冻干。冻干样品用超纯水溶解后用10 ku切向流中空纤维柱超滤,整个系统压力保持55~69 kPa,滤过的蛋白质即为脾脏中分子质量小于10 ku的抗菌肽样品,冷冻干燥备用。
1.4 3种抗菌活性检测方法的比较
将从日本鳗鲡脾脏中提取的小于10 ku的抗菌肽样品用超纯水溶解,配制成1 200μg/mL的储备液,蛋白质浓度测定参照Bradford[17]的方法。3 种检测方法均设置了 60、30、20、10、7、4 和 2 μL 7个加样体积,对应的蛋白质质量分别为Q1(72.0 μg)、Q2(36.0 μg)、Q3(24.0 μg)、Q4(12.0 μg)、Q5(8.4 μg)、Q6(4.8 μg)和 Q7(2.4μg)。3种方法中,上述选取的3株菌均设置105和104CFU/mL 2个细菌浓度。
1.4.1 琼脂板孔穴扩散法检测抗菌活性
取15μL 1×108CFU/mL菌液加入平皿内,待培养基冷却至45℃,将培养基倒入平皿,每个平皿约15 mL,置水平位置迅速旋动平皿,使培养基和菌液充分混匀,分别制备3株致病菌的检测平板,细菌浓度为 105CFU/mL。取 1.5 μL 1×108CFU/mL菌液以同样方法分别制备3株致病菌的检测平板,使细菌浓度为104CFU/mL。每个平板内打8个孔(孔径为5 mm),标记后,在第1~7孔内分别加入与7个蛋白质质量相对应体积(分别为60、30、20、10、7、4 和2 μL)的抗菌肽样品,第8个孔加入60μL 0.85%生理盐水作为阴性对照,28℃培养24 h后观察并测量抑菌圈大小,记录试验结果。每个蛋白质质量的抗菌肽样品做3个重复。
1.4.2 微孔液体培养法检测抗菌活性
参照Anderson等[18]的方法略加修改。在96孔细胞培养板的孔中分别加入与7个蛋白质质量相对应体积的抗菌肽样品和同样体积的菌液,即60μL抗菌肽样品+60μL菌液、30μL抗菌肽样品+30μL菌液……;在对照孔中加入相应体积的0.85%生理盐水和同样体积的菌液,即 60μL 0.85%生理盐水+60 μL 菌液、30 μL 0.85%生理盐水+30μL菌液……。设置2个细菌浓度,分别为105和104CFU/mL。将细胞培养板置28℃培养1 h,而后每孔中分别加入与7个蛋白质质量对应体积的无菌MHB培养基,即试验孔:60μL抗菌肽样品+60μL菌液+60μL无菌MHB培养基、30μL抗菌肽样品+30μL菌液+30μL无菌MHB培养基……;对照孔:60μL 0.85%生理盐水+60μL菌液+60μL无菌 MHB培养基、30μL 0.85%生理盐水+30μL菌液+30μL无菌MHB培养基……。28℃继续培养24 h后,在酶标仪上检测600 nm处的吸光度值(A600)。每个蛋白质质量的抗菌肽样品做3个重复。按下列公式计算抑菌指数:
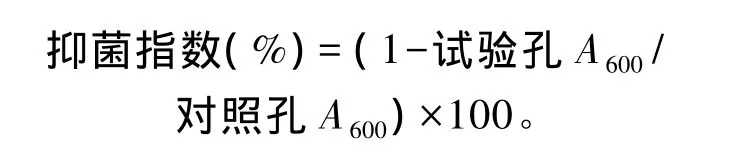
1.4.3 微量液体培养法检测抗菌活性
参照陆婕等[19]方法进行适当改进。试验组:取与7个蛋白质质量相对应体积的抗菌肽样品和同样体积的菌液混合,即60μL抗菌肽样品+60μL菌液、30μL抗菌肽样品+30μL菌液……;对照组:取相应体积的0.85%生理盐水和同样体积的菌液混合,即60μL 0.85%生理盐水+60μL菌液、30μL 0.85%生理盐水+30μL菌液……。设置2个细菌浓度,分别为105和104CFU/mL。28℃孵育1 h,期间将普通培养基熔化后倒平板,待其凝固,分别取试验组和对照组的混合液点样于普通培养基上,尽量涂布均匀,28℃培养24 h后,分别计算试验组和对照组培养基上生长的菌落数(N)。每个蛋白质质量的抗菌肽样品做3个重复。按下列公式计算杀伤指数:
杀伤指数(%)=(1-试验组N/对照组N)×100。
1.5 数据统计分析
试验数据用平均值±标准误(mean±SE)表示,采用SPSS 13.0软件进行单因素方差分析(oneway ANOVA)和 Duncan氏法检验,以P<0.05为差异显著,P>0.05为差异不显著。
2 结果与分析
2.1 琼脂板孔穴扩散法检测抗菌活性
60μL抗菌肽样品对105和104CFU/mL 2个浓度的B09、B18和B27菌株表现出最强的抗菌活性,其次为30μL,从20μL开始逐渐递减体积的样品对3株菌均无抗菌活性。60和30μL的抗菌肽样品对浓度为105CFU/mL的B09菌株的平均抑菌圈半径分别为3.0和1.0 mm;对浓度为105CFU/mL的B18菌株的平均抑菌圈半径分别为4.0和0 mm;对浓度为105CFU/mL的 B27菌株的平均抑菌圈半径分别为3.0和2.0 mm(表1)。60和30μL抗菌肽样品对浓度为104CFU/mL的B09菌株的平均抑菌圈半径分别为3.0和0 mm;对浓度为104CFU/mL的 B18菌株的平均抑菌圈半径分别为4.0和2.0 mm;对浓度为104CFU/mL的B27菌株的平均抑菌圈半径分别为 4.0 和 3.1 mm(表 2)。对照组中 0.85%生理盐水对105和104CFU/mL 2种浓度的 B09、B18和B27菌株均无抗菌活性。
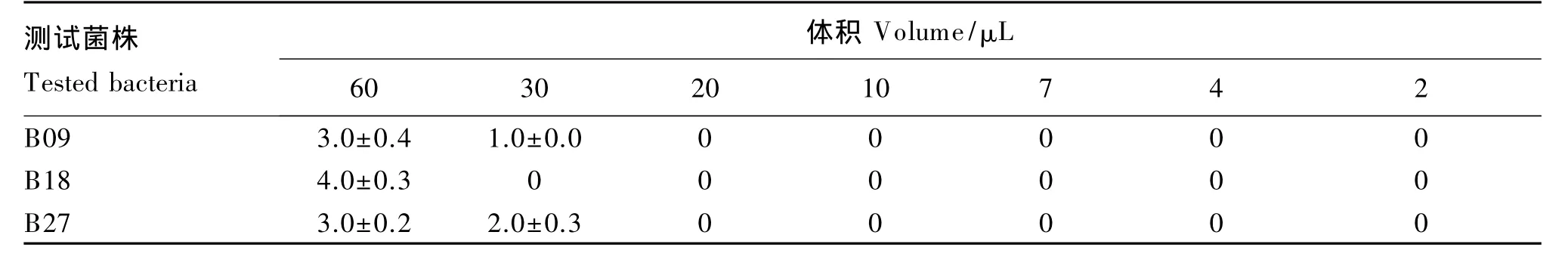
表1 7个体积的抗菌肽样品对105 CFU/mL B09、B18和B27菌株的抗菌活性(以抑菌圈半径表示)Table 1 Antibacterial activities of antibacterial peptide samples with seven kinds of volume against 105 CFU/mL B09,B18 and B27 strains(represented by radius of inhibitory ring) mm
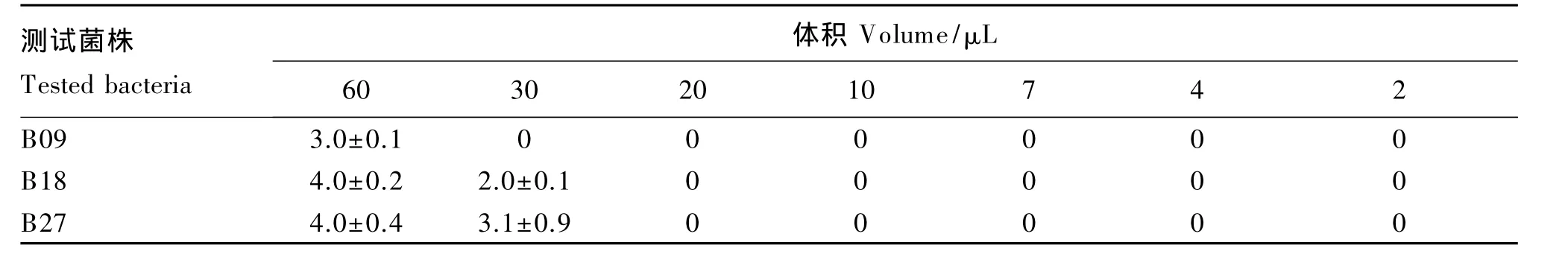
表2 7个体积的抗菌肽样品对104 CFU/mL B09、B18和B27菌株的抗菌活性(以抑菌圈半径表示)Table 2 Antibacterial activities of antibacterial peptide samples with seven kinds of volume against 104 CFU/mL B09,B18 and B27 strains(represented by radius of inhibitory ring) mm
2.2 微孔液体培养法检测抗菌活性
在此方法中,与10、7、4和2μL抗菌肽样品相对应的加样体积,即10μL抗菌肽样品+10μL菌液+10μL MHB培养基(共30μL)、7μL抗菌肽样品+7μL菌液+7μL MHB培养基(共21μL)、4μL抗菌肽样品+4μL菌液+4μL MHB培养基(共12μL)、2μL抗菌肽样品+2μL菌液+2μL MHB培养基(共6μL),未能覆盖满孔底,当用酶标仪进行检测时这4组数据受干扰较大,而以肉眼判断的结果不准确,无法对其分析。60、30、20μL 3个体积的抗菌肽样品对浓度为105CFU/mL的B09、B18和B27菌株的抗菌活性高于对浓度为104CFU/mL的对应菌株的抗菌活性,且这3个体积的抗菌肽样品对2种浓度的B09菌株的抗菌活性明显低于B18和B27菌株,3个体积的抗菌肽样品对2个浓度的B18和B27菌株的抗菌活性大体呈现为:30μL>60μL>20μL。当待试菌浓度为105CFU/mL时,对于B09菌株,60和30μL 2个体积的抗菌肽样品的抗菌活性显著低于20μL体积的抗菌肽样品(P<0.05);对于B18和B27菌株,60和20μL 2个体积的抗菌肽样品的抗菌活性显著低于30μL体积的抗菌肽样品(P<0.05)(表 3)。 当 待 试 菌 浓 度 为104CFU/mL时,对于 B09菌株,60和30μL 2个体积的抗菌肽样品的抗菌活性无显著差异(P>0.05),但二者均显著低于20μL体积的抗菌肽样品(P<0.05);对于 B18菌株,60和 30 μL 2个体积的抗菌肽样品的抗菌活性显著高于20μL体积的抗菌肽样品(P<0.05);对于 B27菌株,60和20μL 2个体积的抗菌肽样品的抗菌活性显著低于30μL体积的抗菌肽样品(P<0.05)(表4)。对照孔中均见到弥散浑浊细菌沉淀,表现为无抗菌活性。

表3 3个体积的抗菌肽样品对105 CFU/mL B09、B18和B27菌株的抗菌活性(以抑菌指数表示)Table 3 Antibacterial activities of antibacterial peptide samples with three kinds of volume against 105 CFU/mL B09,B18 and B27 strains(represented by antibacterial index) %

表4 3个体积的抗菌肽样品对104 CFU/mL B09、B18和B27菌株的抗菌活性(以抑菌指数表示)Table 4 Antibacterial activities of antibacterial peptide samples with three kinds of volume against 104 CFU/mL B09,B18 and B27 strains(represented by antibacterial index) %
2.3 微量液体培养法检测抗菌活性
在此方法中,与 60、30、20、10 μL 抗菌肽样品相对应的加样体积,即60μL抗菌肽样品+60μL菌液(共120μL)、30μL抗菌肽样品+30μL菌液(共60μL)、20μL抗菌肽样品+20μL菌液(共40μL)、10μL 抗菌肽样品+10μL 菌液(共20μL),因加样体积太大,不能在一个琼脂培养板上同时点样,故无法检测抗菌活性。7、4和2μL的抗菌肽样品对浓度为105CFU/mL的B09、B18和B27菌株的杀伤指数均为0。7μL的抗菌肽样品对浓度为104CFU/mL的B09、B18和B27菌株的杀伤指数分别为0、50%和40%,抗菌活性大体呈现为:B18>B27>B09,4和 2μL的抗菌肽样品对浓度为104CFU/mL的B09、B18和B27菌株均无抗菌活性。对照组中浓度为105和104CFU/mL的B09、B18和B27菌株在培养基上生长良好。
3 讨论
琼脂板孔穴扩散法中,60μL(72μg)的抗菌肽样品对浓度分别为105和104CFU/mL的B09、B18和B27这3个菌株均表现出最强的抗菌活性,其次为30μL(36μg),但后者的抑菌圈大小不明显。从20μL(24μg)开始逐渐递减体积的抗菌肽样品对上述3个菌株均无抗菌活性。微孔液体培养法中,60和30μL的抗菌肽样品对浓度分别为105和104CFU/mL的3个菌株均表现出较强的抑菌活性,其中对B18和B27菌株的抑菌指数基本达到55%以上;20μL的抗菌肽样品对3个菌株仍表现出较强的抗菌活性。同样蛋白质质量的抗菌肽样品在上述2种检测方法中表现出来的抗菌活性有明显差异,产生此差异的原因可能有2个方面:一方面,在制作琼脂板时,由于培养基厚度难以准确控制,经常导致同一培养皿中各点的厚薄不均,由此产生抑菌圈大小和抗菌肽量不成比例[20-21];另一方面,以往的研究结果发现水溶性好的小分子物质在琼脂板孔穴扩散法中具有很好的扩散行为,而对于抗菌肽类大分子则表现为扩散能力有限,往往得不到较好的结果,这是因为抗菌肽实现其活性的空间结构可能被琼脂抑制,影响其真正地发挥出对细菌的抑制作用[11,22]。此外,在微孔液体培养法中,抗菌肽能直接与检测菌接触,克服了抗菌肽因分子结构复杂而无法在琼脂孔中快速扩散的问题,能够比较准确的反映抗菌肽的真实抗菌活性[11]。从加样体积上看,选择琼脂板孔穴扩散法检测抗菌活性存在样品需要量大、灵敏度低的缺陷。但是,相对来说其具有操作比较简单、试验结果直观的优点,在抗菌肽粗提阶段样品量较多且对样品抗菌活性的精确度要求不高时,可以选择这种方法。
传统的微孔液体培养法主要借助仪器进行检测,即通过检测550或600 nm处的吸光度确定抗菌肽的抗菌活性[23-25]。在本试验中,与 10、7、4、2μL抗菌肽样品相对应的加样体积未覆盖满孔底,采用酶标仪对其吸光度进行检测时,这4组数据受干扰较大,无法准确判断结果。由此可见,微孔液体培养法对于样品量的需求也必须要满足一定的体积。在试验过程中发现60、30和20μL 3个体积的抗菌肽样品对浓度为105CFU/mL的B09、B18和B27这3个菌株的抑菌活性反而高于浓度为104CFU/mL的对应菌株,推测在这种检测方法中,抗菌肽与菌液是直接接触的,被抗菌肽杀灭的细菌和存活的细菌以及抗菌肽与细菌相互作用后的产物均留在微量孔中,通过测量试验孔和对照孔的吸光度,以吸光度的差值来确定抗菌肽的抗菌活性,在抗菌活性的判断上难免产生干扰和误差[13]。此外,试验还发现 60、30和 20μL 3个体积的抗菌肽样品对2个浓度的3个菌株的抗菌活性不是理论上的逐渐减弱,而是出现了明显的波动。对于2个浓度的B09菌株,60和30μL的抗菌肽样品的抑菌活性显著低于20μL的抗菌肽样品;而对于2个浓度的B27菌株,60和20μL的抗菌肽样品的抑菌活性显著低于30μL的抗菌肽样品。出现这样一个明显差异的原因,推断可能是由于抗菌肽与不同细菌之间最佳的作用点不同,对此机理还需要进一步研究。因此,微孔液体培养法的灵敏度和准确度欠佳,并且此法需使用细胞培养板,成本较高,但是这种方法能够同时在一块细胞培养板上处理大批样品,在目前抗菌肽的抗菌活性检测中还是得到了广泛的应用。
微量液体培养法在传统的琼脂板孔穴扩散法和微孔液体培养法的基础上,既克服了琼脂板孔穴扩散法中抗菌肽类大分子在琼脂中扩散有限的缺点,也弥补了微孔液体培养法准确度欠佳的缺陷。此方法中,抗菌肽和细菌虽然也是直接接触,但是试验中是将抗菌肽和细菌的混合液先孵育后再点样于琼脂板上,这样只有存活下来的细菌会在琼脂板上生长,排除了死菌和作用产物的干扰,试验结果简单明了且准确性高。陆婕等[19]采用微量液体培养法用于测量最低抑菌浓度和分析杀菌能力,试验组中以没有长出菌落的对应样品的终浓度即为该样品对该菌的最低抑菌浓度,以有无长菌判断是否有杀菌能力。本试验中,作者对此方法进行适当改进,试验组与对照组的混合液点样于培养基上后,在此增加一个重要步骤,即对混合液进行均匀涂布,这样在培养一定时间后,可以分别数出试验组和对照组在培养基上生长的菌落数,从而较精确的计算出杀伤指数。因此,通过这样的改进,不仅可以对抗菌活性做定性分析,还可以进行定量分析。
从加样体积上看,本试验在3种检测方法中均设置了抗菌肽的最大加样量60μL,以保证试验的同步性和平行性。但在微量液体培养法中,要在1块琼脂板的空间上同时点样60μL抗菌肽样品+60μL菌液(共120μL)、30μL抗菌肽样品+30μL菌液(共60μL)、20μL抗菌肽样品+20μL菌液(共40μL)、10μL抗菌肽样品+10μL菌液(共20μL),则超过了1块琼脂培养板所承受的最大点样体积。换言之,微量液体培养法不需要如此多体积的样品。相反,小剂量样品(7μL抗菌肽样品+7μL菌液)表现出对浓度为104CFU/mL的B18和B27菌株均有抗菌活性。采用此方法,仅需8.4μg的抗菌肽样品就能获得明显的抗菌活性,样品需求量大大少于琼脂板孔穴扩散法和微孔液体培养法。但是,选择此方法需要指出的一个关键性的问题就是对菌液浓度的选择。因此,在本试验的3种检测方法中,对3个菌株均设置了105和104CFU/mL 2个细菌浓度。7μL抗菌肽样品对浓度为105CFU/mL的3个菌株均无抗菌活性,对浓度为104CFU/mL的B18和B27菌株有抗菌活性。这可能是微量体积的抗菌肽在面对浓度为104CFU/mL的菌液时,其中的抗菌肽分子尚能够对抗细菌,而当单位体积中的细菌数增加时,此时抗菌肽分子不足以对抗如此多的细菌,表现出无抗菌活性。当然,也不是细菌的浓度越低越好,有研究曾经选择更低浓度的菌液进行试验,由于细菌的生长也是群居性的,当单位体积中细菌数太少时,对照组的细菌在琼脂板上本身就不生长,从而无法比较试验结果[26]。
4 结论
通过对3种方法的比较发现,微量液体培养法比琼脂板孔穴扩散法和微孔液体培养法所需抗菌肽样品量少,且具有很高的灵敏度和准确性。该方法对分离纯化并鉴定纯度高、样品量少的抗菌肽的抗菌活性有着重要的应用价值,适用于日本鳗鲡脾脏中抗菌肽抗菌活性的检测。
[1] LAUTH X,SHIKE H,BUMSJC,et al.Discovery and characterization of two isoforms of moronecidin,a novel antimicrobial peptides from hybrid striped bass[J].The Journal of Biological Chemistry,2002,277(7):5030-5039.
[2] 梁英.抗菌肽的来源及应用[J].动物营养学报,2014,26(1):7-16.
[3] 黎观红,洪智敏,贾永杰,等.抗菌肽的抗菌作用及其机制[J].动物营养学报,2011,23(4):546-555.
[4] 岳昌武,莫宁萍,刘坤祥,等.抗菌肽的结构特点·作用机理及其应用前景[J].安徽农业科学,2008,36(5):1736-1739.
[5] 金莉莉,丁忠福,王秋雨.中国林蛙皮抗菌肽提取条件的优化研究[J].食品科学,2008,29(10):223-227.
[6] 赖仞,叶文娟,冉永禄,等.大蹼铃蟾皮肤分泌液中抗菌活性肽的分离纯化及其性质[J].动物学研究,1998,19(4):257-262.
[7] SIMMACO M,MIGNOGNA G,BARRA D.Antimicrobial peptides from amphibian skin:what do they tell us?[J]Biopolymers:Peptide Science,1998,47(6):435-450.
[8] SONNER A,KNOOP F C,PATEL M,et al.Antimicrobial properties of the frog skin peptide,ranatuerin-1 and its [Lys28] substituted analog[J].Peptides,2004,25(1):29-36.
[9] 邓小娟,曹阳,钟仰进,等.SDS-PAGE凝胶原位检测抗菌蛋白的活性——生物自显影技术[J].西南农业大学学报:自然科学版,2005,27(1):136-137.
[10] 马瑜,孙燕,李治.两栖类皮肤抗菌肽的分离纯化与抗菌活性检测技术[J].药物生物技术,2010,17(1):83-86.
[11] 邬晓勇,何钢,颜军,等.抗菌肽抑菌活性测定方法的研究[J].生物学通报,2011,46(4):4-7.
[12] 齐珂珂,康相涛,李国喜,等.鸡白细胞中抗菌肽的分离纯化及活性鉴定方法的建立[J].西北农林科技大学学报:自然科学版,2008,36(9):27-39.
[13] 李秀兰,戴祝英,张双全.抗菌肽琼脂糖孔穴扩散法与比浊法测活比较及其相关性[J].南京师大学报:自然科学版,1998,21(2):81-83.
[14] ZHANG J J,YAN Q P,JI R X,et al.Isolation and characterization of a hepcidin peptide from the head kidney of large yellow croaker,Pseudosciaena crocea[J].Fish & Shellfish Immunology,2009,26(6):864-870.
[15] FERNANDES J M O,MOLLE G,KEMP G D,et al.Isolation and characterization of oncorhyncinⅡ,a histone H1-derived antimicrobial peptide from skin secretions of rainbow trout,Oncorhynchus mykiss[J].Developmental and Comparative Immunology,2004,28(2):127-138.
[16] BIRKEMO G A,LÜDERS T,ANDERSEN Ø,et al.Hipposin,a histone-derived antimicrobial peptide in Atlantic halibut(Hippoglossus hippoglossus L.)[J].Biochimica et Biophysica Acta,2003,1646(1/2):207-215.
[17] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1/2):248-254.
[18] ANDERSON R S,BEAVEN A E.Antibacterial activities of oyster(Crassostrea virginica)and mussel(Mytilus edulis and Geukensia demissa)plasma[J].Aquatic Living Resources,2001,14(6):343-349.
[19] 陆婕,汪俊汉,钟雅,等.弱酸性家蝇蛆抗菌肽MD7095的分离纯化及性质研究[J].微生物学报,2006,46(3):406-411.
[20] 夏明明,徐上,李伟,等.高敏感薄层平板抗菌肽活性检测[J].农业生物技术学报,1995,3(2):19-24.
[21] 吴琦,杨美薷,钟德钰,等.琼脂糖弥散抗菌实验在检测腮腺唾液抗菌活性中的应用[J].华西口腔医学杂志,1995,13(3):201-206.
[22] 邬晓勇,何钢,颜军,等.蛙皮抗菌肽活性检测方法的筛选及其分离纯化[J].西南农业学报,2011,24(4):1564-1567.
[23] ISSACSON T,SOTO A,IWAMURO S,et al.Antimicrobial peptides with atypical structural features from the skin of the Japanese brown frog Rana japonica[J].Peptides,2002,23(3):419-425.
[24] LIANG Y,GUAN R Z,HUANG W S,et al.Isolation and identification of a novel inducible antibacterial peptide from the skin mucus of Japanese eel,Anguilla japonica[J].The Protein Journal,2011,30(6):413-421.
[25] HUANG W S,WANG K J,YANG M,et al.Purification and part characterization of a novel antibacterial protein scygonadin,isolated from the seminal plasma of mud crab,Scylla serrata(Forskål,1775)[J].Journal of Experimental Marine Biology and Ecology,2006,339(1):37-42.
[26] 沈萍,陈向东.微生物学[M].北京:高等教育出版社,2006:130-135.

