饲喂乳酸菌对母猪和哺乳仔猪生长性能、血清生化指标及粪便微生物数量的影响
楚青惠 汪官保 曾勇庆** 张 哲 赵 勇 张建梅 武慕达 谢伟仕
(1.山东农业大学动物科技学院,泰安 271018;2.山东宝来利来生物工程股份有限公司,泰安 271000;3.山东银宝食品有限公司养猪场,肥城 271611)
在现代养猪生产中,母猪的繁殖性能和健康状况直接影响猪场的经济效益,而在规模化、集约化的饲养管理条件下,母猪繁殖障碍等问题日趋严重,不少母猪处于亚健康状态,特别是抗生素引起的肠道的亚健康。广谱抗生素和化学药物等添加剂的滥用,不仅杀灭了致病菌,同时也杀死了益生菌,破坏了肠道微生物平衡,导致菌群生长失调[1-2]。为解决上述问题,以乳酸菌为主的高品质微生态制剂已经成为打造安全、高效养殖的首选添加剂[3-4]。
乳酸菌是一种安全、优质、高效的益生菌,是形态、生理学特性和代谢性能不完全相同的无芽孢、革兰氏阳性细菌的总称。天然乳酸菌饲料添加剂是通过微生物发酵,真空冷冻干燥,再经配制而成的活菌冻干菌粉制剂。大量研究表明,乳酸菌可起到防治消化道疾病和促进生长的双重作用[5],还能提高机体特异性免疫水平,通过加强宿主对有害菌非特异性免疫来提高机体抗病力[6]。本试验以母猪及哺乳仔猪为试验对象,系统研究添加不同剂量乳酸菌对母猪繁殖性能及哺乳仔猪生长性能的影响及其作用机理,以确定乳酸菌的适宜添加量,为乳酸菌制剂在养猪生产中的推广应用提供科学依据。
1 材料与方法
1.1 试验动物与分组
试验猪选自山东银宝食品有限公司养猪场,选择第4胎次、体重和体况相近、健康无病、妊娠后期(81~85 d)的长大(长白×大白)二元母猪40头,随机分成4组,每组10头,饲养于妊娠舍,预产期前7天母猪由妊娠舍转入产仔舍,舍内利用产床网上饲养,哺乳期21 d。各组试验猪进行1周的预试验后进入正试期,试验期间,基础饲粮采用玉米-豆粕型,参照NRC(1998)猪饲养标准配合而成,4%预混料和大料均不含任何抗生素和药物,基础饲粮组成及营养水平见表1。对照组及3个试验组母猪分别通过饮水每天每头饲喂0、200、250、300 mL的乳酸菌液,试验期80 d;各组哺乳仔猪通过饮水每天每头饲喂0、5、10、15 mL的乳酸菌液,试验期7 d,其他饲养管理按常规方法进行并保持一致。
乳酸菌液由山东宝来利来生物工程股份有限公司研发的乳酸菌自动发酵罐发酵制备,使用的菌种主要为植物乳杆菌与戊糖片球菌,发酵液活乳酸菌浓度≥1×109CFU/mL,乳酸含量≥30 mg/mL,pH 在 3.5~4.5 之间。

表1 基础饲粮组成与营养水平(风干基础)Table 1 Composition and nutrient levels of basal diets(air-dry basis) %
1.2 母猪繁殖性能及哺乳仔猪生长性能的测定
母猪繁殖性能:分别记录每头母猪的总产仔数、活仔数、弱仔数(初生重小于0.9 kg)、初生个体重和窝重。弱仔率为弱仔数占活仔数的比例,活仔率为活仔数占总产仔数的比例。根据母猪的产活仔数和乳房发育情况调整母猪带仔数,使母猪实际带仔数为10头左右,记录每头母猪的实际带仔数;育成率为母猪带仔数与断奶仔猪数的比例。
哺乳仔猪生长性能:测定哺乳仔猪21日龄的断奶个体重和窝重,分别计算4组仔猪在哺乳期间的增重速度。
1.3 母猪及哺乳仔猪的健康体况
试验期间记录各组母猪分娩滞产数、早产数、母猪三联征(MMA)(乳房炎、子宫炎、无乳综合征)发病数,以及哺乳仔猪腹泻状况。
滞产率为母猪从开产到产完仔猪总时间超过6 h的数量占总母猪数的比例;早产率为产仔日期比预产期提前的母猪数量占总母猪数的比例。
母猪体况评分[7]:在母猪断奶时,由3名工作人员按1~5分对母猪的膘况进行评定,1分=极度消瘦,2分=消瘦,3分=适度,4分=肥胖,5分=过肥。
仔猪腹泻状况评定[8]:观察并记录试验期间每头试验猪每天的腹泻情况;腹泻率=观察记录仔猪腹泻个数总和∕观察总天数。
仔猪皮毛发育状况评定[8]:在仔猪断奶前1天,由3名工作人员按1~5分对试验猪的皮毛发育状况进行评定,1分=皮毛非常粗糙,2分=皮毛粗糙,3分=皮毛较光滑,4分=皮毛光滑,5分=皮毛非常光滑并有光泽。
1.4 母猪再繁殖性能的测定
测定并分别统计4组母猪断奶至再发情的时间间隔,断奶后1~7 d、8~14 d内母猪发情数、未正常发情数,分析情期受胎率(母猪配种后25 d,用B超诊断母猪是否受胎)、情期返情率的差异。
1.5 母猪泌乳力、初乳成分及初乳免疫球蛋白G(IgG)含量的测定
以同窝存活仔猪哺乳至21日龄时的全窝增重代表母猪的泌乳力,包括寄养进来的仔猪在内,但寄出仔猪的体重不计在内;日泌乳力=[(断奶窝重-初生窝重)×3]/21[9]。
采集每头母猪的初乳(开产3 h以内)放入灭菌的离心管中,-20℃保存备用。用福斯乳汁分析仪测定初乳成分;初乳抗体G蛋白用猪IgG酶联免疫检测试剂盒检测,测定OD450nm值,根据标准曲线计算样品IgG含量,每个样品2个平行。
1.6 母猪血清抗氧化指标的测定
母猪妊娠110 d时08:00,每组随机挑选4头母猪(共16头)用真空采血管耳缘静脉采血10 mL,将分离的血清放入灭菌的离心管,-20℃保存备用。总超氧化物歧化酶(T-SOD)活性、总抗氧化能力(T-AOC)、丙二醛(MDA)含量分别采用南京建成生物工程研究所试剂盒检测,根据对应 OD550nm、OD520nm、OD532nm值计算。
1.7 母猪粪便微生物数量的测定
在母猪哺乳期5、10和15 d的09:00,于母猪饲喂前采集其粪便,-20℃保存备用[10-11];将每头母猪3次粪样等量混匀,取样用平板菌落计数法测定粪便微生物数量。大肠杆菌采用伊红美兰培养基,乳酸菌采用MRS培养基,总菌采用LB培养基,分别于37℃培养48 h后,记录菌落数,并换算成每克内容物所含菌落数。
1.8 数据统计与分析
试验数据采用SPSS 13.0统计软件进行单因素方差分析,用Duncan氏法多重比较检验,试验数据用平均值±标准差表示。
2 结果
2.1 饲喂不同剂量乳酸菌对母猪繁殖性能的影响
从表2可以看出,各组试验猪的死胎数、母猪带仔数、断奶仔猪数、仔猪初生重、初生窝重均差异不显著(P>0.05),其中,300 mL 组死胎数最少、活仔率最高,分别比对照组降低了63.16%、提高了8.00个百分点,仔猪初生重和初生窝重最高,分别比对照组提高了 7.09%、21.77%。与对照组相比,试验组仔猪断奶育成率分别提高了7.64、6.05和8.89个百分点。
2.2 饲喂不同剂量乳酸菌对哺乳仔猪生长性能的影响
从表3可以看出,与对照组相比,试验组仔猪断奶重、平均日增重均极显著提高(P<0.01),仔猪断奶重分别提高了22.70%、16.24%、23.48%,平均日增重分别提高了 30.54%、21.84%、29.76%。
2.3 饲喂不同剂量乳酸菌对母猪及哺乳仔猪健康体况的影响
从表4可以看出,试验组母猪哺乳期MMA发病率分别为 10.00%、0.00%、0.00%,而对照组的发病率为30.00%;与对照组相比,3个试验组断奶母猪体况评分分别显著或极显著提高了25.00%、37.50%和 29.17%(P<0.05 或 P<0.01)。与对照组相比,3个试验组哺乳仔猪腹泻率分别降低了5.62、5.79、6.84 个百分点;而断奶前 1 天仔猪皮毛发育状况评分则极显著提高(P<0.01),分别提高了35.48%、25.81%、45.16%。

表2 饲喂不同剂量乳酸菌对母猪繁殖性能的影响Table 2 Effects of different Lactobacillus feeding amounts on reproduction performance of sows
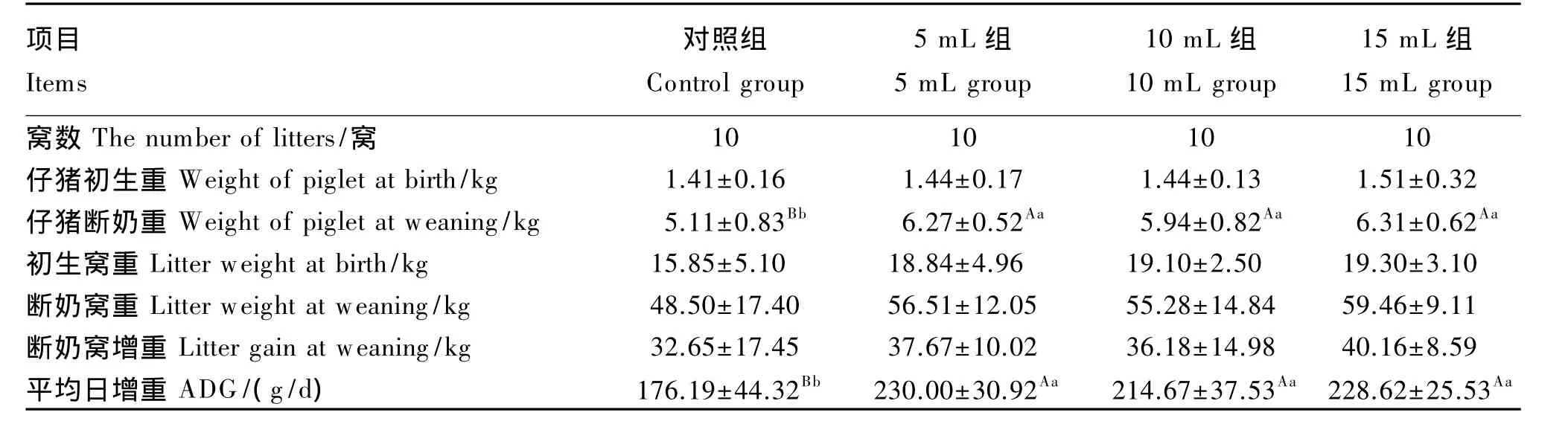
表3 饲喂不同剂量乳酸菌对哺乳仔猪生长性能的影响Table 3 Effects of different Lactobacillus feeding amounts on growth performance of suckling piglets

表4 饲喂不同剂量乳酸菌对母猪及哺乳仔猪健康体况的影响Table 4 Effects of different Lactobacillus feeding amounts on sow and suckling piglet healthy state
2.4 饲喂不同剂量乳酸菌对母猪再繁殖性能的影响
从表5可以看出,试验组母猪断奶后1~14 d内均正常发情,且情期受胎率为100.00%;而对照组未正常发情率为 30.00%,情期返情率为10.00%,情期受胎率只有 60.00%。
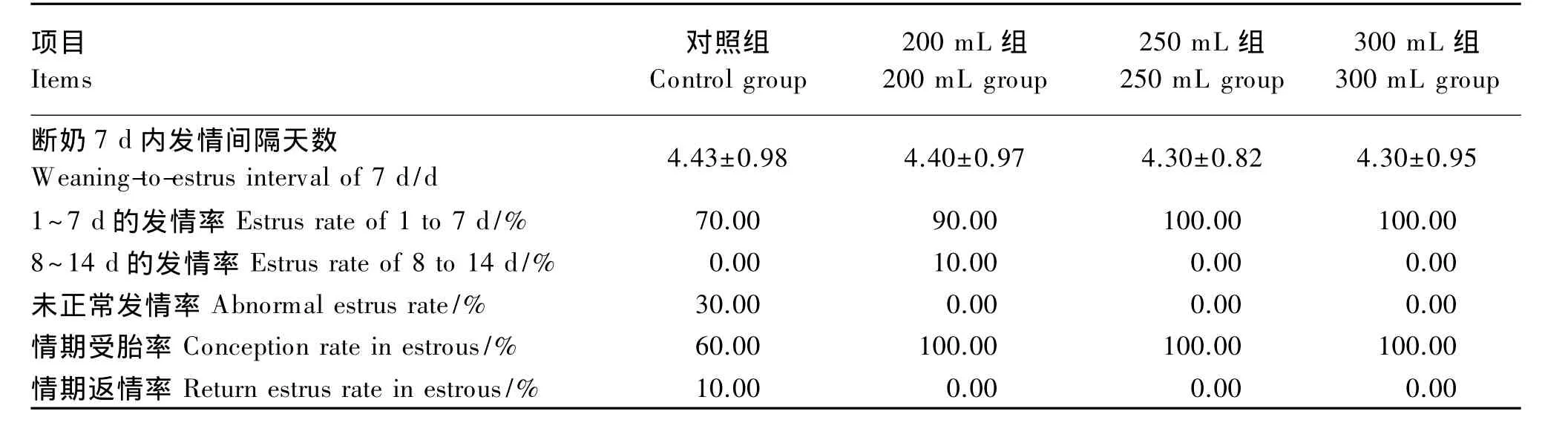
表5 饲喂不同剂量乳酸菌对母猪再繁殖性能的影响Table 5 Effects of different Lactobacillus feeding amounts on next reproduction performance of sows
2.5 饲喂不同剂量乳酸菌对母猪泌乳力、初乳成分及IgG含量的影响
从表6可以看出,饲喂乳酸菌液对母猪初乳IgG含量具有显著影响(P<0.05),与对照组相比,试验组分别提高了7.96%、9.24%、11.31%。同时,饲喂乳酸菌液对母猪日泌乳力、乳蛋白、乳脂含量也有提高趋势,与对照组相比,3个试验组母猪日泌乳力分别提高了15.45%、10.94%、23.18%,乳蛋白含量分别提高了15.29%、0.40%、4.14%,乳脂含量分别提高了 3.18%、23.25%、47.77%。
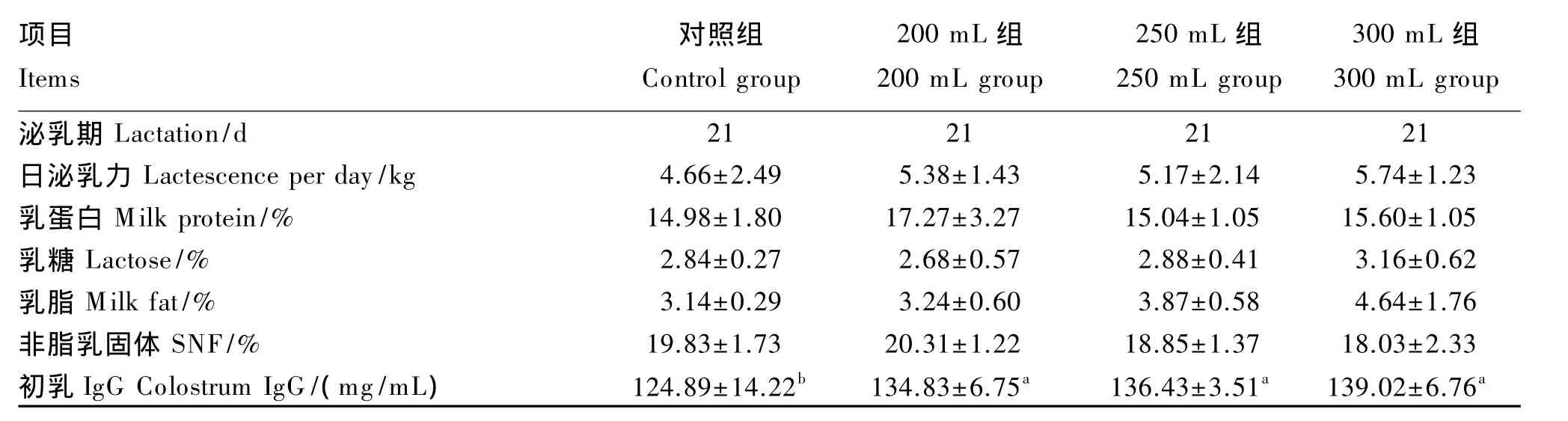
表6 饲喂不同剂量乳酸菌对母猪泌乳力、初乳成分及IgG含量的影响Table 6 Effects of different Lactobacillus feeding amounts on the lactescence,colostrum ingredients and IgG content of sows
2.6 饲喂不同剂量乳酸菌对母猪血清抗氧化指标的影响
从表7可以看出,饲喂乳酸菌液对母猪血清抗氧化指标有提高趋势,表现为T-SOD活性和T-AOC升高,MDA含量有下降趋势,其中,300 mL组的T-SOD活性、T-AOC最高,比对照组分别提高了13.74%、1.00%,而 MDA 含量最低,比对照组降低了 5.25%。
2.7 饲喂不同剂量乳酸菌对母猪粪便微生物数量的影响
从表8可以看出,与对照组相比,试验组母猪粪便中大肠杆菌数量分别降低了25.76%、25.62%、47.25%,其中,300 mL 组差异达显著水平(P<0.05);3个试验组粪便中沙门氏菌数量与对照组差异显著(P<0.05),尤其是 300 mL组的降低较为明显;3个试验组粪便中乳酸菌数量均有显著提高(P<0.05),分别是对照组的 3.99、4.19、4.70 倍。

表7 饲喂不同剂量乳酸菌对母猪血清抗氧化指标的影响Table 7 Effects of different Lactobacillus feeding amounts on serum antioxidative indexes of sows

表8 饲喂不同剂量乳酸菌对母猪粪微生物数量的影响Table 8 Effects of different Lactobacillus feeding amounts on the number of fecal microorganisms of sows 106 CFU/g
3 讨论
3.1 饲喂乳酸菌对母猪繁殖性能的影响
繁殖母猪是养猪场的核心,而随着集约化水平的提高,母猪超负荷生产,造成母猪繁殖障碍等问题日趋严重,使得猪群异常淘汰的比例剧增。因此,探讨高效益生菌在繁殖母猪及仔猪上的应用具有重要意义。本试验研究表明,给妊娠及泌乳母猪饲喂乳酸菌液能够提高繁殖性能,其中饲喂300 mL组的仔猪初生重、初生窝重以及仔猪断奶育成率最高;母猪哺乳期MMA发病率有所降低,母猪的泌乳力得到提高,为哺乳仔猪的生长发育提供了保障,也保证了断奶母猪具有良好的体况,从而缩短了断奶至再发情的时间间隔,并提高了试验组母猪的发情率和情期受胎率。
母猪饲粮中添加乳酸菌液能降低母猪肠道pH,调节母猪肠道内环境平衡,提高了营养物质的代谢和吸收[12],提高采食量和消化率,并能直接或间接地促进与泌乳有关激素的分泌,从而提高了哺乳母猪的泌乳性能;同时,减少母猪因泌乳造成体重大幅下降,防止母猪断奶至发情间隔延长、下一胎次产仔数减少等问题。
Otero等[13]研究表明,牛阴道乳酸菌作为益生菌可以通过抑制子宫内有害菌的生长来预防牛子宫炎症。乳酸菌在代谢过程中能够合成一类具有抑菌活性的小肽、多肽和多肽前体复合物即乳酸菌素,其可在致病菌细胞膜上形成亲水孔道,使胞内营养物质外泄,胞外水分子流入,从而达到抑制和杀死病原菌的目的[14],有效地阻止了腐败性细菌的异常增殖,抑制有害物质的产生,促进子宫复原,并且在一定程度上有利于母猪产后体质的恢复,降低母猪的生产应激[15]。
3.2 饲喂乳酸菌对哺乳仔猪生长性能的影响
本试验研究表明,哺乳仔猪添加乳酸菌液15 mL组提高断奶窝重幅度最大,试验组仔猪平均日增重与李国友等[16]报道的直接给仔猪灌服乳酸菌液对仔猪的增重效果较为一致,试验组仔猪腹泻率也有非常明显的改善。由于泌乳母猪和哺乳仔猪同时饲喂乳酸菌,一方面可以通过改善母猪泌乳性能,为仔猪提供充足的乳汁营养[15];另一方面可以改善哺乳仔猪肠道的微生态环境,从而有效促进了哺乳仔猪的生长发育和健康状况。
仔猪刚出生时的肠道是无菌的,出生以后随着仔猪哺乳以及与产床等环境的接触,外来菌群逐渐进入肠道,经过黏附和定植,建立自身的肠道菌群,维持着肠道的微生态平衡。因而对于初生仔猪,灌服一定剂量黏附性好的乳酸菌,可使乳酸菌较早地占据肠道有效位点,从而在生态位上竞争性地抑制其他病原菌的黏附,有效地阻止了有害菌的入侵[17-18],有利于降低仔猪腹泻等发病率。
3.3 饲喂乳酸菌对母猪繁殖性能和哺乳仔猪生长性能影响的作用机理
本试验研究表明,饲喂乳酸菌对提升母猪初乳中IgG含量的影响显著,对乳蛋白、乳脂含量也具有一定的影响,IgG是母猪初乳中的主要免疫球蛋白,能活化补体、清除病原体、增强仔猪免疫力[19]。初乳营养水平的高低尤为重要,初乳不仅提供了仔猪营养,还富含免疫球蛋白,能提供被动免疫,还有大量的肽、激素和酶等,这些生物活性物质能促进仔猪消化系统的发育及成熟,形成正常的肠道微生物区系,诱导肠道内正常消化液的分泌[20]。初乳营养水平及泌乳量直接影响仔猪生长性能及后期健康状况。初乳蛋白主要包含酪蛋白和乳清蛋白,乳清蛋白主要提供免疫球蛋白,而酪蛋白为氨基酸的主要来源[21],母乳中所含的蛋白质在仔猪体内消化率极高。Mcnamara等[22]指出,在产前2周增加一定量的脂肪摄入量能提高所产仔猪的活力[23],同时提高母乳中的脂肪含量。
饲喂乳酸菌对母猪血清抗氧化指标有提高趋势,并且其抗氧化性能是随乳酸菌饲喂剂量的增大而提高,说明添加较高剂量的乳酸菌更有利于提升母猪的抗氧化性能。母猪在分娩和泌乳过程中,生理调节发生了巨大的变化,机体消耗大量的能量和氧,可产生超氧阴离子(O2-)、羟自由基(·OH)等活性氧自由基(ROS),如不及时清除,细胞内大分子物质就会受到氧化损伤,影响母猪生产性能,产生一些代谢性疾病和乳腺疾病[24-25]。乳酸菌的菌体、由菌体破碎离心得到的无细胞提取物、胞外分泌物对O2-和·OH等ROS有较高的清除能力[26]。因此,给母猪饲喂乳酸菌液,可以在提高其生长性能的同时提高抗氧化酶和抗氧化物质等活性,从而清除过量的自由基,保护机体组织免受氧化损伤[27-28]。
另外,饲喂乳酸菌能够降低母猪粪便中大肠杆菌和沙门氏菌的数量,提高乳酸菌的数量,并且其效果是随乳酸菌饲喂剂量的提高而增大,这同样说明添加较高剂量的乳酸菌更有利于改善母猪的肠道微生态。Muralidhara等[29]研究发现,饲喂乳酸菌能显著降低仔猪肠道组织及粪便中大肠杆菌、沙门氏菌等有害菌的数量,增加乳酸菌菌群数量。肠道内的有益微生物增加而使潜在的致病性微生物减少,因而表现为排泄物中的有益微生物数量增加,致病性微生物数量减少。
4 结论
综上,对于妊娠后期和泌乳期母猪来说,每天每头饲喂 250~300 mL乳酸菌液即 2.5×1011~3.0×1011个乳酸菌菌落数对其生长性能、健康状况、血清抗氧化指标、粪便微生物数量等改善的效果最好;对于哺乳仔猪来说,每天每头饲喂10~15 mL乳酸菌液即 1.0×1010~1.5×1010个乳酸菌菌落数对其生长性能的改善效果最好。
[1] D’SOUZA A L.Probiotics in prevention of antibiotic associated diarrhoea:meta-analysis[J].British Medical Journal,2002,324(7350):1361.
[2] SØRUM H,SUNDE M.Resistance to antibiotics in the normal flora of animals[J].Veterinary Research,2001,32(3/4):227-241.
[3] 霍英军,代素贞.微生态制剂的作用机理及其在畜牧业中的应用现状[J].饲料与畜牧:新饲料,2013(1):35-39.
[4] DE LANGE C F M,PLUSKE J,GONG J,et al.Strategic use of feed ingredients and feed additives to stimulate gut health and development in young pigs[J].Livestock Science,2010,134(1/2/3):124-134.
[5] SCHILLINGER U,LÜCKE F K.Antibacterial activity of Lactobacillus sake isolated from meat[J].Applied and Environmental Microbiology,1989,55(8):1901-1906.
[6] 尹清强,李小飞,常娟,等.微生态制剂对哺乳和断奶仔猪生产性能的影响及作用机理研究[J].动物营养学报,2011,23(4):622-630.
[7] 杨伦,杨献鹏,曾勇庆,等.促甲状腺素释放激素对母猪泌乳等繁殖性能及仔猪生长性能影响的研究[J].猪业科学,2009,26(12):82-85.
[8] 曾勇庆,孙传禹,刘万成,等.黄霉素(flavomycin)对生长猪生产性能影响的研究[J].饲料广角,2004(17):41-43.
[9] 杨公社.猪生产学[M].北京:中国农业出版社,2002:201.
[10] 陈鲜鑫,王金全,王春阳,等.乳酸菌发酵液体饲料对生长猪生长性能和粪中微生物区系的影响[J].饲料工业,2010,31(4):40-42.
[11] 杭苏琴,毛胜勇,黄瑞华,等.断奶仔猪饲喂甘露寡糖后粪样菌群的变化[J].农业生物技术学报,2006,14(5):701-705.
[12] 李秋艳,夏先林,黄伟.日粮中添加微生态制剂对瘦肉型繁殖母猪生产性能的影响[J].贵州农业科学,2012,40(8):145-147.
[13] OTERO M C,MORELLI L,NADER-MACÍAS M E.Probiotic properties of vaginal lactic acid bacteria to prevent metritis in cattle[J].Letters in Applied Microbiology,2006,43(1):91-97.
[14] 房春红,刘杰,许修宏.乳酸菌素的研究现状和发展趋势[J].中国乳品工业,2006,34(2):53-55.
[15] 韦明宇,陆建明,赵武,等.NS复合乳酸菌制剂对母猪生产性能和免疫水平的影响[J].安徽农业科学,2012,40(5):2728-2730.
[16] 李国友,黄成金.微生态制剂对仔猪的生长效果观察[J].广西畜牧兽医,2011,27(5):283-285.
[17] COCONNIER M H,BERNET M F,CHAUVIERE G,et al.Adhering heat-killed human Lactobacillus acidophilus,strain LB,inhibits the process of pathogenicity of diarrhoeagenic bacteria in cultured human intestinal cells[J].Journal of Diarrhoeal Diseases Research,1993,11(4):235-235.
[18] 兰青.仔猪主要肠道菌群分布的研究和益生菌对仔猪生长发育及免疫功能的影响[D].硕士学位论文.雅安:四川农业大学:2008:22-24.
[19] KLOBASA F,WERHAHN E,BUTLER J E.Regulation of humoral immunity in the piglet by immunoglobulins of maternal origin[J].Research in Veterinary Science,1981,31(2):195-206.
[20] 张金枝,吴跃明,刘建新.母乳能量水平对仔猪生长的影响及其分子机理[J].中国畜牧杂志,2006,42(7):42-44.
[21] 王炳艳,李藏兰,吕刚,等.猪初乳免疫球蛋白研究进展[J].动物科学与动物医学,2004,21(7):16-18.
[22] MCNAMARA J P,PETTIGREW J E.Protein and fat utilization in lactating sows:Ⅰ.Effects on milk production and body composition[J].Journal of Animal Science,2002,80(9):2442-2451.
[23] 陈颋,何若钢,刘桂武,等.不同水平脂肪粉对母猪乳成分及乳激素的影响[J].养猪,2013(3):42-44.
[24] 陈丰,蒋宗勇,林映才,等.大豆异黄酮对哺乳母猪生产性能及抗氧化性能的影响[J].饲料博览,2010(8):1-5.
[25] VÁZQUEZ-AÑÓN M,NOCEK J,BOWMAN G,et al.Effects of feeding a dietary antioxidant in diets with oxidized fat on lactation performance and antioxidant status of the cow[J].Journal of Dairy Science,2008,91(8):3165-3172.
[26] 张江巍,曹郁生.乳酸菌抗氧化活性的研究进展[J].中国乳品工业,2005,33(1):34-36.
[27] LIN M Y,YEN C L.Antioxidative ability of lactic acid bacteria[J].Journal of Agricultural and Food Chemistry,1999,47(4):1460-1466.
[28] 胡晓丽,孙进,乐国伟,等.抗氧化乳酸菌在体外结肠环境清除羟自由基的研究[J].中国微生态学杂志,2009,21(6):488-492.
[29] MURALIDHARA K S,SHEGGEBY G G,ELLIKER P R,et al.Effect of feeding Lactobacillus on the coliform and Lactobacillus flora of intestinal tissue and feces from piglets[J].Journal of Food Protection,1977,40(5):288-295.

