脂多糖刺激对仔猪下丘脑-垂体-肾上腺轴Toll样受体4信号通路关键基因表达的影响
陈少魁 刘玉兰 李 权 朱惠玲 侯永清 吴欢听 王秀英 刘 称
(武汉轻工大学动物营养与饲料科学湖北省重点实验室,武汉 430023)
免疫应激导致仔猪生长抑制和饲料利用率降低[1],给畜牧生产造成一定的经济损失。研究表明,免疫应激与炎性细胞因子的过量产生密切相关,如肿瘤坏死因子-α(TNF-α)和白细胞介素-1(IL-1)、白细胞介素-6(IL-6)等[1]。这些炎性细胞因子可通过作用于外周组织或影响神经内分泌系统,从而导致生长抑制[1]。因此,调控炎性细胞因子的产生是缓解免疫应激的有效手段。
Toll样受体(TLRs)是近年来才发现的和免疫密切相关的受体家族,为一类模式识别受体,通过识别不同病原体的病原相关的分子模式(PAMP)在天然免疫和炎症反应中发挥重要作用。其中Toll样受体4(TLR4)是脂多糖(LPS)的受体,是TLRs家族中研究最多的一种。研究发现,TLRs为机体炎性反应链的启动蛋白,TLRs被激活后,可以激活其下游一系列信号分子,如髓样分化因子88(MyD88)、白细胞介素-1受体相关激酶1(IRAK1)、肿瘤坏死因子受体相关因子6(TRAF6)等,导致核转录因子-κB(NF-κB)的激活,而活化的NF-κB可以促进炎性细胞因子基因,如TNF-α、IL-1和IL-6的表达,从而启动机体的炎症反应[2]。
研究表明,当机体处于免疫应激状态时,免疫系统和神经内分泌系统之间是相互作用、相互影响的[3]。当受 LPS刺激时,TLR4信号通路被激活,导致NF-κB的激活,从而释放大量炎性细胞因子,而炎性细胞因子对神经内分泌系统发挥着重要的调控作用[4]。因此,我们可以推测TLR4信号通路也可能对仔猪神经内分泌系统发挥调控作用,从而对免疫应激起调控作用。在神经-内分泌-免疫网络中,下丘脑-垂体-肾上腺(HPA)轴是最主要的应激轴[3]。本研究通过给断奶仔猪注射LPS以模拟免疫应激状态,研究免疫应激对断奶仔猪HPA轴TLR4信号通路关键基因(包括TLR4、MyD88、IRAK1、TRAF6 和 NF-κB)mRNA 表达水平的影响,旨在为探索TLR4信号通路与免疫应激之间的相关性提供初步依据。
1 材料与方法
1.1 试验动物与设计
选择 12 头平均体重为(13.76±1.13)kg 的“杜×长×大”断奶仔猪,按体重相近原则,随机分配到2个组中,每个组6个重复,每个重复1头猪。预试10 d后,试验组注射100μg/kg体重的LPS(大肠杆菌血清型055∶B5,Sigma 公司)(LPS 组),对照组注射等量的生理盐水。试验前12 h停水停料。
1.2 血液样品采集及测定
1.2.1 样品采集
于注射LPS或生理盐水后4 h,从仔猪前腔静脉用肝素抗凝真空管分别采血7 mL离心(3 500 r/min,10 min),分离血浆,-80 ℃ 保存待测。
1.2.2 测定方法
采用放射免疫试剂盒(购自北京科美东雅生物技术有限公司)测定TNF-α含量;采用放射免疫试剂盒(购自北京北方生物技术研究所)测定皮质醇、促肾上腺皮质激素释放激素(CRH)、促肾上腺皮质激素(ACTH)含量。
1.3 组织样品采集
注射LPS或生理盐水4 h后,屠宰,取下丘脑、垂体、肾上腺,立即投入液氮冻存,随后转移至-80℃冰箱保存,用于提取组织总RNA。
1.4 mRNA 表达分析
1.4.1 主要仪器与试剂
7500 Real-time PCR仪(Applied Biosystems)、梯度升降温功能 PCR仪(TaKaRa)、Nanodrop 2000超微量分光光度计(Thermo)、Tanon-4100凝胶成像系统(上海天能)。总RNA提取试剂RNAiso Plus、cDNA合成试剂盒 PrimeScript RT reagent kit with gDNA eraser和real-time PCR试剂盒SYBR Premix Ex TaqTM(Tli RNaseH Plus)均购自宝生物工程(大连)有限公司。
1.4.2 测定方法
组织总RNA提取、cDNA合成、real-time PCR参照陈逢等[5]的方法。相对荧光定量PCR数据的计算采用 Livak 等[6]的 2-ΔΔCt法,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因。根据已发表的猪的 TLR4、MyD88、IRAK1、TRAF6、NF-κB、GAPDH的基因序列,利用Primer premier 6.0软件设计real-time PCR引物(表1),由宝生物工程(大连)有限公司合成。
1.5 统计分析
用SPSS 17.0软件进行 t检验,数据以平均值±标准误表示。以P<0.10表示具有显著性趋势,P<0.05 表示差异显著。
2 结果
2.1 LPS刺激对断奶仔猪血浆炎性细胞因子和激素含量的影响
由表2可知,LPS刺激后,血浆 TNF-α、皮质醇和ACTH含量显著上升(P<0.05)。LPS对血浆CRH 含量无显著影响(P>0.05)。
2.2 LPS刺激对仔猪TLR4信号通路关键基因表达的影响
TLR4信号通路关键基因 TLR4、MyD88、IRAK1、TRAF6、NF-κB 的 mRNA 表达水平见图 1~图5。LPS刺激导致TLR4在下丘脑、垂体、肾上腺中的mRNA表达水平显著升高(P<0.05)(图1)。LPS刺激导致MyD88在垂体、肾上腺中的mRNA表达水平显著升高(P<0.05),在下丘脑中的mRNA表达水平有升高的趋势(P<0.10)(图 2)。LPS刺激有提高IRAK1在垂体、肾上腺中mRNA表达水平的趋势(P<0.10),在下丘脑中无显著变化(P>0.05)(图3)。LPS刺激导致 TRAF6在下丘脑、垂体、肾上腺中的mRNA表达水平显著升高(P<0.05)(图4)。LPS 刺激导致 NF-κB 在垂体中的mRNA表达水平显著升高(P<0.05),在下丘脑、肾上腺中无显著变化(P>0.05)(图 5)。

表1 基因的引物序列Table 1 Primer sequences of genes

表2 LPS刺激对断奶仔猪血浆炎性细胞因子和激素含量的影响Table 2 Effects of LPS challenge on plasma proinflammatory cytokine and hormone contents of weaner piglets

图1 LPS刺激后TLR4 mRNA表达水平变化Fig.1 The change of TLR4 mRNA expression level after LPS challenge

图2 LPS刺激后MyD88 mRNA表达水平变化Fig.2 The change of MyD88 mRNA expression level after LPS challenge
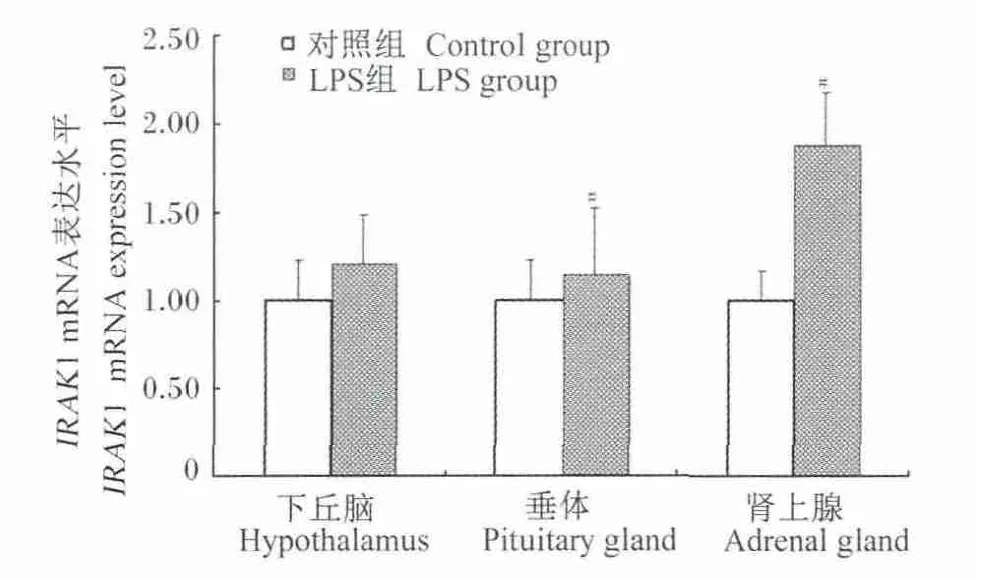
图3 LPS刺激后IRAK1 mRNA表达水平变化Fig.3 The change of IRAK1 mRNA expression level after LPS challenge

图4 LPS刺激后TRAF6 mRNA表达水平变化Fig.4 The change of TRAF6 mRNA expression level after LPS challenge

图5 LPS刺激后NF-κB mRNA表达水平变化Fig.5 The change of NF-κB mRNA expression level after LPS challenge
3 讨论
目前最经典的模拟免疫应激的方式是通过猪腹膜或静脉注射一定剂量的LPS[7]。LPS能诱导猪产生急性细菌感染症状,如厌食、嗜睡和发热等[7]。LPS刺激会使巨噬细胞合成和分泌IL-1、IL-6、TNF-α等炎性细胞因子。这些细胞因子可引起一系列代谢变化,同时它们也具有类似激素功能,可以将异源物质入侵信号传入中枢神经系统,改变神经内分泌,尤其会导致HPA轴激活[7]。本试验结果表明,LPS刺激导致断奶仔猪血浆炎性细胞因子TNF-α、皮质醇、ACTH含量显著上升,这表明LPS刺激导致猪发生急性免疫应激,HPA轴被激活。
TLRs是与免疫密切相关的模式识别受体(PRRs)[8]。目前已发现的 TLRs有10多种。其中,TLR4是识别LPS的关键分子,LPS刺激激活膜受体TLR4,TLR4与LPS聚合使信号转导到胞内。TLR4在胞内翻译起始区域与MyD88的羧基端结合,MyD88通过其死亡域与IRAK1的死亡域相结合,使IRAK1磷酸化。磷酸化后的IRAK1和TRAF6结合并使其激活。TRAF6最终使 NF-κB激活,活化的NF-κB最终转移到细胞核内,诱导炎性细胞因子(如 IL-1、IL-6、TNF-α 等)的过量表达,从而导致机体的炎症反应[9-10]。当动物机体遭受应激或感染时,免疫系统和神经内分泌系统之间是相互作用、相互影响的,这提示TLR4信号通路可能具有调控免疫应激仔猪神经内分泌系统的作用。又基于HPA轴是最主要的应激轴[3],本研究推测,TLR4可能对免疫应激仔猪HPA轴有调节作用,但目前有关此方面的研究未见报道。
本试验发现,LPS刺激导致TLR4传导通路关键基因(TLR4、MyD88、TRAF6、NF-κB)mRNA 表达水平显著上升,IRAK1 mRNA表达水平有升高趋势。其变化趋势与血浆TNF-α、皮质醇、ACTH含量一致。目前,有关LPS刺激对仔猪HPA轴TLR4传导通路关键基因表达的影响的研究未见报道。我们前期研究发现,LPS刺激导致仔猪肠道、肝脏和肌肉TLR4信号通路关键基因mRNA表达水平的上升[11-13]。与我们的研究结果类似,肖品品等[14]研究发现,大鼠癫痫持续状态 24 h后,TLR4在海马组织中表达活性增强。王意[15]研究表明,在手术及麻醉后,老龄大鼠海马CA3区TLR4、MyD88、NF-κB 及炎症因子 TNF-α、白细胞介素-1β(IL-1β)、IL-6等都呈现表达水平增高的趋势。此外,高音[16]发现,小鼠脑缺血再灌注状态下,海马CA1区和顶叶皮质均出现TLR4过表达,从而引起其胞内衔接蛋白MyD88表达水平增加,NF-κB被激活,并进一步导致炎症因子 IL-1β和TNF-α的过表达。汪军[4]也发现,创伤应激可导致大鼠下丘脑和肾上腺TLR4表达水平增加,炎性细胞因子合成和分泌增加。本试验结果提示,LPS应激诱导下丘脑、垂体和肾上腺中TLR4传导通路关键基因表达,导致炎性细胞因子的释放,从而导致HPA轴的过度激活。然而,Kanczkowski等[17]报道,虽然在肝脏和造血系统中MyD88缺失的小鼠,LPS诱导的肾上腺炎症和HPA轴激活显著降低,但是在肾上腺皮质中MyD88缺失的小鼠,其肾上腺炎症和HPA轴的激活并未发生显著改变。这表明免疫细胞(而不是肾上腺细胞)是LPS诱导的系统和肾上腺炎症反应的主要调节者。然而,Kanczkowski等[17]也指出,在系统炎症反应综合征的情况下,HPA轴激活并不完全依赖于系统TLRs信号。由此可见,HPA轴激活与TLR4信号通路的关系还需进一步试验进行验证。
4 结论
LPS刺激导致断奶仔猪HPA轴被激活,HPA轴中 TLR4传导通路关键基因 TLR4、MyD88、TRAF6、NF-κB mRNA 表达水平显著升高;IRAK1 mRNA表达水平有升高趋势。
[1] GABLER N K,SPURLOCK M E.Integrating the immune system with the regulation of growth and efficiency[J].Journal of Animal Science,2008,86(Suppl.14):E64-E74.
[2] SABROE I,PARKER L C,DOWER S K,et al.The role of TLR activation in inflammation[J].The Journal of Pathology,2008,214(2):126-135.
[3] HADDAD J J.Oxygen-sensitive pro-inflamnatory cytokines,apoptosis signaling and redox-responsive transcription factors in development and pathophysiology[J].Cytokines Cellular and Molecular Therapy,2002,7(1):1-14.
[4] 汪军.电针对创伤应激大鼠外周和中枢TLR2/4以及炎性细胞因子表达的调节作用与机制[D].博士学位论文.上海:复旦大学,2009.
[5] 陈逢,刘玉兰,李权,等.TLR4信号通路关键基因在断奶仔猪不同组织中的mRNA表达[J].中国畜牧杂志,2013,49(17):53-57.
[6] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J].Methods,2001,25(4):402-408.
[7] JOHNSON R W.Inhibition of growth by pro-inflammatory cytokines:an integrated view[J].Journal Animal Science,1997,75(5):1244-1255.
[8] SŁOTWIN'SKI R,SŁOTWI N'SKA S,KEDZIORA S,et al.Innate immunity signaling pathways:links between immunonutrition and responses to sepsis[J].Archivum Immunologiae et Therapiae Experimentalis,2011,59(2):139-150.
[9] 陈洁,姜虹.TLR4信号通路与炎性反应[J].医学综述,2009,15(19):2902-2904.
[10] LEE J Y,YE J,GAO Z,et al.Reciprocal modulation of Toll-like receptor-4 signaling pathways involving MyD88 and phosphatidylinositol 3-kinase/AKT by saturated and polyunsaturated fatty acids[J].The Journal of Biological Chemistry,2003,278(39):37041-37051.
[11] LIU Y L,CHEN F,ODLE J,et al.Fish oil increases muscle protein mass and modulates Akt/FOXO,TLR4 and NOD signaling in weaning piglets after lipopolysaccharide challenge[J].The Journal of Nutrition,2013,143(8):1331-1339.
[12] LIU Y L,CHEN F,ODLE J,et al.Fish oil enhances intestinal integrity and inhibits TLR4 and NOD2 signaling pathways in weaned pigs after LPS challenge[J].The Journal of Nutrition,2012,142(11):2017-2024.
[13] CHEN F,LIU Y L,ZHU H L,et al.Fish oil attenuates liver injury caused by LPS in weaned pigs associated with inhibition of TLR4 and nucleotide-binding oligomerization domain protein signaling pathways[J].Innate Immunity,2013,19(5):504-515.
[14] 肖品品,耿直.癫痫持续状态大鼠海马组织中NR1和TLR4的表达及其相关性[J].中风和神经疾病杂志,2013,30(12):1077-1079.
[15] 王意.TLR4信号通路在老龄大鼠术后认知功能下降中的作用研究[D].博士学位论文.长沙:中南大学,2013.
[16] 高音.TLR4介导的MyD88信号通路在小鼠脑缺血再灌注损伤中的作用[D].博士学位论文.沈阳:中国医科大学,2009.
[17] KANCZKOWSKI W,ALEXAKI V I,TRAN N,et al.Hypothalamo-pituitary and immune-dependent adrenal regulation during systemic inflammation[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(36):14801-14806.

