碘量法测定硫酸锰溶液中S2-含量
郭文林,刘智来,杜晓荣
(内蒙古鑫旺再生资源有限公司,内蒙古 鄂尔多斯 014300)
0 前言
电解金属锰的获得是在碳酸锰矿粉中加入硫酸溶液,将获得的硫酸锰溶液送电解槽电解析出单质金属锰。目前,碳酸锰矿粉在浸出后需要加硫化剂除去除溶液中的重金属离子,硫化剂有福美钠(S.D.D),Na2S,(NH4)2S,BaS 等。锰片当中的 S2-不能超过一定标准,所以需要控制电解液中的S2-含量。水中S2-的分析方法有亚甲基蓝分光光度法和碘量法,前者一般适用于低含量S2-的分析(0.4 mL以下),后者一般适用于高含量S2-的分析(0.4 mL以上)[1-2]。通过参考水中硫化物测定的国标方法[1],测定原理是将酸化为H2S后用锌溶液吸收,再用亚甲基蓝分光光度法显色测定[3],但这种方法不太稳定,所需设备较多,仪器昂贵。本文是采用碘量法测定硫酸锰溶液中的S2-,操作简单。
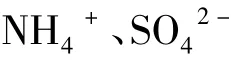
1 实验部分
1.1 实验原理
国标中采用亚甲基蓝吸光光度法测定水溶液中S2-含量的原理是先用在吸收仪内酸化水质,使产生的H2S放出后变成ZnS沉淀,再用对氨基二甲基苯胺和硫酸铁铵形成亚甲基蓝后用分光光度计在665 nm处检测[6]。
经过多次实验验证这种方法适合测定少量的S2-,对于硫酸锰溶液中相对量大的S2-,结果不准确。经过多次实验,采用碘量法[7-8]测定,原理是S2-和过量的单质I2发生反应,生成S单质,溶液中过量的I2用Na2S2O3滴定,使其全部变为I-,化学方程式如下:
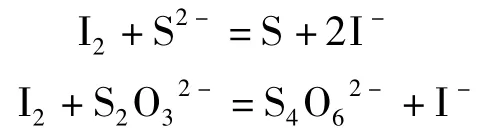
通过比较部分学者的实验装置[9-10],改进测定硫化物的国标方法中规定的酸化吸收仪,使溶液酸化逸出后的H2S能够被吸收液完全吸收,使测定过程中的硫损失降至最低。
1.2 主要试剂与仪器
试剂:I2单质,乙酸锌,乙酸钠,2%NaOH溶液,(NH4)2SO4、Na2S2O3溶液(K2Cr2O7标定),磷酸(分析纯),乙二胺四乙酸,硫化钠,抗坏血酸,Fe(NH4)(SO4)2·12H2O,高纯氮(纯度≥99.99%)。
仪器和设备:720分光光度计,250 mL碘量瓶,50 mL棕色滴定管,水质硫化物酸化吸收仪。
1.3 实验步骤
1)配制250 mL硫酸锰溶液,调整pH至6.5;往硫酸锰溶液中分别加入 0.25,0.5,0.8,1.0,2.0 mL的(NH4)2S,混匀后过滤。
2)碘量法测定:取1 mL硫酸锰液,加入1 mL碘液,滴加1滴醋酸溶液(1+1),用Na2S2O3溶液滴定,同时做空白实验。
3)亚甲基蓝法测定:a配制不同浓度硫化钠溶液,加入N,N-二甲基对苯二胺溶液和硫酸铁铵测定吸光度,绘制标准曲线。b连接吸收装置,通气、检查各部位是否漏气,完毕后关闭气源。c向吸收瓶中加入乙酸锌—乙酸钠溶液,同时将含S2-硫酸锰溶液稀释500倍,加入5 mL抗坏血酸,倒入反应瓶,装好导气管和分液漏斗。开启气源,以200 mL/h吹2 min,关闭气源;取出顶部接管,加10 mL磷酸;接通氮气,以300 mL/h吹1 h。d取下吸收显色管,关闭氮气,加水至60 mL,加入10 mL的N,N-二甲基对苯二胺溶液,塞紧混合1次再加入1 mL硫酸铁铵溶液,混合后放10 min在665 nm测定吸光度。
1.4 测定公式
碘量法:
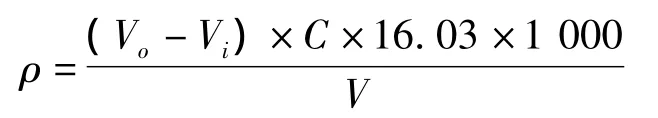
式中 ρ——样品溶液中含有的S2-浓度,mg/L;
V0——空白实验硫代硫酸钠标准溶液用量,mL;
Vi——滴定水样消耗硫代硫酸钠标准溶液用量,mL;
V——水样体积,mL;
C——硫代硫酸钠标准溶液物质的量浓度,mol/mL。
分光光度法:
500×m/V
式中 m——标准曲线上硫化物含量,mg;
V——样品取样体积,mL。
2 实验结果与讨论
在室温下,按1.3的步骤进行实验,实验条件:VMnSO4=250 mL,[I2]=0.019 9 mol/L,[Na2S2O3]=0.049 8 mol/L,[(NH4)2S]=1.992 3 mol/L。表1~2所示分别为pH=6.7时硫酸锰溶液中碘量法和亚甲基蓝分光光度法测定的S2-结果,计算了平行实验的平均值。对比发现碘量法和分光光度法测得的数据相差不大,碘量法测定的结果较为准确。
由表1可以看出,电解金属锰溶液中S2-浓度在100 mg/L以下,实际生产中硫化剂加入量在3 kg左右,折成 S2-在0.5 mol/mL以下。由表2看出,亚甲基蓝分光光度法测定的数值较小,其原因可能是吸收过程不够长,从水质硫化物酸化吸收仪图看,吸收管长度在20 cm以下,H2S利用浮力上行出液面,气泡内可能有部分未能与锌溶液反应,所以,本实验用量筒自制吸收管,如图1所示。
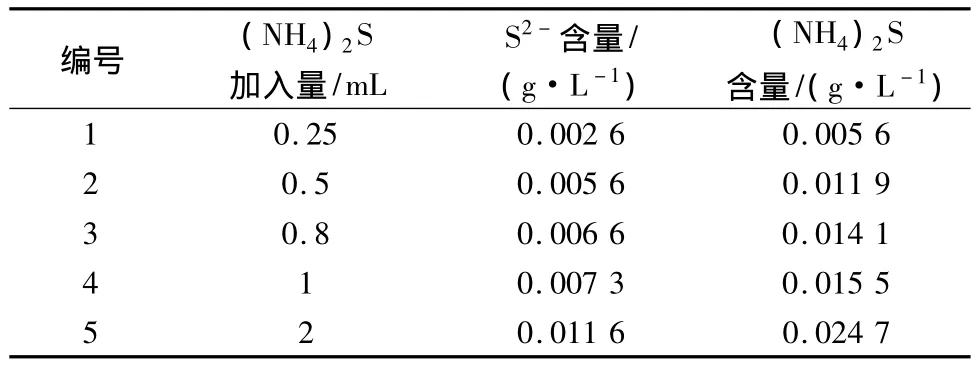
表1 调pH=6.7硫酸锰溶液中碘量法测定的S2-数据
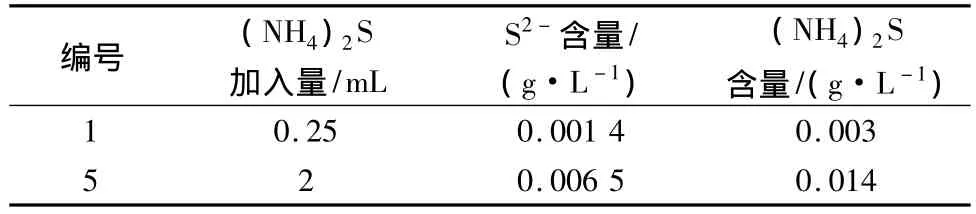
表2 调pH=6.7硫酸锰溶液中分光光度法测定的S2-数据
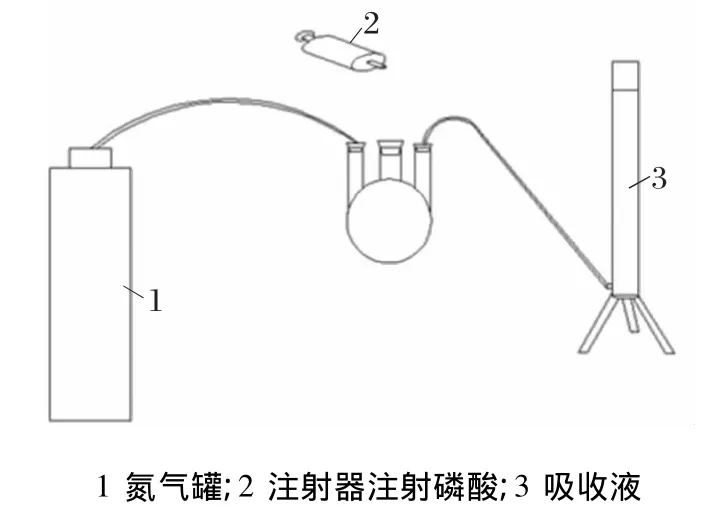
图1 自制酸化吸收仪
本装置中的吸收管长度达500 mm,在电解金属锰溶液中加入2 mL硫化铵的溶液,混匀并过滤,取5 mL滤液,在滤液中滴入2滴稀释10倍的乙酸溶液,使溶液呈酸性,马上加入1 mL的I2溶液,用硫代硫酸钠滴定,测定结果见表3。
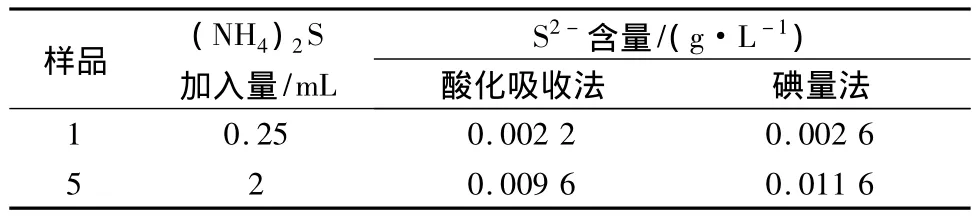
表3 调pH=6.7自制吸收仪测定硫酸锰溶液S2-结果
最高测得S2-在0.000 3 mol/L左右,是碘量法测得值的83%,由此得出,酸化溶液过程中,H2S释放不完全,实验中发现吸收1 h后的硫酸锰溶液,仍然有浓烈的H2S刺激气味,所以,H2S在溶液中有部分残留,酸化法测定值偏低,酸化开始后,载气速度应小,以免H2S与吸收液反应不完全。
在硫化剂除重金属的过程中pH是关键参数,表4是未调整pH的硫酸锰溶液中加入不同硫化铵后S2-的浓度。
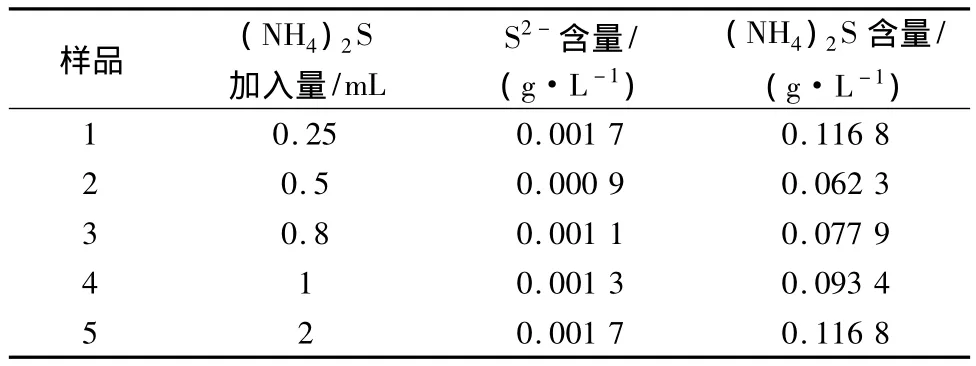
表4 未调pH的硫酸锰溶液S2-碘量法测定数据
图2是调整pH和不调整pH的S2-含量对比图。

图2 硫化铵用量对电解金属锰溶液中硫离子浓度的影响
从图2中可以看到,硫酸锰溶液调整pH后的S2-含量要大于未调整pH的溶液,原因是配制的电解金属锰溶液pH在3.4左右,根据理论,pH低,S2-含量低。
3 结语
根据碘量法和亚甲基蓝分光光度法测定S2-结果的对比,碘量法测定的数据要准确于亚甲基蓝分光光度法,亚甲基蓝分光光度法主要是准备时间较长,H2S在溶液中释放不完全,其中吸收硫化物的仪器是用于测定废水中硫化物含量的,硫酸锰中S2-含量相对较高,需要稀释倍数大,并且需要氮气吹不少时间,所以本文认为碘量法适合于测定硫酸锰溶液中的S2-含量。
[1]GB/T 16489-1996水质硫化物的测定亚甲基蓝分光光度法[S].
[2]黄建宏.碘量法测定废水中硫化物含量的测定条件初探[J].福建化工,2005(3):26-28.
[3]苏庆平.分光光度法测定水样中的硫离子[J].化学研究与应用,2009,21(7):1076 -1078.
[4]曾仁权,杨新斌.碘量法测定废渣中可溶性S2-含量[J].广西化工,2001,30(1):25 -26.
[5]秦忆.碘量法测定低硫[J].理化检验 -化学分册,2001,37(4):187.
[6]邢书才.紫外分光光度法与亚甲兰分光光度法测定水中硫化物方法的对比及评价[J].干旱环境监测,2009,23(1):57-58.
[7]陶晓红,唐莉,李军.碘量法测定硫化物实验研究[J].油气田环境保护,2006,16(2):37 -38.
[8]桂烈勇.碘量法测定化纤废水中硫化物基体干扰的消除[J].广州环境科学,2004,19(1):59 -60.
[9]王娟.NaOH和乙酸锌—乙酸钠吸收液吸收废水中硫化物测定结果比较[J].新乡学院学报,2010,27(6):41 -42.
[10]张家铭,曾燕,李娟.碘量法测定硫化钠含量之改进[J].纸和造纸,1993(1):60.

