β-葡萄糖苷酶水解对辽东楤木嫩芽皂苷理化性质的影响*
颜廷才,张旋,斯琴,孟宪军
(沈阳农业大学 食品学院,辽宁沈阳,110161)
辽东楤木(Aralia elata(Miq)Seem)属于五加科楤木属植物,又名龙牙楤木、刺嫩芽、树龙牙等,主要分布在我国东北部,俄罗斯、日本、朝鲜等地。辽东楤木嫩芽营养丰富、口感好,属山野菜中之珍品,号称“天下第一山珍”[1]。辽东楤木嫩芽还含有较高的皂苷、醛类物质、生物碱、挥发油、胆碱、香豆精、鞣质、豆甾醇及β-谷甾醇等药用成分,有消炎、利尿、强心、免疫和防癌等医疗保健作用[2-3]。由于皂苷的药效广泛而且显著,近年来皂苷成为有机化学、天然产物化学、生物医学的研究热点[4]。辽东楤木嫩芽总皂苷的含量大约是人参皂苷含量的3倍,含量虽然高,但活性比人参皂苷小,并且辽东楤木嫩芽皂苷种类繁多,具体是哪一组分活性更高,目前没有研究,这限制了辽东楤木嫩芽皂苷的应用[5]。目前辽东楤木嫩芽皂苷研究方向主要集中在辽东楤木嫩芽新皂苷种类的发现上,而对于辽东楤木嫩芽皂苷活性改进方面未见到相关报道。相关研究表明:β-葡萄糖苷酶等水解人参皂苷得到高抗癌活性的皂苷单体[6],酸催化水解法、乙酞解法、降解水解法、光解法、碱裂解法和酶水解法等[7]也可以提高皂苷活性,这为提高辽东楤木嫩芽皂苷生物活性提供了理论依据与方向。本研究旨在通过β-葡萄糖苷酶水解辽东楤木嫩芽皂苷原料,探索β-葡萄糖苷酶水解后皂苷基本理化性质的变化,并采用红外与紫外检测来证实皂苷分子变化,希望找到提高辽东楤木嫩芽皂苷生物活性的方法,为扩大辽东楤木嫩芽皂苷应用提供一定基础。
1 材料与方法
1.1 材料与试剂
辽东楤木嫩芽皂苷粗品,由本实验室自制;齐墩果酸对照品(批号:110709-200304,供定性分析和含量测定用),中国药品生物制品检定所;层析用硅胶,国药集团化学试剂有限公司;β-葡萄糖苷酶为分析纯,Sigma公司;甲醇为分析醇、乙腈为色谱纯,Sigma公司;娃哈哈饮用纯净水。
1.2 仪器
SBA—100数控计滴自动收集器,青浦沪西仪器厂;玻璃层析柱,华美试验仪器厂;RE—52型旋转蒸发仪,博通仪器厂;HL—2S恒流泵,青浦沪西仪器厂;DEF真空干燥箱,上海精宏试验设备有限公司;KQ-100DB型数控超声波清洗器,昆山市超声仪器有限公司;FT-IR200型傅立叶变换红外光谱仪,THERMO公司;TDL-5000B型离心机,安亭仪器厂;微量进样器(25 μL),安亭微量进样器厂;UNICUV-4802H紫外可见分光光度计,上海分析仪器厂;FA2004电子天平,上海精密科学仪器有限公司。
1.3 方法
1.3.1 硅胶柱分离辽东楤木嫩芽皂苷组分
样品胶制备:称取经过纯化的β-葡萄糖苷酶酶解前后辽东楤木嫩芽皂苷样品各500 mg和4 g过60~100目筛的硅胶,分别放入研钵中研磨,倒入5 mL甲醇搅拌,辽东楤木嫩芽皂苷被硅胶吸附。
湿法装柱:使用前硅胶G于110℃活化1 h。先用一小块脱脂棉堵住柱底,将30 g过200~300目筛的硅胶在甲醇溶剂中充分溶胀后除去气泡,将硅胶的糊状物慢慢陆续不断地倒入层析住中至距柱顶约10 cm,放置过夜,使硅胶沉降,保持展开剂界面高于硅胶界面。沉降完毕把样品胶缓慢的倒入柱上端[8],保持交界面平整。
洗脱:硅胶柱装好后用甲醇洗脱,按时间30 min收集一份分别收集,共收集6份样品,分别经过旋转蒸发、真空干燥得到不同组分的固体粉末,按照时间先后分别命名1~6,酶解后为E1~E6。
1.3.2 高效液相色谱检测定样品中齐墩果酸含量
仪器:美国 Waters1525 Binary HPLC Pump,Waters2487 Dual λ Absorbance Detector,Waters Breeze 色谱工作站;色谱柱:Eclipes XDB-C18(4.6mm×150mm,5 μm)。
进样量:10 μL(样品浓度1 mg/mL);流动相:乙腈∶水(体积比85∶15);流速:1.0 mL/min;检测器波长:215 nm;温度为30℃;数据处理:外标法峰面积定量[9]。
样品预处理:样品各10 mg用1 mL 1 mol/L的H2SO4水解后再用Na2CO3中和蒸干后,分别溶于10 mL甲醇中,进样时用0.45 μm滤膜过滤。
1.3.3 对羟基自由基的清除作用
水杨酸法[10]:按照 Smirnof(1989)的方法,(1)羟自由基的产生:在10 mL刻度具塞试管中加入10 mmol/L水杨酸0.5mL,0.4 mmol/L pH 7.4的磷酸缓冲液 3 mL,3.8 mmol/L Fe(Ⅱ)的 EDTA溶液 0.5 mL,加入4 mmol/L的H2O21 mL启动反应,于25℃恒温水浴中放置90 min。
(2)羟自由基的测定:加6 mol/L HCl结束反应,再加入0.5 g NaCl,滴加去离子水至6 mL刻度处,混匀。加入冷的乙醚4 mL,充分混匀,静置后移取上层乙醚3 mL于10 mL刻度离心管中,将离心管置于40℃恒温水浴中,将乙醚蒸发至干,加入0.15 mL 10%三氯乙酸,0.25 mL 10%钨酸钠,0.25 mL 0.5%NaNO2,放置5 min后,加入0.25 mL 1 mol/L KOH,滴加去离子水至4 mL,混匀,于510 nm处测定其吸光度A0,同时做空白试验。
(3)OH·清除率的测定:在(1)的体系中加入清除剂,按(2)的方法测定吸光度AS,按下式计算:
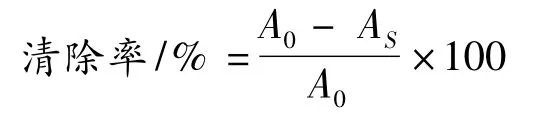
1.3.4 对O2-·自由基的清除作用
邻苯三酚法[11]:取 pH 8.2的 Tris-HCl-EDTA 缓冲液于4.5 mL比色管中,于25℃恒温10 min,再加入25℃恒温的45 mmol/L的邻苯三酚溶液10 μL,混匀后迅速倒入1 cm石英比色杯,于325 nm下每隔30 s测1次光密度值,共测定4 min,求出邻苯三酚自氧化速率ΔA0,同时用盐酸作空白试验。在上述体系中加入邻苯三酚之前加一定体积的皂苷溶液,混匀于325 nm下测其光密度变化ΔAS,计算清除率。
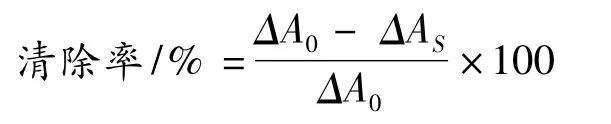
1.3.5 辽东楤木嫩芽皂苷紫外光谱的测定
取经真空干燥的β-葡萄糖苷酶酶解前后辽东楤木嫩芽皂苷各10 mg用甲醇溶解,配制成浓度1 mg/mL的溶液,用UNICUV-4802H紫外可见分光光度计测定其紫外光谱吸收的特点[12]。
1.3.6 辽东楤木嫩芽皂苷红外光谱测定
取经真空干燥的β-葡萄糖苷酶酶解前后辽东楤木嫩芽皂苷各2 mg与干燥KBr100 mg,磨碎混匀后30 MPa下压片,用FT-IR200型傅立叶变换红外光谱仪测定其红外光谱吸收特点[13]。详细图谱检索所用的图谱库为:奥尔德利希凝相样品库、奥尔德利希气相样品库、乔治亚州罪犯实验室样品库、无角聚合体样品库、拉曼有机样品库、Sigma生物样品库[14]。
2 结果与分析
2.1 β-葡萄糖苷酶酶解对辽东楤木嫩芽皂苷感官指标影响
辽东楤木嫩芽皂苷经提纯和干燥以后,形成了红棕色的粉末,在阳光下有明显的反光现象,说明有晶体存在。闻起来有香甜的焦糖味道,在空气中容易吸湿,溶液为红褐色,溶解度较小,易溶解于热水和酸性溶液中,溶液黏稠而有甜味,搅拌容易产生泡沫。经过β-葡萄糖苷酶酶解后辽东楤木嫩芽皂苷,颜色明显变浅,为浅黄色粉末,无明显晶体,反光性能差,无明显吸湿性,溶解速度较快且溶解度较大,溶液黏稠度下降,有清新的清凉味略带甜味,搅拌产生丰富的泡沫。主要感官指标比较如表1。分析原因可能是由于辽东楤木嫩芽皂苷主要是由三萜酸类皂苷元与单糖连接形成皂苷,辽东楤木嫩芽皂苷含有丰富的单糖,在浓度或者温度较高情况下,单糖会有部分聚合[15],所以会有较深的焦糖颜色和风味,糖含量高,溶液黏稠,不容易溶解。经过β-葡萄糖苷酶酶解后辽东楤木嫩芽皂苷的葡萄糖被水解掉,分子明显缩小,颜色变浅,黏性变小,溶解速度提高;由于分子变小,糖组分减少,挥发程度提高,所以刺激气味变强烈,甜味降低。

表1 β-葡萄糖苷酶酶解对辽东楤木嫩芽皂苷主要感官指标影响Table 1 Effect of hydrolyzation of β-glucosidase on main sensory indexs of aralosides
2.2 β-葡萄糖苷酶酶解对辽东楤木嫩芽皂苷组分分离的影响
辽东楤木嫩芽皂苷6个样品组分,干燥后的样品均为棕红色粉末,有特殊的香气味,有反光显现,有晶体出现,遇到冷水变黏稠浆状,溶解比较慢,能够溶于水,水溶液为淡褐色,有刺激性的气味并带有香甜味。6组分的质量比例为:34.3%、21.1%、16.9%、15.1%、7.9%、4.7%。按色谱条件定量测定,6个样品的齐墩果酸含量分别为45.6%、36.1%、31.4%、10.7%、26.6%、25.5%,辽东楤木嫩芽总皂苷里的齐墩果酸含量为33.5%,可见,辽东楤木嫩芽总皂苷与6个组分皂苷内齐墩果酸含量还都是很丰富的[16]。
同样收集经β-葡萄糖苷酶酶解后辽东楤木嫩芽皂苷6个组分,按照时间先后分别命名E1~E6,干燥后的样品也均为有色粉末,E1样品颜色有点暗绿,样品E2、E3颜色为浅黄,后面3个样品为深棕褐色粉末,都有强烈的特殊的香气味,前3个属于清淡味道,后3个样品有香甜味道;都有更大的晶体和大晶体反光显现,比酶解前更容易溶于冷水,水溶液为黏稠浆状,但比酶解前黏度下降,水溶液颜色是更淡的褐色,刺激性的气味比酶解前更强烈并带有微弱香甜味。β-葡萄糖苷酶酶解后E1~E6各组分的质量比例为:34.8%、24%、11.8%、11.3%、8.1%、10%,齐墩果酸含量分别为50.6%、40.1%、34.9%、11.9%、29.5%、28.3%,β-葡萄糖苷酶酶解后辽东楤木嫩芽总皂苷里的齐墩果酸含量为37.2%,含量提高。
2.3 β-葡萄糖苷酶酶解对辽东楤木嫩芽皂苷OH·清除的影响
由图1、2中可知,皂苷溶液在较低浓度时对OH·就有一定的清除作用,浓度为0.25 mg/mL时清除率达到50.65%,随着溶液浓度的增大其清除自由基的能力逐渐增强,皂苷浓度达到1.00 mg/mL对OH·的清除率达到76.75%,而经β-葡萄糖苷酶酶解后皂苷对OH·的清除率明显提高,浓度为1.00 mg/mL时清除率达到82.49%。可见,羟基自由基的清除效果与皂苷的浓度呈显著正相关性,β-葡萄糖苷酶酶解可显著提高皂苷羟基自由基的清除效果[17]。
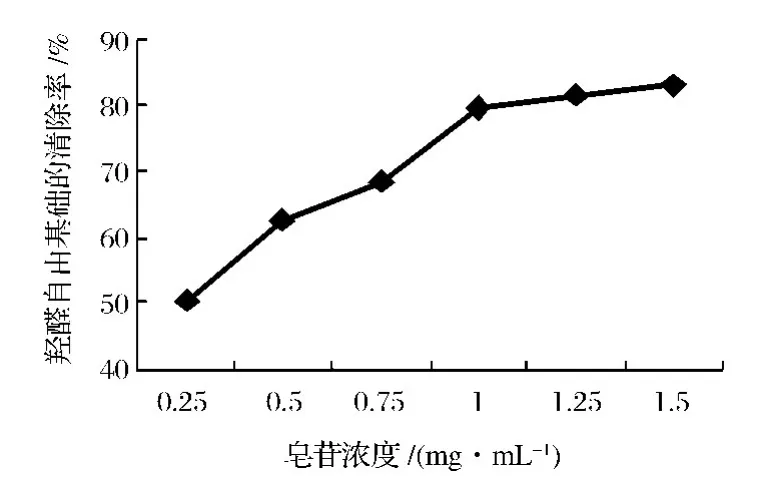
图1 刺嫩芽皂苷对羟基自由基的清除Fig.1 The·OH radical scavenging activity of aralosides

图2 刺嫩芽皂苷对羟基自由基的清除Fig.2 The·OH radical scavenging activity of hydrolyzed aralosides
2.4 β-葡萄糖苷酶酶解对辽东楤木嫩芽皂苷O2-·清除的影响
由图3和图4可知,皂苷溶液在较低浓度时对O2-·就有一定的清除作用,浓度为0.5 mg/mL时的清除率就达到46.35%,随着溶液浓度的增大其清除自由基的能力逐渐增强,皂苷浓度达到1.00 mg/mL的清除率达到79.46%,而经β-葡萄糖苷酶酶解后皂苷对氧自由基的清除率明显提高,浓度为1.00 mg/mL时清除率达到82.26%。可见,氧自由基的清除效果与皂苷的浓度呈显著正相关性[18],β-葡萄糖苷酶酶解可显著提高皂苷氧自由基的清除效果。

图3 刺嫩芽皂苷对O2-·的清除Fig.3 The O2-radical scavenging activity of aralosides

图4 刺嫩芽皂苷对O2-·的清除Fig.4 The O2-radical scavenging activity of hydrolyzed aralosides
2.5 β-葡萄糖苷酶酶解对辽东楤木嫩芽皂苷紫外吸收的影响
由图5可以看到,辽东楤木嫩芽总皂苷的紫外吸收图谱里有6个比较明显的吸收峰,其中在299 nm处的吸收峰最大,吸光值达到0.95,说明辽东楤木嫩芽总皂苷里含有多个皂苷单体,分子比较大[19]。
由图6可以看到,β-葡萄糖苷酶酶解后辽东楤木嫩芽总皂苷的紫外吸收明显向低波长靠近,有5个比较明显的吸收峰,其中在236 nm处的吸收峰最大,说明β-葡萄糖苷酶能够酶解总皂苷,水解下葡萄糖分子,使皂苷单体分子明显变小,单体数量减少。
2.6 β-葡萄糖苷酶酶解对辽东楤木嫩芽皂苷红外吸收的影响
由图7可以看到,辽东楤木嫩芽总皂苷分别在波数为3 373、1 075与2 939、1 388处有明显吸收,经过基础图谱分析可以判断所对应的官能团分别为脂肪族伯醇、脂肪烃[20];经详细图谱检索,此图谱与异麦芽糖的匹配度达到48.27,与β-D-半乳糖的匹配度达到47.10,说明总皂苷含有带羟基的长碳链、异麦芽糖和β-D-半乳糖。
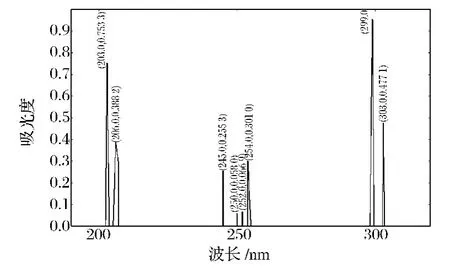
图5 辽东楤木嫩芽总皂苷的紫外扫描图Fig.5 The ultraviolet scan chart of the aralosides
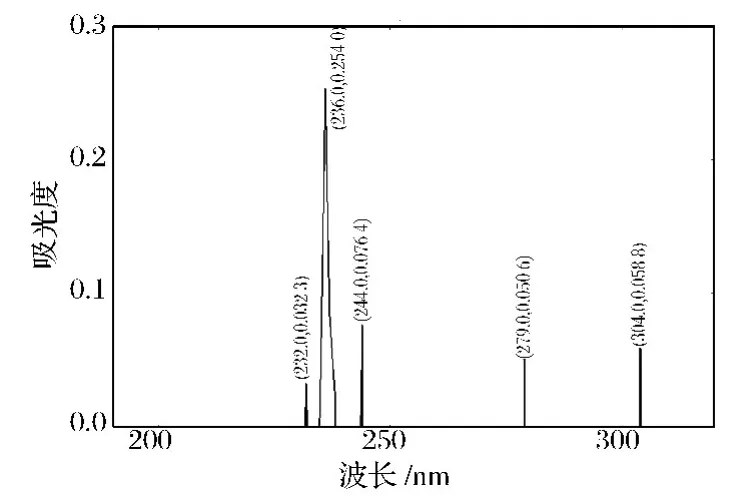
图6 酶解后辽东楤木嫩芽总皂苷的紫外扫描图Fig.6 The ultraviolet scan chart of the hydrolyzed aralosides
由图8可以看到,β-葡萄糖苷酶酶解后辽东楤木嫩芽总皂苷分别在波数为3 300、1 609、750与2 931、1 416及3 397、1 076处有明显吸收,经过基础图谱分析可以判断所对应的官能团分别为脂肪族伯胺、脂肪烃、脂肪族仲醇,脂肪族羧酸,不饱和脂肪酸[21];经详细图谱检索,此图谱与异麦芽糖的匹配度达到53.27,与β-D-半乳糖的匹配度达到53.52,与β-D-苯基葡糖苷的匹配度达到44.89,说明总皂苷含有带羟基或氨基的长碳链、异麦芽糖、β-D-苯基葡糖苷和β-D-半乳糖成分,这证明β-葡萄糖苷酶水解掉部分单糖,裸露出了羧基与长的碳链[22]。
3 结论
经过β-葡萄糖苷酶酶解后辽东楤木嫩芽皂苷分子中的葡萄糖被水解掉,分子明显缩小,颜色变浅,溶解速度明显提高,溶液黏稠度下降,糖组分减少,甜味降低,焦糖风味消失,由于分子变小,挥发程度提高,刺激气味变强烈。
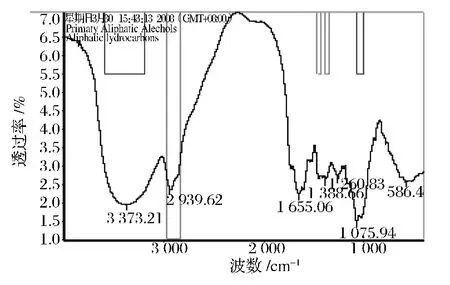
图7 辽东楤木嫩芽总皂苷的红外扫描图Fig.7 The infrared scan chart of the aralosides
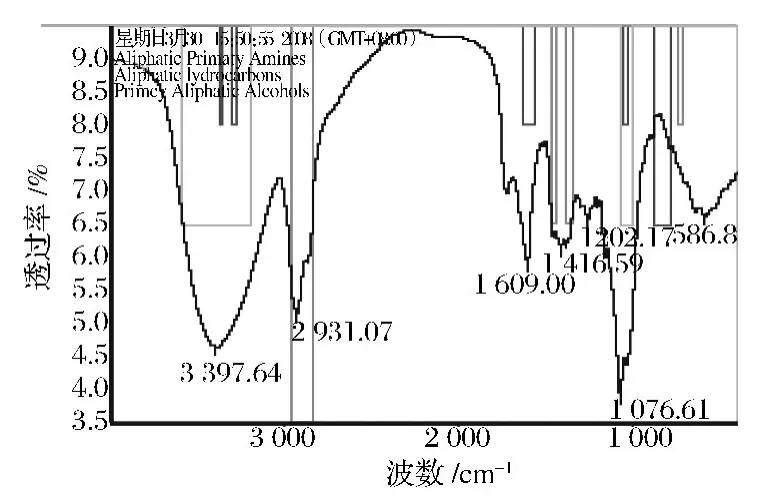
图8 酶解后辽东楤木嫩芽总皂苷的红外扫描图Fig.8 The infrared scan chart of the overall hydrolyzed aralosides
经过硅胶柱分离后的辽东楤木嫩芽皂苷6个样品干燥后的感官特征与总皂苷类似,6组分的质量比例为:34.3%、21.1%、16.9%、15.1%、7.9%、4.7%,齐墩果酸含量分别为 45.6%、36.1%、31.4%、10.7%、26.6%、25.5%,辽东楤木嫩芽总皂苷齐墩果酸含量为33.5%。经β-葡萄糖苷酶酶解后辽东楤木嫩芽皂苷6个样品为有色粉末,E1样品为暗绿色,样品E2、E3为浅黄色,味道清淡,后面3个样品为深棕褐色粉末,味道香甜,都有强烈的特殊香气味;都有更大的晶体和大晶体反光显现,比酶解前更容易溶于冷水,水溶液为黏稠浆状,但黏度下降;质量比例为:34.8%、24%、11.8%、11.3%、8.1%、10%,齐墩果酸含量分别为 50.6%、40.1%、34.9%、11.9%、29.5%、28.3%,酶解后辽东楤木嫩芽总皂苷里的齐墩果酸含量为37.2%。
皂苷溶液在较低浓度时对OH·与O2-·就有一定的清除作用,随着溶液浓度的增大其清除自由基的能力逐渐增强,羟基自由基与氧自由基的清除效果与皂苷的浓度呈显著正相关性,β-葡萄糖苷酶酶解可显著提高皂苷羟基自由基的清除效果。
紫外吸收图谱表明:辽东楤木嫩芽总皂苷经β-葡萄糖苷酶酶解后最大吸收峰从299 nm处降低到236 nm处,紫外吸收明显向低波长靠近,紫外吸收峰减少1个。证明β-葡萄糖苷酶水解掉部分单糖,使皂苷单体分子明显变小,单体数量减少。
红外光谱研究表明:辽东楤木嫩芽总皂苷经β-葡萄糖苷酶酶解后,在3个波数处有了明显吸收,经过基础图谱分析可以判断所对应的官能团分别为脂肪族伯胺、脂肪族羧酸,不饱和脂肪酸;经详细图谱检索,结构多了β-D-半乳糖成分,证明了β-葡萄糖苷酶水解掉部分葡萄糖,裸露出了β-D-半乳糖、羧基与长的碳链。
试验证明,β-葡萄糖苷酶水解掉辽东楤木嫩芽总皂苷分子中部分葡萄糖,改变其物理化学特性,提高其清除自由基能力,这为提高辽东楤木嫩芽总皂苷活性提供参考。
[1] 高萍.大孔树脂在天然药物分离纯化中的应用[J].天津药学,2006,18(2):63-66.
[2] 颜廷才,刘静,孟宪军.超声波提取辽东楤木嫩芽中齐墩果酸类皂甙的工艺研究[J].食品与发酵工业,2008,43(5):170-173.
[3] 匡海学.中国黑龙江产药用植物成分研究[D].日本:明治药科大学,1997:12-36.
[4] 石雪萍,姚惠源.植物皂甙测定方法的进展[J].理化检验(化学分册),2007,43(6):518-524.
[5] 马志强.刺龙芽化学组成及生物活性的研究[D].沈阳:沈阳药科大学,2004:21-45.
[6] 张丹.酶法改变人参皂甙Rg<,3>糖基以获得高抗肿瘤活活物质-人参皂甙Rh<2>的研究[D].大连:大连轻工业学院,2000:5-30.
[7] Masayuki Yoshikawa,Hiroshi Shimoda,Toshiaki Uemura.Alcohol absorption inhibitors from bay leaf(Laurus nobilis):structure-requirements of sesquiterpenes for the activity[J].Bioorganic& Medicinal Chemistry,2000,68(8):2 071-2 077.
[8] 颜廷才,刘静,孟宪军.HPLC法测定辽东楤木嫩芽皂甙中齐墩果酸的含量[J].食品研究与开发,2008,29(2):114-116.
[9] 吴立东,赵凤珍.辽东楤木嫩芽资源的经营利用[J].林业勘查设计,2004,30(2):53-55.
[10] 谭萍,方玉梅,王毅红.苦荞麦多糖的抗氧化作用[J].食品研究与开发,2011,32(4):5-8.
[11] 陈金娥,丰慧君,张海容.红茶、绿茶、乌龙茶活性成分抗氧化性研究[J].食品科学,2009,30(3):62-65.
[12] Joong Hyung Cho,Ji Yun Lee,Sang Soo Sim,et al.Inhibitory effects of diterpene acids from root of Aralia cordata on IgE-mediated asthma in guinea pigs[J].Pulmonary Pharmacology& Therapeutics,2010,58(2):1-10.
[13] Sridhar R A,Ramesh D,Ramchander M.New icetexane diterpenes with intestinal α-glucosidase inhibitory andfreeradical scavenging activity isolated from Premna tomentosa roots[J].Fitoterapia,2012,83(1):88-92.
[14] Min Songa.Determination of oleanolic acid in human plasma and study of its pharmacokinetics in Chinese healthy male volunteers by HPLC tandem mass spectrometry [J].Pharmaceutical and Biomedical Analysis,2006,80(4):190-196.
[15] Anne-Claire Mitaine-Offer,Nicolas Pénez,Tomofumi Miyamoto.Acylated triterpene saponins from the roots of Securidaca longepedunculata[J].Phytochemistry,2010,71(1):91-94.
[16] Ilsley S E,Miller H M,Kamel C.Effects of dietary quillaja saponin and curcumin on the performance and immune status of weaned piglets[J].Journal of Animal Science,2005,83(1):82-88.
[17] Sachiko N Yagi-Chaves,Gang Liu.Effect of five triterpenoid compounds isolated from root bark of Aralia elata on stimulus-induced superoxide generation,yrosyl or serine/threonine phosphorylation and translocation of p47phox,p67phox,and rac to cell membrane in human neutrophils[J].Archives of Biochemistry and Biophysics,2006,446(1):84-90.
[18] Seok-Jong Suh,Un-Ho Jin,Kyung-Woon Kim,et al.Triterpenoid saponin,oleanolic acid 3-O-β-D-glucopyranosyl(1-3)-a-L-rhamnopyranosyl(1-2)-a-L-arabinopyranoside(OA)from Aralia elata inhibits LPS-induced nitric oxide production by down-regulated NF-κB in raw 264.7 cells[J].Archives of Biochemistry and Biophysics,2007,467(2):227-233.
[19] LI Shi-gang,WANG De-gui,TIAN Wei.Characterization and anti-tumor activity of a polysaccharide from Hedysarum polybotrys Hand.-Mazz [J].CarbohydratePolymers,2008,73(2):344-350.
[20] Toshihiko Nakano,Toshiro Fujimoto,Muhammed Gad.Imaging saponin-induced structuralchangesin neural processes with atomic force microscopy[J].Journal of E-lectron Microscopy,2012,51(4):241-246.
[21] Yeon-Suk Lee,Junheon Kim,Sang-Gil Lee.Effects of plant essential oils and components from Oriental sweetgum(Liquidambar orientalis)on growth and morphogenesis of three phytopathogenic fungi[J].Pesticide Biochemistry and Physiology,2009,93(3):138-143.
[22] Yong Pi Hwang.Protective mechanisms of Aralia continentalis extract against tert-butyl hydroperoxide-induced hepatotoxicity[J].Food and Chemical Toxicology,2008,46(11):3 512-3 521.

