海洋细菌发酵液快速预处理工艺*
廖云莉,夏金梅,刘荣丽,许建中,徐洵,许晨
1(厦门大学 生命科学学院,福建厦门,361102)
2(国家海洋局第三海洋研究所,福建 厦门,361005)3(福建中医药大学,福建福州,360122)
海洋微生物生存于高压、缺氧、避光、低温、贫营养的特殊生境,产生的代谢产物具有化学结构多样性和生物活性多样性[1]。我国2008年启动海洋微生物资源的战略性勘探与挖掘,目前,中国海洋微生物菌种保藏管理中心已经收集保藏了10万余株海洋微生物菌种,为新化合物的发现提供了重要资源保障。开发利用海洋微生物资源,重要的途径之一是大批量规模发酵海洋微生物,高通量分离制备其小分子代谢产物以供药物活性筛选,增加发现活性化合物和药物先导化合物的可能性。
微生物发酵液组成非常复杂,通常情况下,发酵液中目标物浓度很低,同时存在大量菌体细胞、培养基及其水解产物、金属离子、生成的蛋白质和多糖等胶状物、色素等,严重干扰海洋微生物小分子代谢产物的获取与制备。因此,需要对发酵液进行适当的预处理以除去绝大多数的干扰物质,从而高效获取目标产物[2-3]。发酵液的预处理方法多种多样,分别适用于不同场合,其中絮凝除杂的方法操作简便易行、能耗低、所用设备及药剂成本低廉、易于与离心分离和膜分离等其它方法耦合使用,是工业上提取某单一目标产物常用的发酵液预处理方法[4]。目前,针对大批量不同的海洋微生物发酵液体系,以获取全组分小分子代谢产物为目的的发酵液的预处理方法尚未见文献报道,建立一种通用的、高效的、快捷的、能预处理大批量大体积海洋微生物发酵液的方法,对高通量分离制备小分子代谢产物具有重要意义。
由于细菌菌体极小,固液分离十分困难,本实验采用絮凝技术使菌体聚集,增大悬浮颗粒体积,以提高过滤速率和滤液质量。配合后续提取分离,以蛋白和多糖的去除率、小分子代谢产物的保留量为指标,筛选和确定了一种絮凝耦合膜超滤处理发酵液的方法,建立了能适用于大多数不同海洋细菌发酵液的快速预处理工艺,为高通量制备海洋微生物小分子代谢产物,构建海洋微生物代谢产物馏分库奠定了基础。
1 材料与方法
1.1 材料与试剂
Al2(SO4)3·18H2O、Fe2(SO4)3、CaCl2、Na2HPO4·12H2O(分析纯),西陇化工股份有限公司;阴离子聚丙烯酰胺(CPAM)、阳离子聚丙烯酰胺(PAM)(分子质量≥300万),北京康普汇维科技有限公司;聚合氯化铝、壳聚糖(化学纯),国药集团化学试剂有限公司;甲醇、乙酸乙酯(分析纯),汕头市达濠精细化学品有限公司;甲醇(色谱纯),美国SPECTRUM CHEMICAL MFG.COPR。
1.2 仪器设备
圆形平板超滤膜(平均孔径30 nm),厦门新世膜环保科技有限公司;UV-9100型紫外-分光光度计,北京北分天普仪器技术有限公司;GL-21M高速冷冻离心机,湖南湘仪离心机仪器有限公司;GQ75高速管式离心机,上海浦东天本离心机械有限公司;旋转蒸发仪RE-52A,上海亚荣生化仪器厂;Waters(Model 510)液相色谱仪,美国Waters公司;电感耦合等离子体质谱仪(icp-ms7500ce),安捷伦公司;JA4103电子天平,上海舜宇恒平科学仪器有限公司。
1.3 实验方法
1.3.1 絮凝实验[5]
取100 mL发酵液于250 mL烧杯中,加入一定量的絮凝剂,快速搅拌30 s后再慢速搅拌2 min,调节pH值至6,静置30 min后取上清液用滤纸过滤并测定前2 min的滤液体积,计算滤速,离心后测定上清液中的蛋白质、多糖含量和透光率,根据分析结果确定合适的絮凝pH值和絮凝剂用量[6]。
1.3.2 蛋白含量测定
采用考马斯亮蓝法[7]。
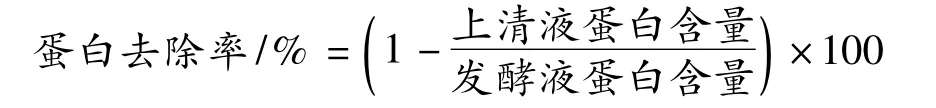
1.3.3 多糖含量测定
采用 DNS 法[8]。

1.3.4 滤速测定[9]
取发酵液絮凝后的上清液,在常压下过0.45 μm中性滤纸,测前2 min的滤液体积,并计算滤速。
1.3.5 透光率测定[9]
取发酵液絮凝并离心后的上清液,以水为空白,在610 nm下测定透光率。
1.3.6 絮凝剂絮凝对小分子代谢产物提取的影响
取3份发酵液,每份100 mL,一份加Al2(SO4)3絮凝,一份加聚合氯化铝絮凝,另一份不做任何处理,均采用离心法进行固液分离(8 000 r/min,10 min)。提取3份上清液中的小分子代谢产物,粗提物干燥后分别溶解定容至10 mL,取 1 mL进行HPLC检测。同时,将离心后固形物用甲醇∶乙酸乙酯(20∶80)混合溶剂200 mL浸泡24 h后超声30 min,离心后取上清液浓缩干燥;将干燥后的样品分别溶解定容至10 mL,取1 mL进行HPLC检测。
1.3.7 铝离子残留量测定
取2份发酵液,每份100 mL,一份用Al2(SO4)3絮凝,另一份不做任何处理,8 000 r/min离心10 min,提取上清液中的小分子代谢产物,将粗提物进行消解[10],消解液定容于25 mL容量瓶中,采用电感耦合等离子体质谱仪(ICP-MS)检测的含量。
2 实验结果
2.1 絮凝剂
2.1.1 不同絮凝剂去除蛋白、多糖的比较
不同絮凝剂去除蛋白和多糖的实验结果见表1。从表中可以看出:Al2(SO4)3、聚合氯化铝、壳聚糖的蛋白去除效率都较高,均达到80%以上,Na2HPO4、CPAM(阳离子聚丙烯酰胺)、PAM(聚丙烯酰胺)、聚合氯化铝对多糖的去除效果较好,均达到83%以上。从透光率和滤速来看,Al2(SO4)3和聚合氯化铝的滤速明显高于其它絮凝剂。综合实验结果,Al2(SO4)3和聚合氯化铝的蛋白、多糖除去率高,滤速快,澄清度好,符合本实验要求。因此,考虑兼顾各种指标,后续实验选择Al2(SO4)3和聚合氯化铝为絮凝剂,进行其他实验比较。
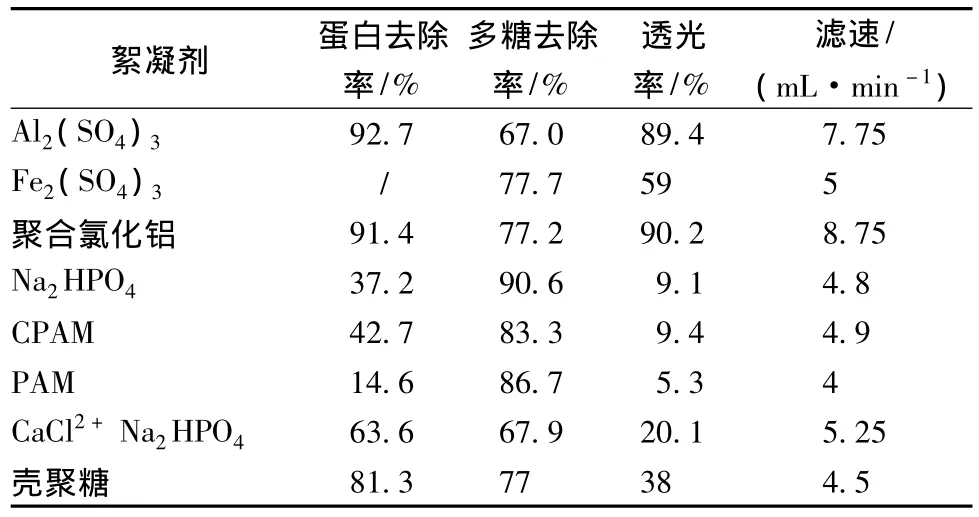
表1 不同絮凝剂的絮凝效果Table 1 The flocculation of the different flocculants
2.1.2 絮凝剂使用对小分子代谢产物提取的影响
按1.3.6的方法分别提取Al2(SO4)3絮凝发酵液、聚合氯化铝絮凝发酵液、未絮凝处理发酵液上清液中的次级小分子代谢产物,获得的指纹图谱见图1,相应的固形物提取的小分子代谢产物指纹图谱见图2。从图1可以看出,Al2(SO4)3絮凝组与未作处理组的色谱峰基本吻合,聚合氯化铝絮凝组的色谱峰在15~25 min和40~45 min与未作处理组的色谱峰吻合度不高;从图2可以看出,Al2(SO4)3絮凝组与未作处理组提取物的色谱峰基本重合,表明Al2(SO4)3絮凝对小分子代谢产物组成与含量基本无不利影响;而聚合氯化铝絮凝组提取物的色谱峰在9~12.5 min段的色谱峰信号明显降低,某些组分提取含量减少,可能聚合氯化铝絮凝剂或絮凝产生的固型物对小分子代谢产物有吸附作用,因此,选择Al2(SO4)3作为发酵液的絮凝剂更适宜。
2.1.3 铝离子在粗提物中残留量的考察
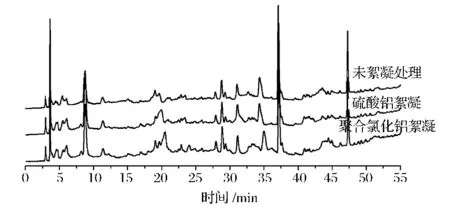
图1 上清液粗提物的色谱图比较Fig.1 Contrasting the chromatograms of the crude extracts from the supermatant
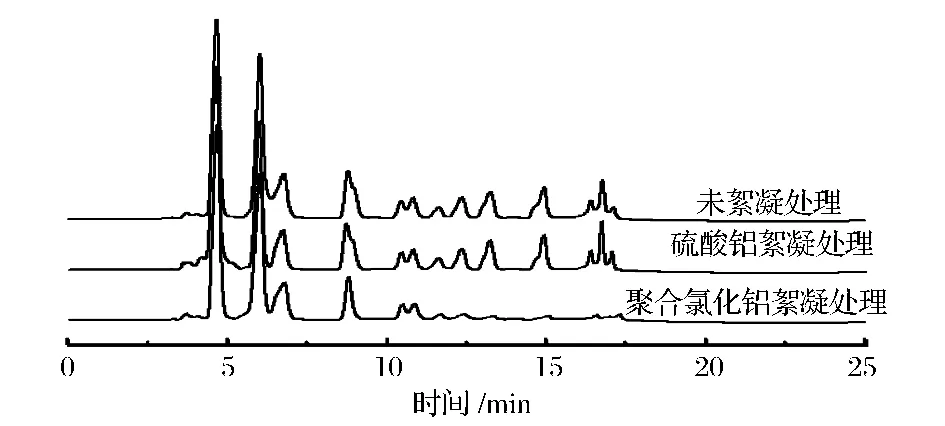
图2 固形物萃取液的色谱比较图Fig.2 Contrasting the chromatograms of the extracts from the solid content
Al2(SO4)3絮凝处理与未絮凝处理的发酵液粗提物中铝离子含量比较结果如表2所示,从表中数据可以看出,采用Al2(SO4)3絮凝发酵液,由上清液提取的小分子代谢产物中金属Al3+含量与未经絮凝的发酵液上清液提取的小分子代谢产物中的金属铝离子含量在同一数量级水平,而且没有明显增加,说明小分子代谢产物粗提物中金属铝离子的贡献并不是来源于Al2(SO4)3絮凝剂。
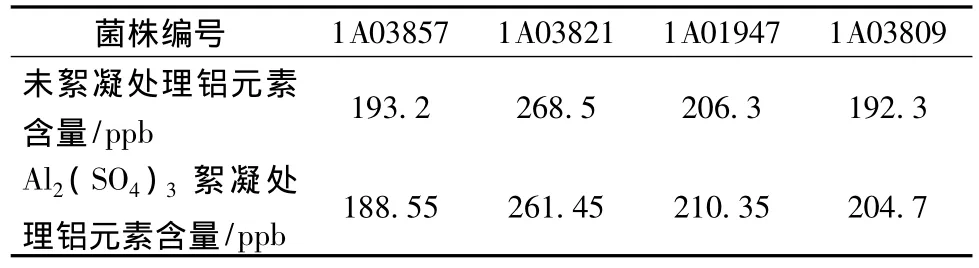
表2 粗提物中的Al3+含量比较Table 2 Contrasting the Al ion content of the crude extracts
2.2 絮凝条件的确定
2.2.1 pH值对絮凝的影响
固定絮凝剂用量、温度等其它操作条件,在4~9之间改变pH值,分别静置30 min后取上清液测过滤速率,8 000 r/min转速下离心5 min后取上清液测定蛋白和多糖含量、610 nm的透光率。不同pH值条件下的实验结果如图3所示(A、B、C、D分别表示pH对蛋白去除率、多糖去除率、透光率、滤速的影响)。从图3-A可以看出,随着pH值的升高,蛋白去除率降低,pH>6时,蛋白去除率急剧下降;从图3-B可看出,pH值变化对多糖去除率影响不大;从图3-C可知,随pH的增大透光率先降低,pH>7后缓慢升高;从图3-D可以看到,pH<6时,随pH升高滤速增加,pH为6~7时,随 pH升高滤速下降,pH为7~8时,随pH升高滤速升高,pH>8时,随pH升高滤速下降,滤速呈波动状态。pH值可影响Al3+的游离状态,Al3+含量高,蛋白质的凝聚能力强,Al(OH)3含量高,吸附絮凝能力强。低pH值时,Al3+含量高,蛋白质凝聚能力强,但Al(OH)3含量低,吸附絮凝能力弱,溶液中的细小颗粒多,因此蛋白去除率高,但滤速低;而随pH值增大,Al3+含量降低,Al(OH)3含量增加,蛋白凝聚能力弱,吸附絮凝能力增强,因此蛋白去除率降低,滤速增加,pH进一步增大时,生成了偏铝酸,Al3+和Al(OH)3的含量均减少,因此蛋白去除率仍下降,同时可溶性蛋白的含量升高会使滤速降低。综合考虑,选择絮凝pH值为6。

图3 pH值对Al2(SO4)3絮凝效果的影响Fig.3 Effect of pH on the floccucation effect of aluminum sulfate
2.2.2 温度对絮凝的影响
固定絮凝剂用量、pH值等其他操作条件,让温度在25~45℃之间变化,静置30 min后,取上清液测过滤速率,8 000 r/min转速下离心5 min后取上清液测定蛋白和多糖含量以及610 nm的透光率。结果如图4所示(A、B、C、D分别表示温度对蛋白去除率、多糖去除率、透光率、滤速的影响)。在25~45℃,随温度升高,蛋白多糖去除率、透光率以及滤速均略有增加,但是影响不明显,因此,在25~45℃可以根据具体情况设定絮凝温度。
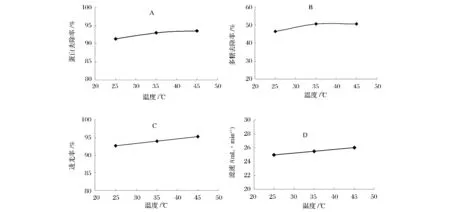
图4 温度对Al2(SO4)3絮凝效果的影响Fig.4 Effect of temperature on the floccucation effect of aluminum sulfate
2.2.3 絮凝剂用量的确定
采用上述实验确定的最适温度和 pH,使 Al2(SO4)3用量在100~300 μg/L之间变化,其他操作条件保持一致,静置30 min后取上清液测定过滤速率,离心后取上清液测定蛋白质和多糖含量、610 nm透光率。以蛋白去除率和透光率均大于(或等于)80%为标准确定Al2(SO4)3的用量,建立发酵液中蛋白含量与Al2(SO4)3用量的关系,结果如表3所示。从表3可以看出,细菌发酵液中蛋白含量与Al2(SO4)3用量存在一定的关联性,即发酵液中蛋白含量较高时为达到一定的蛋白去除率所需要的Al2(SO4)3用量也较高,但蛋白质含量在一定范围内时,Al2(SO4)3用量多,蛋白去除率反而降低。尽管如此,仍可以通过蛋白质的含量大致判断Al2(SO4)3的用量,该结果对细菌发酵液的快速预处理可提供有效的参考。
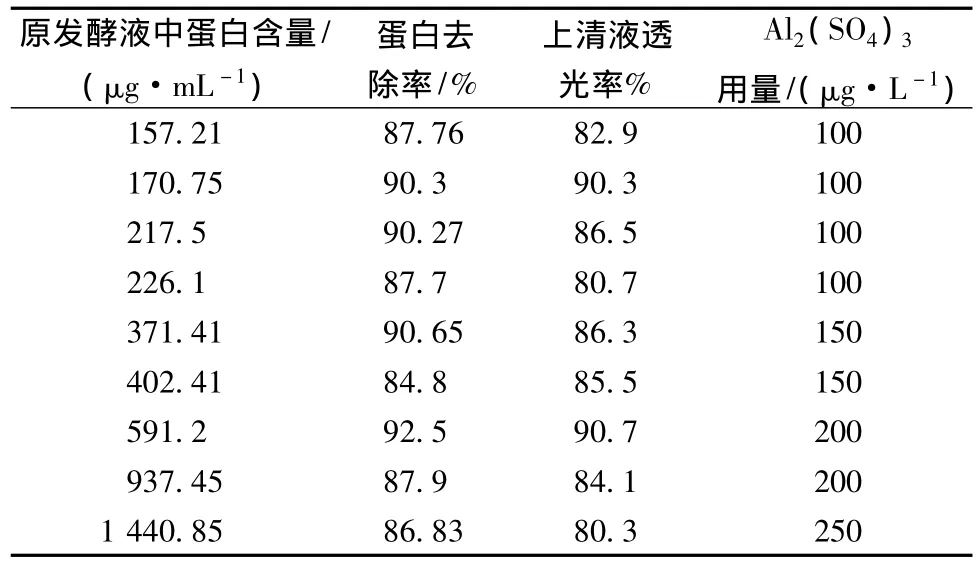
表3 海洋细菌发酵液中蛋白含量与Al2(SO4)3用量的关系Table 3 The relation of the protein content of fermentation borth of marine bacterias and the dosage of aluminum sulfate
2.3 海洋细菌发酵液固液分离方法的探究
2.3.1 不同固液分离方法的比较
采用上述确定的实验条件进行发酵液的絮凝,发酵液静置30 min后,分别采用管式离心机(20 000 r/min,2.5 L/h)、台式离心机(8 000 r/min,离心 5 min)、0.45 μm滤纸(中速)(模拟0.45 μm 的陶瓷膜过滤)、平板超滤膜(平均孔径30 nm)进行固液分离,取上清液测定过滤速率、蛋白和多糖含量、透光率,4种固液分离方式的效果如图5所示(A、B、C、D分别表示对蛋白去除率、多糖去除率、透光率、滤速的影响)。从图A、B可以得知,平板超滤膜的蛋白和多糖去除效果最好,其次是管式离心;从图C可以看出,经过平板超滤膜过滤后的滤液透光率远大于其他3者,台式离心与管式离心的滤液透光率相差不大,0.45 μm滤纸过滤的滤液效果透光率极低;从图D可以看出,采用平板超滤膜过滤的滤液再次过滤纸的速率明显高于其他3种方式,管式离心的滤液过滤纸的速度大于台式离心的滤液过滤纸的滤速。平板超滤膜过滤的综合效果明显优于其他3种固液分离方式,蛋白去除率达到98.7%,多糖去除率达到82.2%,透光率达到98%,而且滤速明显较高。细菌的细胞很小,破碎后碎片更小,采用0.45 μm的滤纸过滤时,由于膜孔较大,小颗粒粒子能进入膜孔,使膜孔被堵,同时可溶性蛋白和多糖大部分可以通过,固液分离效果差;台式离心机适合样品量少的发酵液的处理,且不能连续进料;管式离心机可以连续进料,但较适合固体悬浮颗粒的液体,且进料过程中泵的脉冲会破坏絮团,操作不方便,噪音大;本实验使用的平板超滤膜平均孔径为30nm,对小粒子有很好的截留作用,并能截留一部分可溶性蛋白和多糖,使用几十次后膜通量变化不大,过滤时不会破坏絮团,并且操作简单方便,安全,能耗低,膜清洗也方便,具有很大优势。缺点是膜比较脆弱,不能耐碱,使用pH值不宜超过8。
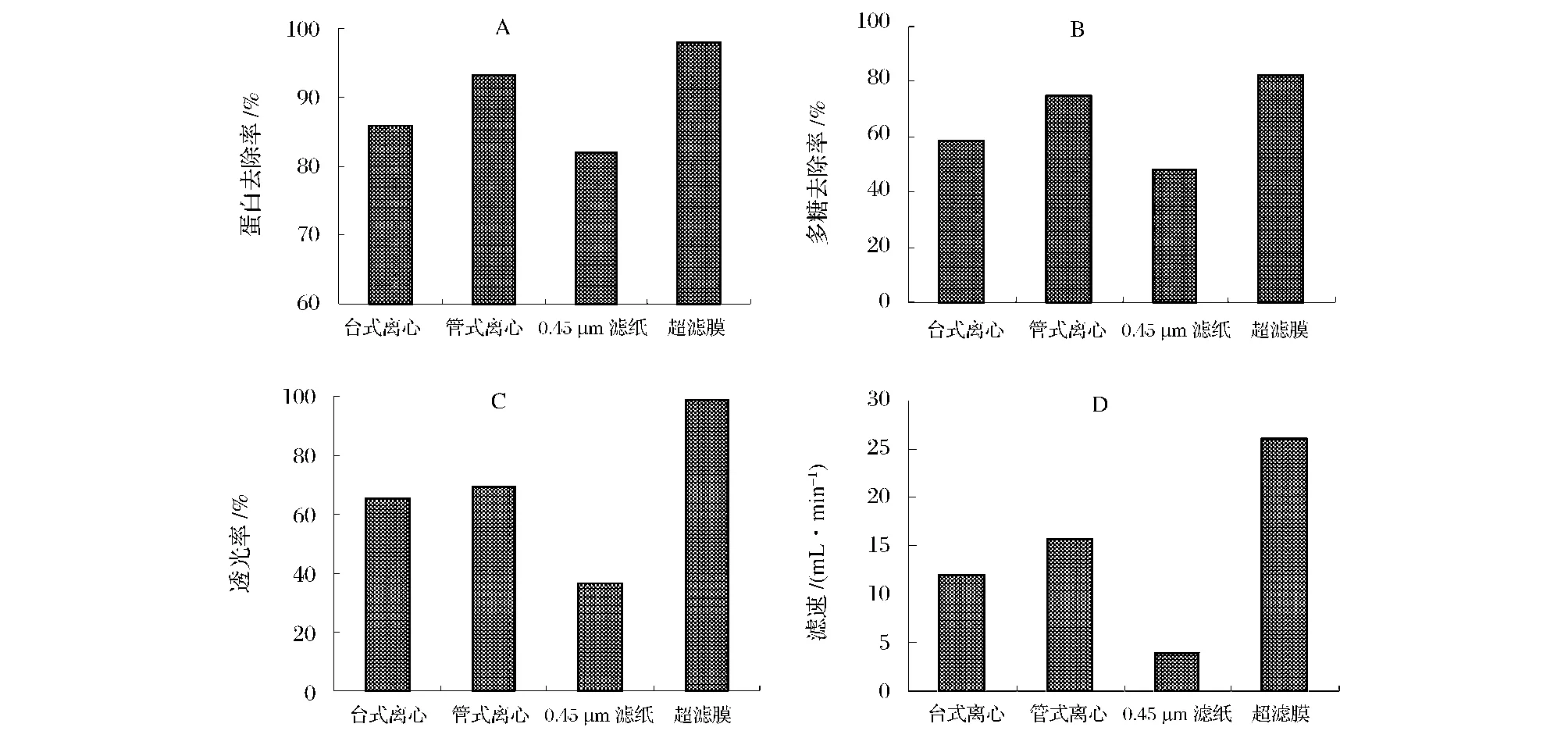
图5 固液分离方式的效果比较Fig.5 Contrasting the effect of the way of solid-liquid separation
2.3.2 絮凝处理对膜超滤的影响
分别取絮凝处理与未絮凝处理的发酵液2.5 L进行膜超滤,每0.5 min读取一次滤液体积,以时间对剩余发酵液百分比作曲线,同时分别测定滤液的各项指标值。絮凝与未絮凝发酵液的过滤速率变化如图6所示,表征絮凝与未絮凝效果的参数结果如表4所示。从图6的速率曲线可得知,剩余85%发酵液时絮凝组与未絮凝组用时均约为1 min,相差不大;剩余60%发酵液时,絮凝组用时2.5 min,而未絮凝组用时4.5 min,絮凝组的滤速比未絮凝组快了1.8倍;剩余40%发酵液时,絮凝组用时5 min,而未絮凝组用时13.5 min,絮凝组的滤速比未絮凝组快了2.7倍。两者的滤速前1 min内相差不大,随后差别越来越大,因为未絮凝组发酵液中的细小菌体及其碎片堵塞了膜孔致使滤速越来越慢,膜通量越来越低,因此进行絮凝预处理后,有效减少了膜的污染,提高了过滤速率。从表4可以看出,经过絮凝后,膜过滤上清液的澄清度、蛋白去除率以及多糖去除率、滤速明显优于未絮凝的膜过滤上清液。
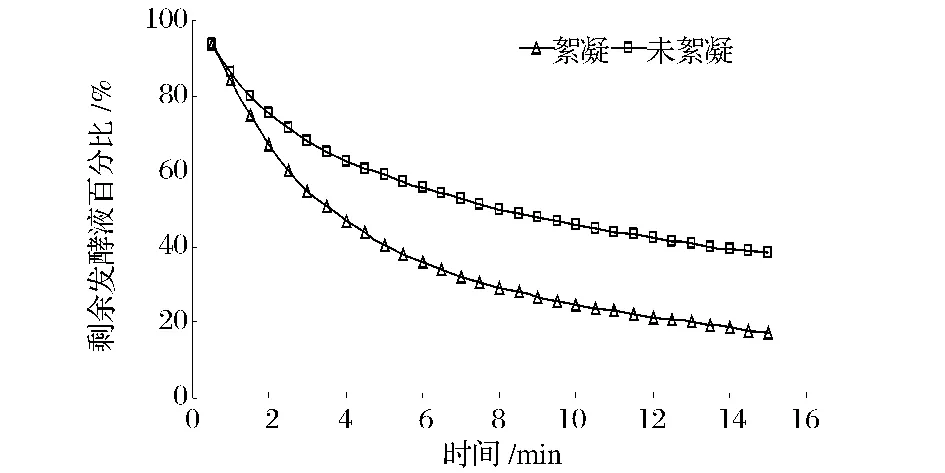
图6 絮凝与未絮凝膜超滤速率变化曲线Fig.6 Comparing with the variation of membrane ultrafitration rate of flocculation treatment and flocculation untreatment

表4 絮凝与未絮凝处理效果比较表Table 4 Effect comparion of locculation treatment and flocculation untreatment
3 结论
本实验以蛋白和多糖去除率、透光率、滤速为指标,结合提取到的次级代谢产物的指纹图谱,筛选出适合海洋细菌发酵液预处理用的Al2(SO4)3絮凝剂并确定了其使用条件。Al2(SO4)3作为发酵液的絮凝剂其最适pH为6,在25~35℃均可适用,对后续目标小分子产物的提取影响不大,未增加提取物中金属铝的残留量,发酵液中蛋白含量在250 μg/mL以下Al2(SO4)3用量约为100 μg/L,蛋白含量在250~400 μg/mL 时 Al2(SO4)3用量约为150 μg/L,蛋白含量在400~950 μg/mL时 Al2(SO4)3用量约为200 μg/L,蛋白含量在950 ~1 440 μg/mL 时 Al2(SO4)3用量约为250 μg/L;与超滤膜法耦合,可高效快速进行固液分离,滤液澄清度好、蛋白和多糖去除率高,并具有广谱性,适用于大部分海洋细菌发酵液的预处理。
[1] Mariadhas V A,Veeramuthu D,Savarimuthu I.Antibacterial and antifungal activities of polyketide metabolite from marine Streptomyces sp.AP-123 and its cytotoxic effect[J].Chemosphere,2013,90(2):479-487.
[2] Belfort G,Davis R H,Zydney A L.The behavior of suspensions and macromolecular solutions in cross-flow microfilm tration[J].Journal of Membrane Science,1994,96(1-2):1-58.
[3] Nobble R D,Stern S A.Membrane Separation Technology-Principles and Applications[M].Amsterdam:Elsevier Science,1995:353-413.
[4] 张一,杜连祥.万古霉素发酵液凝聚与絮凝研究[J].中国抗生素杂志,2007,32(5):291-294.
[5] 沈金玉,熊训浩,刘元帅.絮凝与膜超滤耦合预处理谷氨酰胺发酵液[J].精细化工,2002,19(11):675-677.
[6] 毕喜婧,张建安,刘德华.甘油发酵液的絮凝除菌研究[J].精细化工,2002,19(7):394-397.
[7] 安志强,孙新顺,乔文庆.考马斯亮蓝法测定青霉素发酵液中可溶性蛋白质含量[J].分析与测试,2010,33(9):60-61.
[8] 孙小丁,姜守刚,杨丽新.DNS法测定谷氨酸发酵过程中总糖的研究[J].发酵科技通讯,2009,38(3):22-25.
[9] 赵彦修,张露茜.赤霉素发酵液的絮凝预处理研究[J].微生物学通报,1994,21(1):3-5.
[10] 喻利娟,史玉坤,铬天青S分光光度法测定食品中铝的改进[J].中国公共卫生,2001,17(9):848.

