阿托伐他汀对慢性阻塞性肺疾病合并肺动脉高压患者的临床作用及其机制
马 航,何海艳,邱海艳,陶一江(南通市第一人民医院呼吸科,南通 226001;通讯作者,E-mail:taoyjdr@126.com)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种在全球发病率和病死率日趋增高的疾病,目前COPD居全球死亡原因的第4位,预测至2020年COPD将成为世界第三大死亡原因[1]。肺动脉高压(pulmonary hypertension,PH)是COPD病程发展为肺心病的关键环节,其严重影响COPD患者的生存质量及预后。目前PH的发病机制尚未完全明确,其特点是肺血管阻力和肺动脉压力进行性增加,最终导致右心衰和死亡。近年来一些研究显示[2],他汀类药物可以通过多种途径降低肺动脉高压。本研究探讨了阿托伐他汀对COPD合并PH患者的治疗价值及可能作用机制,以期为他汀类药物治疗PH提供理论依据。
1 材料与方法
1.1 临床资料
选择南通市第一人民医院2011-04~2012-06间呼吸科确诊为单纯性COPD患者40例,COPD合并PH患者45例。40例单纯性COPD患者中男32例,女8例,平均年龄(68.75 ±6.01)岁,其中吸烟者34例,平均吸烟量(29.7±4.2)包/年。45例稳定期COPD合并PH患者中男35例,女10例,平均年龄(69.87±6.87)岁。其中吸烟者37例,平均吸烟量(31.4±3.7)包/年。全部患者诊断符合2007年中华医学会呼吸病学组制定的COPD的相关诊断标准。PH的诊断是根据超声心动图测定肺动脉收缩压(pulmonary arterial systolic pressure,PASP)的水平,PASP>40 mmHg定义为PH。排除标准:近期使用过糖皮质激素或抗生素、合并其他肺部疾病、肝炎、糖尿病、心脏病、高血压病、感染性疾病、自身免疫性疾病、肾脏疾病、神经系统疾病、恶性肿瘤及血液系统疾病者。COPD合并肺动脉高压患者分为常规治疗组及阿托伐他汀治疗组,治疗6个月。所有患者纳入研究前均征求意见,获得同意后签署知情同意书。
1.2 治疗方法
COPD合并PH患者随机分为常规治疗组及阿托伐他汀治疗组。常规治疗组予鼻导管持续低流量吸氧、抗炎、止咳化痰、平喘等常规治疗;阿托伐他汀治疗组除上述治疗外,加用阿托伐他汀治疗20 mg口服,每晚1次,治疗6个月。阿托伐他汀由辉瑞制药有限公司提供(国药准字J20070061)。
1.3 观察指标
1.3.1 肺功能、动脉血气分析、6 min步行距离检查 由有经验的技术员采用美国Sensormedics公司生产的肺功能仪测定第1秒用力呼气容积(forced expiratory volume in one second,FEV1)、用力肺活量(forced vital capacity,FVC)。于呼吸空气条件下在相同时间段抽取桡动脉血,用血气分析仪测定动脉氧分压(PaO2)、动脉二氧化碳分压(PCO2)。6 min分钟步行距离(6-minute walking distance,6MWD)按照6 min步行实验的标准程序进行测定,由各自主管医师负责。
1.3.2 超声心动图测定 采用彩色多普勒超声仪测定三尖瓣最大返流速度(V),根据简化伯努利公式肺动脉收缩压(PASP)=4V2+右心房压。右心房增大时PASP=4V2+10,右心房正常时PASP=4V2+5,PASP>40 mmHg认为存在肺动脉高压。
1.3.3 血清标本的采集与检测 取清晨空腹肘静脉血3 ml,室温静置1 h后2 000 r/min离心15min,吸取血清于Ependoff管中,-70℃冰箱保存待测。采用ELISA法测定血清中IL-6和8-iso-PG浓度,试剂盒为上海船夫生物科技有限公司产品。所有标本严格按照说明书操作。肝肾功能、血脂的血浆标本的采集在同一时间进行,采用全自动生化仪测定。
1.4 统计学分析
2 结果
2.1 一般资料的比较
单纯性COPD患者组40例,平均肺动脉压力(25.2±6.5)mmHg。COPD 合并PH 组45 例,平均肺动脉压力(47.6 ±11.6)mmHg。两组间年龄、性别、吸烟史、肺功能均无统计学差异(P>0.05)。COPD合并PH组PaO2、6MWD低于单纯COPD组,差异有统计学意义(均P<0.05)。伴PH组PCO2高于不伴PH者,但差异无统计学意义(P>0.05,见表1)。
2.2 两组患者血清中8-iso-PG、IL-6水平的比较
COPD合并PH组血清中8-iso-PG与IL-6水平均明显高于单纯性COPD组(P<0.01,见表2)。

表2 两组患者血清中8-iso-PG与IL-6水平的比较(ng/L)Table 2 Com parison of 8-iso-PG and IL-6 in serum between two groups(ng/L)
2.3 COPD合并肺动脉高压组血清中8-iso-PG、IL-6与相关临床指标的相关性分析
COPD合并肺动脉高压组血清中8-iso-PG、IL-6水平与年龄、FEV1、FVC、PaO2、PCO2、6MWD、PASP采用Pearson相关分析,结果显示COPD合并肺动脉高压组血清中 8-iso-PG、IL-6与年龄、FEV1、FVC、PCO2无相关性(P >0.05),与 PaO2、6MWD 呈线性负相关(P<0.05),与肺动脉压成正相关(r=0.494,P <0.01;r=0.346,P <0.05,见表3)。
2.4 COPD合并PH患者中阿托伐他汀治疗组和常规治疗组治疗前后血气、肺功能的比较
两组治疗前的 FEV1、FVC、PaO2、PaCO2比较差异无统计学意义(P>0.05),治疗6个月后,治疗组PaO2比同组治疗前及常规治疗组治疗后均有明显提高,差异有统计学意义;两组PaCO2均有下降,但治疗组与对照组比较差异无统计学意义(P>0.05,见表4)。
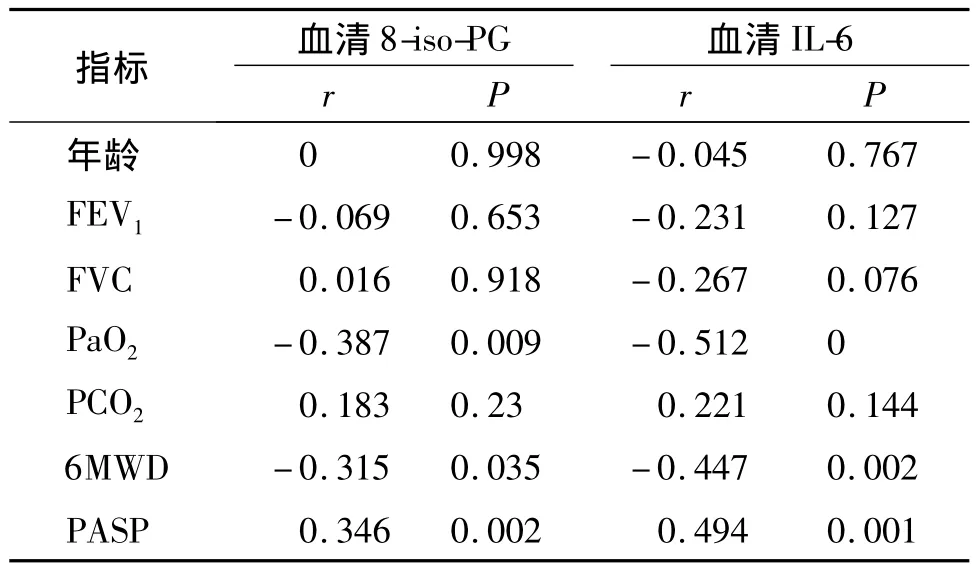
表3 COPD合并PH组中血清8-iso-PG、IL-6与相关临床指标的相关性分析Table 3 Correlation of 8-iso-PG,IL-6 with the related clinical factors in COPD with pulmonary hypertension group
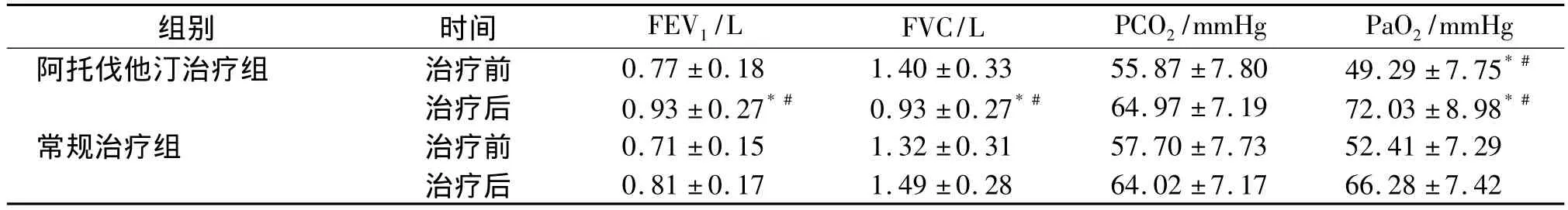
表 4 两组治疗前后 FEV1、FVC、PCO2、PaO2的比较Table 4 Com parison of FEV1,FVC,PCO2 and PaO2 before and after treatment in two groups
2.5 COPD合并PH患者中阿托伐他汀治疗组和常规治疗组治疗前后PASP、6MWD、胆固醇、甘油三酯的比较
两组治疗前PASP、6MWD、胆固醇、甘油三酯比较差异无统计学意义(P>0.05),治疗6个月后,治疗组PASP、胆固醇、甘油三酯比同组治疗前和对照组治疗后均有明显降低,差异有统计学意义(P<0.05)。6MWD比同组治疗前和对照组治疗后均有明显提高(P <0.05,见表5)。
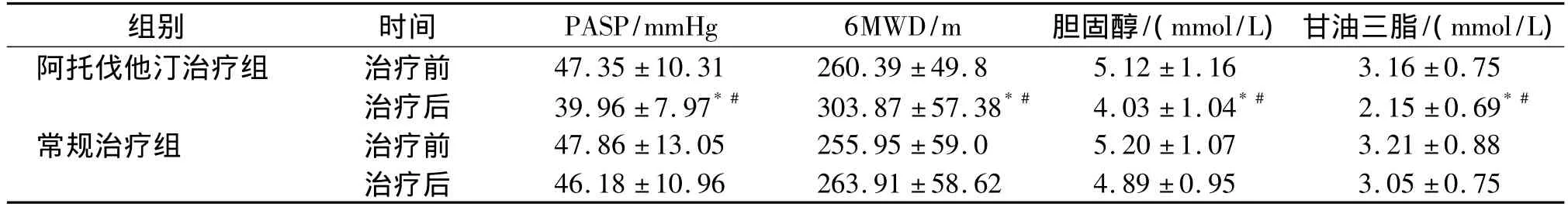
表5 两组治疗前后PASP、6MWD、胆固醇、甘油三脂的比较Table 5 Com parison of PASP,6MWD,cholesterol and triglyceride before and after treatment in two groups
2.6 COPD合并PH患者中阿托伐他汀治疗组和常规治疗组治疗前后血清中IL-6、8-iso-PG的比较
两组治疗前血清中IL-6、8-iso-PG比较差异无统计学意义;治疗6个月后,两组血清中IL-6、8-iso-PG均明显降低,但治疗组较对照组降低更明显,差异有统计学意义(P<0.05,见表6)。
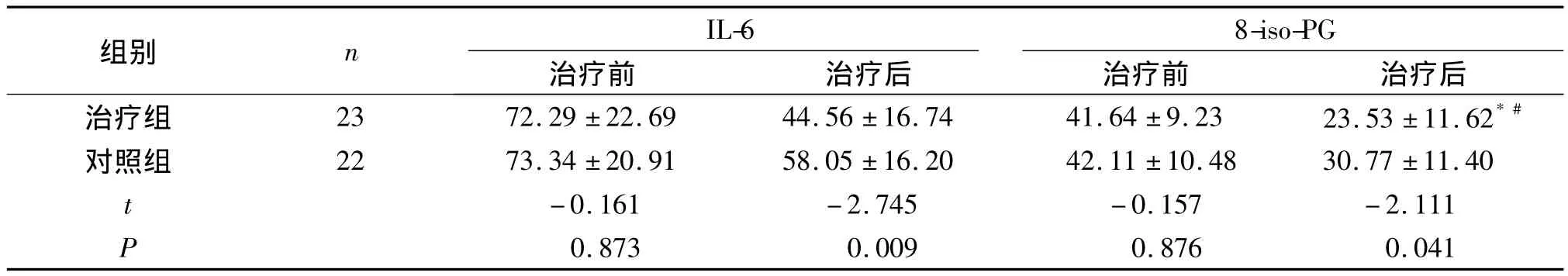
表6 两组治疗前后血清中IL-6、8-iso-PG的比较 (ng/L)Table 6 Com parison of IL-6 and 8-iso-PG before and after treatment in two groups (ng/L)
3 讨论
COPD是一种严重危害人类健康的常见病,肺动脉高压(PH)是病程向肺心病发展的一个关键环节。及时发现和降低PH对于延缓右心衰竭和降低COPD的死亡率有着重要的意义。目前对COPD合并PH的治疗以治疗原发病为主,这些方法不能阻止PH的进展加重,患者的再入院率及死亡率逐年上升,可见目前研究一种新型的慢性阻塞性肺疾病治疗的方法十分迫切。
PH主要特征是肺血管内膜增厚、肺血管网狭窄及肺血管阻力升高,上述病理生理结果可能与低氧、内皮功能失调、氧化与抗氧化失衡及炎症反应相关[3]。以往认为慢性低氧在PH形成过程中起重要作用,但近年来研究还发现未存在缺氧的轻中度COPD患者出现肺动脉结构异常和功能改变的病例。近年来炎症反应及氧化与抗氧化失衡在COPD合并肺高压发病机制中的作用越来越受到重视。COPD的本质是炎症反应,许多相关研究表明,肺泡巨噬细胞在吞噬香烟烟雾中的颗粒物质后能被激活,产生IL-6、IL-8、花生四烯酸代谢产物等趋化介质放大炎症,在COPD伴发的肺动脉高压中起重要作用[4,5]。IL-6 是主要由单核、巨噬细胞分泌的一种多效性细胞因子。研究发现,在硬皮病、SLE、混合性结缔组织病、Castleman病、HIV等疾患并发的肺动脉高压患者中,血清中 IL-6均增高[6]。近年来,有研究报道[7,8],IL-6 可以通过多种途径诱发肺血管平滑肌细胞的增殖和抑制血管平滑肌细胞的凋亡,从而促进肺动脉高压发生。动物实验表明IL-6可导致轻度肺动脉高压,并加重低氧诱导的大鼠肺动脉高压。本实验结果显示COPD合并肺动脉高压组IL-6水平明显高于不合并肺动脉高压组,且与PASP具有正相关性,进一步说明IL-6在COPD伴发的肺动脉高压形成中起着重要作用。其他众多证据表明COPD存在氧化应激增强,氧化-抗氧化失衡。氧化应激能引起脂质过氧化,导致抗蛋白酶失活、黏液分泌增加、气道上皮损伤、气道及小血管内皮重构,在COPD及肺动脉高压形成过程中起重要作用。8-异前列腺素(8-iso-prostaglandin,8-iso-PG)是主要由氧自由基(reactive oxygen species ROS)催化细胞膜脂质的花生四烯酸(arachidonic acid AA)的过氧化而产生一类前列腺素的异构体,被认为是反映机体氧化应激水平的可靠生物指标[9]。动物研究表明缺氧性肺动脉高压小鼠模型中肺动脉肌细胞中8-iao-PG大量聚集,8-iso-PG通过促发缺氧肌细胞释放钙离子[10],诱导肺血管平滑肌细胞(PASMCs)释放 ET-1[11],下调肺血管内皮诱导型NOS蛋白表达[12]等促使肺血管的收缩。本研究结果表明COPD合并肺高压组血清8-异前列腺素较单纯COPD组明显升高,差异具有统计学意义,经Pearson相关分析表明:8-iso-PG与PASP呈正相关性,从而进一步证明氧化应激参与COPD合并肺动脉高压形成过程。
他汀类药物是HMG-CoA还原酶抑制剂,是当前最有效的降低胆固醇药物。近年来研究显示他汀类药物具有改善内皮功能、抑制平滑肌细胞增殖、抑制炎症、氧化反应、抗凝等独立于其调脂以外的作用[13,14]。其在PH中的治疗作用日益受到重视。动物实验表明他汀类药物能增高内皮型一氧化氮合酶mRNA的表达,抗氧化,减少白细胞和内皮细胞黏附,促进血管内皮细胞的生成,提高内皮功能,防止血管重建,从而降低肺动脉压力[15]。Li等[16]研究表明阿托伐他汀可以降低C-反应蛋白诱导的IL-6和单核细胞趋化蛋白-1在肺动脉平滑肌细胞上的分泌。辛伐他汀可减少巨噬细胞过氧化物的形成,从而减少细胞活性氧的产生[17]。本研究表明在经过6个月的阿托伐他汀治疗后,两组血清中IL-6、8-iso-PG均明显降低,但治疗组较对照组降低更明显,差异有统计学意义(P<0.05)。治疗组PASP比同组治疗前和对照组治疗后均有明显降低(P<0.05),表明阿托伐他汀能抑制炎性反应,降低COPD氧化应激水平,改善血管重构,从而降低肺动脉压力。
6 min步行试验主要用于评价中、重度心肺疾病患者对治疗干预的疗效,是患者生存率的预测指标之一,已被广泛应用于评价COPD、肺动脉高压等患者肺功能下降的程度,成为监测各种肺疾病的重要手段[18]。本研究结果表明:应用阿托伐他汀治疗的治疗组PASP较对照组明显下降,而6MWD则明显增高,差异有统计学意义,证实阿托伐他汀可以降低COPD患者的肺动脉压,增加病人的运动耐量。经过阿托伐他汀治疗6个月后COPD合并肺动脉高压组血清中IL-6、8-iso-PG均明显降低,差异有统计学意义(P<0.05),说明阿托伐他汀降低COPD患者的肺动脉压、改善右心功能的机制可能与降低IL-6、8-iso-PG的分泌有关。
目前,他汀类药物已广泛应用于临床,具有高效而安全的特点。本实验中经阿托伐他汀治疗期间未发现有严重的肝肾功能损害及横纹肌溶解等不良反应。他汀类药物有望成为治疗COPD并发肺动脉高压患者的药物。但由于样本量偏小,对此还需进一步进行临床验证。
[1]Lopez AD,Shibuya K,Rao C,et al.Chronic obstructive pulmonary disease:Current burden and future projections[J].Eur Respir,2006,27(2):397-412.
[2]Young RP,Hopkins RJ.Update on the potential role of statins in chronic obstructive pulmonary disease and its co-morbidities[J].Expert Rev Respir Med,2013,7(5):533-544.
[3]Jyothula S,Safdar Z.Update on pulmonary hypertension complicating chronic obstructive pulmonary disease[J].Int J Chron Obstruct Pulmon Dis,2009,4:351-363.
[4]De BoerW I.Cytokines and therapy in COPD[J].Chest,2002,121(5 supp l):S209-218.
[5]DeMaat MP,Kluft C.The association between inflammation markers,coronary artery disease and smoking[J].Vascul Pharmacol,2002,39(3):137-139.
[6]Kishimoto T.IL-6:fromits discovery to clinical applications[J].Int Immunol,2010,22(5):347-352.
[7]Steiner MK,Syrkina OL,Kolliputi N,et al.Interleukin-6 overexpression induces pulmonary hypertension [J].Circ Res,2009,104:236-244.
[8]Furuya Y,Satoh T,Kuwana M,et al.Interleukin-6 as a potential therapeutic target for pulmonary arterial hypertension [J].Int J Rheumatol,2010,2010:720-725.
[9]Dalle-Donne I,Rossi R,Colombo R,et al.Biomarkers of oxidative damage in human disease[J].Clin Chem,2006,52:601-623.
[10]Gong Y,Yi M,Fediuk J,et al.Hypoxic neonatal pulmonary arterial myocytes are sensitized to ROS-generated 8-isoprostane[J].Free Radic Biol Med,2010,48(7):882-894.
[11]Yi SL,Kantores C,Belcastro R,et al.8-isoprostane-induced endothelin-1 production by infant rat pulmonary artery smooth muscle cells is mediated by Rho-kinase[J].Free Free Radic Biol Med,2006,41(6):942-949.
[12]Belik J,Jankov RP,Pan J,et al.Chronic O2 exposure in the newborn rat results in decreased pulmonary arterial nitric oxide release and altered smooth muscle response to isoprostane[J].Appl Physiol,2004,96(2):725-730.
[13]Rhodes CJ,Davidson A,Gibbs JS,et al.Therapeutic targets in pulmonary arterial hypertension[J].Pharmacol Ther,2009,121:69-88.
[14]Ali OF,Growcott EJ,Butrous GS,et al.Pleiotropic effects of statins in distal human pulmonary artery smooth muscle cells[J].Respir Res,2011,14:137.
[15]Morimoto K,Janssen WJ,Fessler MB,et al.Lovastatin enhances clearance of apoptotic cells with implication for chronic obstructive disease[J].J Immunol,2006,176:7657-7665.
[16]Li J,Li JJ,He JG,et al.Atorvastatin decreases C-reactive proteininduced inflammatory response in pulmonary artery smooth muscle cells by inhibiting nuclear factor-kappaB pathway[J].Cardiovasc Ther,2010,28:8-14.
[17]Giroux LM,Davignon J,Naruszewicz M.Simvastatin inhibits the oxidation of low-density lipoproteins by activated human monocytederived macrophages[J].Biochim Biophys Acta,1993,1165:335-338.
[18]Fritz JS,Blair C,Oudiz RJ,et al.Baseline and follow-up 6-min walk distance and brain natriuretic peptidepredict 2-year mortality in pulmonaryarterial hypertension[J].Chest,2013,143:315-323.

