拟青霉FLH30胞内β-葡萄糖苷酶特性研究
华承伟,于江傲,李 兰,常景玲,张志宏
(河南科技学院生科院,河南新乡453003)
β-葡萄糖苷酶能够将纤维二糖水解成葡萄糖,从而解除纤维素在酶解过程中产生的纤维二糖对纤维素酶的抑制作用[1],所以,在纤维素的水解中起着非常重要的作用。β-葡萄糖苷酶也是一类具有重要生理功能的水解酶,能催化氧亲合糖基转移的水解酶,在一些条件下可催化芳基、氨基、或烷基-β-D-糖苷以及生青糖苷、短链低聚糖和二糖中的糖苷键,此外,在特定的条件下会发生水解的逆反应,生成一些新的糖苷[2]。β-葡萄糖苷酶在食品中不仅可以用于改良果汁风味、果酒增香、茶叶增香、生产大豆异黄酮活性苷元、去除苦涩物质[3-4],而且,可用于酵母提取物的生产和海藻生物转化生产可发酵葡萄糖,利用其转移活性应用于低聚糖和糖缀合物合成等。此外,在日用化工业、医药行业中也有广泛的用途[5]。
β-葡萄糖苷酶按存在的部位,可分为胞内和胞外2种,根据氨基酸序列相似性,β-葡萄糖苷酶分别隶属于糖苷水解酶家族1和3[6-7]。家族1中的β-葡萄糖苷酶来自于细菌、植物和哺乳动物,家族3中的β-葡萄糖苷酶主要来自于真菌、细菌和植物。几乎所有的β-葡萄糖苷酶对底物的糖基部分结构的专一性较差,能裂解 C-O、C-S、C-N、C-F等键,有些对糖基部分的C4和C2构形也不专一,能同时水解β-葡萄糖苷键和β-半乳糖苷键,甚至对C6位的专一性也不高,能够水解木糖苷[8]。本实验对分离得到的耐热真菌拟青霉FLH30进行细胞破碎,并经凝胶层析和离子交换得到的电泳级β-葡萄糖苷酶纯酶进行性质探索,为该酶的基因克隆及利用提供借鉴作用。
1 材料与方法
1.1 材料与仪器
菌株 Paecilomyces sp.FLH30,河南科技学院分离工程实验室保存。
发酵培养基(g/L) 酵母提取物10,蛋白胨10,葡萄糖 20,KH2PO41.0,MgSO4·7H2O 0.3,CaCl20.4,FeSO4·7H2O 0.1,pH,自然;酵母提取物、蛋白胨Oxoid公司(英国);大麦葡聚糖、地衣多糖、昆布多糖、木聚糖、pNP-β-D-葡萄糖苷、pNP-α-D-葡萄糖苷、pNP-β-D-半乳糖苷、ONP-β-D-半乳糖苷、纤维二糖、龙胆二糖和乳糖 Sigma公司(美国);纤维寡糖(G3~G4) 自制;丙烯酰胺、甘氨酸、Tris Biomol公司(美国);Sephacryl-S-100HR Pharmacia公司(美国);DEAE52 Whatman公司(英国);低分子量蛋白质标准 TaKaRa公司(日本);葡萄糖氧化酶试剂盒 北京北化康泰化学试剂有限公司;其它试剂均为分析纯。
超声波超微细胞破碎仪 浙江宁波新芝生物科技股份有限公司;TU-1800PC紫外可见分光光度计北京普析通用仪器设备有限责任公司;Power Pac BasicTM型电泳仪 BIO-RAD公司(美国);GL-20B高速冷冻离心机 上海安亭科学仪器厂;Kieselgel 60层析板 Merck公司(德国);核酸蛋白层析系统上海沪西仪器厂。
1.2 实验方法
1.2.1 粗酶液制备 取摇瓶发酵培养5d的培养物,3000r/min离心 10min,去除上清,菌丝体用适量50mmol/L pH6.0的磷酸缓冲液重悬,冰浴条件下超声(300W),工作 3s,停 5s,循环 100 次,破碎液经10000r/min 4℃冷冻离心 10min,取上清,即为粗酶液。
1.2.2 酶的纯化及分子量检测 粗酶液经Sephacryl-S-100 HR凝胶层析(1×100cm,流速1mL/min),收集有酶活性的部分,经超滤浓缩后,再用50mmol/L pH6.0的 NaH2PO4-Na2HPO4缓冲液透析过夜,经DEAE52离子交换(1×10cm,上样及平衡缓冲液同透析缓冲液,含有100mmol/L NaCl的缓冲液洗涤3~5个柱体积,100~500mmol/L NaCl的缓冲液梯度洗脱,流速 3mL/min),1mL/管,分步收集后,SDSPAGE电泳[9]分别检测酶蛋白纯度(分离胶和浓缩胶分别为5%和12.5%),收集有酶活且纯度较高的部分,经超滤浓缩和4℃冷冻离心后,取上清4℃保存,作为实验用酶材料。
Sephacryl-S-100HR凝胶过滤法测定分子量以磷酸化酶B(97.4ku)、牛血清蛋白(66.2ku)、兔肌动蛋白(43.0ku)、牛乳酪蛋白(25.0ku)和细胞色素C(12.4ku)作为标准蛋白。按公式Ve=-b'lgMw+c',通过lgMw对Ve做图,从曲线上求出分子量。
1.2.3 蛋白含量测定 参照Lowry等的方法[10],以牛血清白蛋白作为标准蛋白。
1.2.4 酶活测定 于试管中加入75μL用蒸馏水配制的 15mmol/LpNPG底物,然后加入 150μL 75mmol/L,pH6.0磷酸柠檬酸缓冲液,混匀,使底物终浓度为5mmol/L,缓冲液浓度为50mmol/L,50℃预热3min,然后加入25μL适当稀释的酶液,反应10min后,加入750μL饱和四硼酸钠溶液终止反应,冷却后测定A405,以pNP作标准计算酶活力。酶活力的单位定义为:在上述条件下,每分钟生成1μmol pNP所需要的酶量。
1.2.5 最适反应pH和pH稳定性 45℃下,将缓冲液分别换成不同pH及不同体系(Na2HPO4-Citric,2.5 ~ 6.5;NaH2PO4-Na2HPO4,6.0 ~ 8.0;CHES,8.0~11.0;Na2HPO4~NaOH,11.0~12.0;KCl~NaOH,12.0~13.0)的缓冲液加入到底物中,然后按照标准方法测定酶活力,以酶活力最高点作为100%,确定最适pH;用上述不同的pH缓冲液分别稀释纯酶液,将稀释好的酶液置于25℃水浴锅中分别处理30min,迅速将样品置于冰水中冷却30min,然后测定残余酶活力,以未经处理的酶液作为对照,计算残余酶活力的百分比,考查pH稳定性。结果为三次实验数据的平均值。
1.2.6 最适温度和温度稳定性 将重组酶适当稀释于50mmol/L pH6.0的NaH2PO4-Na2HPO4缓冲液中,然后分别在30~70℃不同温度下按照上述方法测定酶活力。温度稳定性测定:将酶液用50mmol/L pH6.0的NaH2PO4-Na2HPO4缓冲液稀释后分别在不同的温度下处理30min,然后置于冰水浴中冷却30min,最后按标准的方法测定残余酶活力,以未经处理的酶液酶活力为100%对照。结果为三次实验数据的平均值。
1.2.7 金属离子及化合物对酶活力的影响 在缓冲液为50mmol/L,pH6.0的NaH2PO4-Na2HPO4缓冲液的酶溶液中分别加入不同的金属离子,使其终浓度为4mmol/L,将酶液在25℃下处理 30min,然后在50℃条件下测定剩余酶活力,以没有添加金属离子的酶液作为对照。结果为三次实验数据的平均值。
1.2.8 底物特异性 分别以pNP-糖苷、二糖、低聚糖和聚糖为反应底物测定酶活力。pNP-糖苷类底物以水解释放出 pNP的速率来计算酶活力,采用50mmol/L,pH6.0 NaH2PO4-Na2HPO4缓冲液配制5mmol/L浓度的底物,然后在50℃下反应10min,最后测定405nm的吸光度值;低聚糖用50mmol/L,pH6.0 NaH2PO4-Na2HPO4缓冲液配制10mg/mL浓度的底物,然后在50℃下反应10min,最后通过检测水解过程中释放出葡萄糖的速率来计算酶活力。葡萄糖的浓度采用葡萄糖氧化酶试剂盒测定;聚糖类底物用50mmol/L,pH6.0 NaH2PO4-Na2HPO4缓冲液配制成1%(w/v)浓度,然后在50℃下反应10min,最后采用DNS法测定水解过程中释放的还原糖量。酶活力单位定义为在上述条件下每分钟反应生成1μmol pNP、葡萄糖或还原糖所需要的酶量。然而,对于低聚糖中的纤维二糖和龙胆二糖,一个酶活力单位为生成2μmol的葡萄糖的量(水解一个糖苷键释放出两个葡萄糖)。所有的实验均经过三次重复。
1.2.9 聚糖和纤维多糖水解TLC分析 以50mmol/L,pH6.0的NaH2PO4-Na2HPO4缓冲液配制10%的纤维多糖和1%的大麦葡聚糖、地衣多糖和昆布多糖,添加10U/mL的重组酶,50℃保温水解,定时取样进行薄层层析(TLC,Kieselgel60)分析,展层系统为正丁醇/乙酸/水系统(2∶1∶1,v/v/v),将水解的样品点样后展开两次,吹干后用硫酸∶甲醇(5∶95,v/v)溶液浸湿,最后在130℃烘箱中烘烤显色。
2 结果与讨论
2.1 糖苷酶纯化及分子量测定
经Sephacryl-S-100HR凝胶层析和DEAE52离子交换,收集纯度较高的部分再经SDS-PAGE检测(上样10μg),达到电泳级纯酶(图1)。
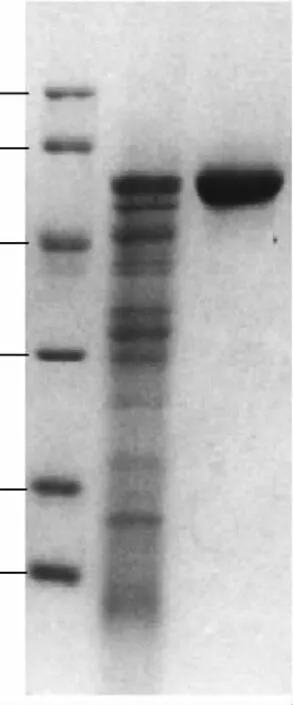
图1 纯化β-葡萄糖苷酶SDS-PAGE电泳检测列Fig.1 Analysis of purified β-glucosidase by SDS-PAGE
微生物胞内β-葡萄糖苷酶一般属于1家族糖苷水解酶,分子量较小,而胞外糖苷酶大多属于3家族糖苷水解酶,分子量较大,且由于β-葡萄糖苷酶的糖基化作用,分子量一般在100~250ku之间[11]。SDS-PAGE电泳结果显示为单一条带蛋白,分子量在44.3~66.4ku之间,为确定在活性状态下该酶的分子量,凝胶过滤法测定了其分子量,根据凝胶过滤标准蛋白分子量曲线(图2),测定活性状态下的β-葡萄糖苷酶分子量为57.2ku,对比SDS-PAGE电泳结果,该酶应为1家族糖苷水解酶且为单亚基蛋白。
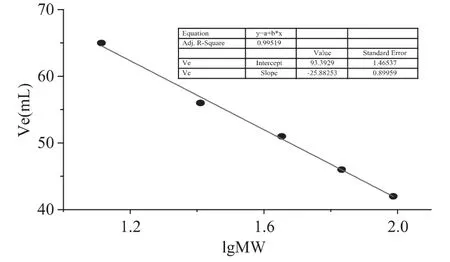
图2 凝胶过滤测β-葡萄糖苷酶标准曲线Fig.2 The curve of gel filtration chromatography of standard protein
2.2 最适反应pH和pH稳定性
该葡萄糖苷酶的最适pH约为6.0,pH对其活性影响较大,pH低于5.0,严重抑制酶活性,在pH4.5时,只有最高酶活的12%,当pH高于6.5时,酶活性也急剧下降(图3a);该酶在pH5.0~12.0(图3b)范围内比较稳定,处理30min后,残余酶活力仍保持在80%以上。
2.3 最适温度和温度稳定性
在不同温度下测得酶活性数据显示该酶最适反应温度60℃左右,超过65℃,酶活性快速下降(图4a);该酶在70℃以下处理30min非常稳定,超过70℃后,酶活性快速丧失,85℃处理30min,只有原酶活性的12.5%。
2.4 金属离子及化合物对酶活力的影响

图3 β-葡萄糖苷酶最适pH(a)和pH稳定性(b)Fig.3 The optimal pH(a)and pH stability(b)of β-glucosidase
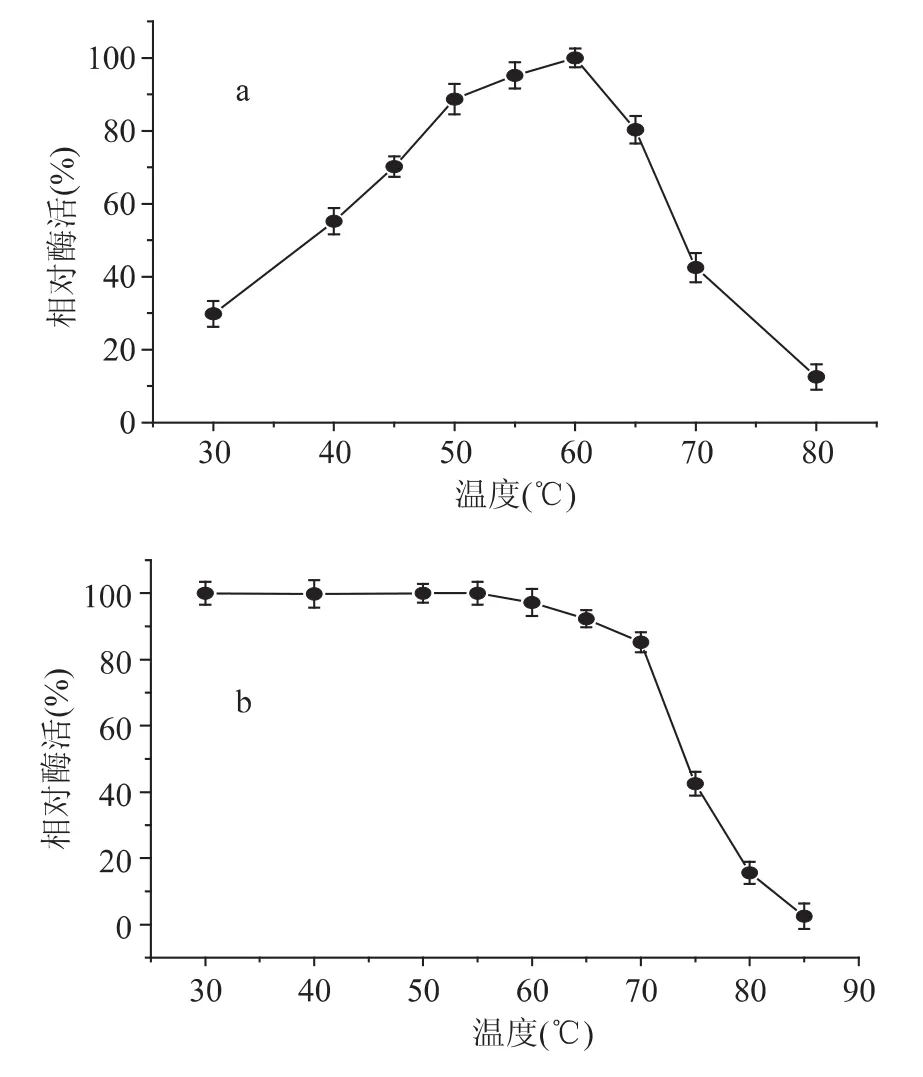
图4 β-葡萄糖苷酶最适温度(a)和温度稳定性(b)Fig.4 The optimal temperature(a)and temperature stability(b)of β-glucosidase
部分金属离子及化合物处理数据显示(表1),Ag+、Hg2+和Fe3+强烈抑制酶活性,Zn2+有较强的抑制作用。其它金属离子对酶活没有显著的影响。其中,EDTA对酶活没有显著影响,表明金属离子不是酶的必需辅助因子,SDS,DTT和β-巯基乙醇对酶活也没有显著影响,说明二硫键不是维持酶正常空间构象的必需作用力。
2.5 底物特异性
该胞内葡萄糖苷酶具有较宽的底物作用范围(表2),对 pNP-(-D-半乳糖苷、ONP-β-D-半乳糖苷和纤维二糖有较高的比活力。此外,对部分聚糖也有水解能力,可以水解地衣多糖、昆布多糖和大麦葡聚糖,但不能水解木聚糖和羧甲基纤维素。该酶作用底物及糖苷键型比较广泛,预示该酶具有较广的用途。

表2 葡萄糖苷酶底物特异性Table 2 Analysis of substrate specificity of β-glucosidase
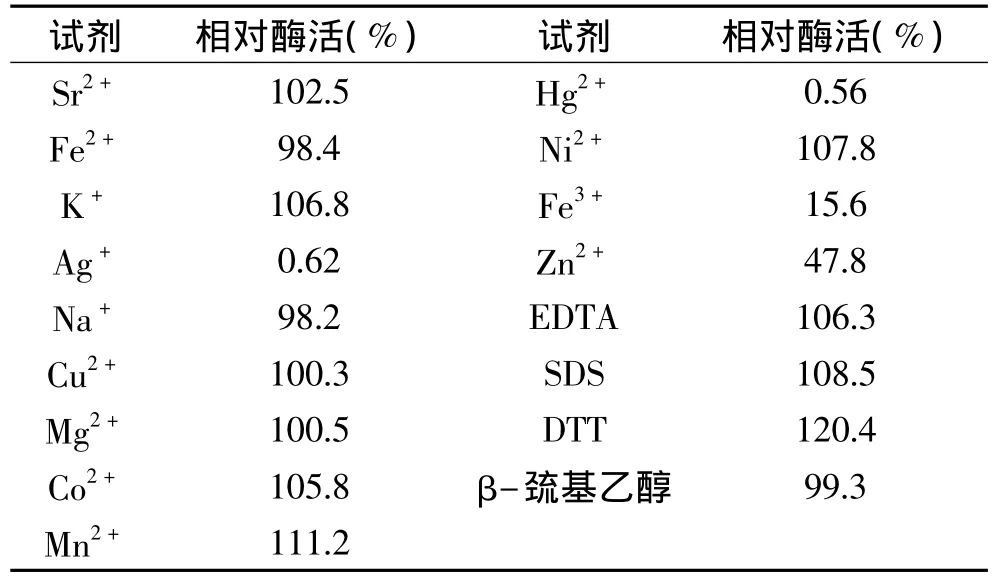
表1 金属离子及其它化合物对β-葡萄糖苷酶的影响Table 1 The metal ions and other chemicals influence on β-glucosidase
2.6 聚糖和纤维多糖水解TLC分析
大麦葡聚糖、昆布多糖、纤维三糖和纤维四糖的水解实验表明,水解大麦葡聚糖、昆布多糖没有见到低聚寡糖的生成,产物主要以单糖为主(图5),可能以外切的方式作用于这些聚糖;此酶可以完全水解纤维三糖和四糖,在4h后基本完全降解为单糖,同时,水解过程中伴随着转糖苷作用,这种转糖苷作用在最初的2h内较为明显,1~2h之间在二糖和三糖之间有一新糖生成,可能为龙胆二糖,但随水解时间增加,逐渐水解为单糖(图6)。
3 结论
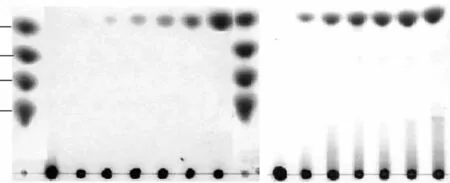
图5 TLC分析β-葡萄糖苷酶水解大麦葡聚糖和昆布多糖Fig.5 Analysis of β-glucosidase hydrolysis of barley glucan and laminarin by TLC

图6 TLC分析β-葡萄糖苷酶水解纤维三糖和四糖Fig.6 Analysis of β-glucosidase hydrolysis of cellotriose and cellotraose by TLC
依据水解底物特异性的不同可将β-葡萄糖苷酶划分成β-葡萄糖苷酶、纤维二糖酶和具有较宽水解特异性,能够水解多种不同底物的β-葡萄糖苷酶三类。本拟青霉FLH30为耐热真菌[12],胞内β-葡萄糖苷酶作用底物广泛,应属于第三类β-葡萄糖苷酶。1家族β-葡萄糖苷酶最适温度一般在40~50℃之间,该β-葡萄糖苷酶最适温度60℃,在此温度下处理30min,酶活损失小于10%,70℃处理30min,酶活损失也小于20%。不同来源β-葡萄糖苷酶pI一般都在酸性范围内(3.5~5.5),并且差别不大,最适pH也多在酸性范围内且最适作用pH范围较窄,本β-葡萄糖苷酶最适pH6.0,在pH4.5以下,酶活性急剧下降,但该酶非常耐碱,在pH12.0处理30min后,残余酶活力仍保持在70%以上,预示该酶在食品、医药、纺织、能源等方面具有较大潜在应用价值。
[1]Hong J,Tamaki H,Kumagai H.Cloning and functional expression of thermostable β-glucosidase gene from Thermoascus aurantiacus[J].Applied Microbiology and Biotechnology,2007,73:1331-1339.
[2]Mohamed G,Issam S.Fungus β-glycosidases:immobilization and use in alkyl β-glycoside synthesis[J].Journal of Molecular Catalysis B:Enzymatic,2004,29:89-94.
[3]JeyaM,JooAR,LeeKM,etal.Characterization of β-glucosidase from a strain of Penicillium purpurogenum KJS506[J].Applied Microbiology and Biotechnology,2010,86:1473-1484.
[4]Zhou C,Qian L,Ma H,et al.Enhancement of amygdalin activated with β-d-glucosidase on HepG2 cells proliferation and apoptosis[J].Carbohydrate Polymers,2012,90:516-523.
[5]潘利华,罗建平.β-葡萄糖苷酶的研究及应用进展[J].食品科学,2006,27(12):803-806.
[6]Henrissat B,Callebaut I,Fabrega S,et al.Conserved catalytic machinery and the prediction of a common fold for several families of glycosyl hydrolases[J].Proceedings of the National Academy of Sciences of the United States of America,1996,93(17):9302.
[7]Ketudat CJR,Esen A.β -Glucosidases[J].Cellular and Molecular Life Sciences,2010,67(20):3389-3405.
[8]Driskill LE,Bauer MW,Kelly RM.Synergistic interactions among beta-laminarinase,beta-1,4-glucanase,and betaglucosidase from the hyperthermophilic archaeon Pyrococcus furiosus during hydrolysis of beta-1,4-,beta-1,3-,and mixedlinked polysaccharides[J].Biotechnol Bioeng,1999,66(1):51-60.
[9]Laemmli UK.Cleavage of structural proteins during assembly of head of bacteriophage-T4[J].Nature,1970,227:680-685.
[10]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the folin phenol reagent[J].Journal of Biological Chemistry,1951,193:265-275.
[11]Nakkharat P,Haltrich D.Purification and characterization of an intracellular enzyme with β -glucosidase and β -galactosidase ac tivity from the thermophilic fungus Talaromyces thermophilus CBS236.58[J].Journal of Biotechnology,2006,123(3):304-313.
[12]华承伟,于江傲,谢凤珍,等.耐热 β-1,3(4)-葡聚糖酶源真菌筛选、鉴定及产酶条件优化[J].食品工业科技,2012,33(13):131-134.

