苹果汁和桃汁种类特异性PCR检测方法的研究
孙建霞,白卫滨 ,曹春廷,张振华,邱瑞霞,吴希阳,欧仕益
(1.广东工业大学轻工化工学院,广东广州510090;2.暨南大学食品科学与工程系,广东广州510632)
DNA分子检测方法是从基因水平鉴别品种的一种手段,采用PCR技术扩增种类特异性基因进行成分鉴定,可以不受时间和环境影响,又能从基因水平直接反映不同种类间差异,是快速可行、高效准确的方法。在PCR技术诞生的20多年里,随着分子生物学研究的不断深入和发展,分子生物学手段为各种水果的遗传研究和育种工作提供了有利工具。研究者在对水果的遗传特性研究基础上,建立了各种水果的基因库,但却很少应用于果汁分子水平种类鉴定。苹果汁主要的掺假现象有三种,即廉价果汁掺假,糖类及水的掺假和调配苹果汁掺假[1]。目前,大多数鉴别掺假果汁的方法均为对各种水果特有的标志性化合物检测。Versari等[2]将苹果汁中酮类物质作为标志性化合物用反相高效液相色谱法进行掺假检测。刘温喜[3]针对苹果汁中的多酚类物质和D,L-苹果酸用超高效液相色谱法鉴别掺假的浓缩苹果汁。胡耀星等[4-5]分别从糖、有机酸、氨基酸、稳定性同位素、类黄酮、阳离子及光谱学等方面采用不同检测方法对苹果汁的掺假进行了检测。同时,Kuchemnko等[6]用电压谐振器对苹果芳香组成的挥发性物质进行掺假检测。Wald B等[7]将存在于用梨汁掺假的苹果汁而不存在于纯苹果汁的异鼠李素葡萄糖苷作为标志性化合物。Muntean[8]首次同时使用碳水化合物色谱和离子色谱分离苹果汁中4种主要的碳水化合物和6种阳离子来检测果汁的掺假。Lukas等[9]根据橘汁中代谢组指纹来检测橘汁中掺假的苹果汁和葡萄柚汁。然而,果汁中所含有的标志化合物是不恒定的,外界环境和加工条件都会影响其含量,因此,用理化方法对果汁进行鉴伪具有局限性。随着无损检测的兴起,也有不少人将红外光谱法应用于果汁掺假检测。Lorenzo等[10-11]用红外光谱法对掺杂各种糖类物质的苹果汁单一建模来检测。而Luis等[12]用红外光谱对苹果汁中的碳水化合物建模来检测糖类物质的掺假。高志明等[13]对苹果汁掺假梨汁用红外光谱法检测。红外光谱法虽然具有快速无损等特点,但是其数据模型制作麻烦且只能针对一种掺假物质检测。分子生物学技术在果汁鉴伪方面的应用不多,Chang等[14]用分子生物学方法鉴定鲜榨和还原橙汁。韩建勋等[15]实时荧光PCR对常见果汁中梨掺假现象检测,但此研究并未涵盖除梨汁以外其他果汁的掺假。

表2 苹果和桃特异性引物Table 2 Specific primers of apple and peach
本研究通过NCBI数据库,筛选苹果和桃特异性基因,进而根据该特异性基因确定特异性扩增引物,使其能在基因水平上反映水果种类的差异,并应用于苹果汁和桃汁的鉴伪研究,该方法不受其他遗传效应和环境条件的影响,具有在苹果和桃深加工产品中区分成分的实际应用价值,具有重要意义。
1 材料与方法
1.1 材料与仪器
苹果和桃 均购于超市,4℃保存,树种与品种见表1;梨、柑橘、番木瓜、樱桃和草莓等 由华南农业大学农业与生物学院馈赠;rTaq酶、dNTPs、PCR缓冲液、溴化乙锭、分子量Marker(100~2000bp) 大连宝生物公司;CTAB、SDS、PVP、β-巯基乙醇、EDTA、Tris饱和苯酚 Sigma公司;其余化学试剂 北京分析仪器厂。

表1 实验材料Table 1 Test material
微量移液器 德国Eppendorf公司;ABI 2720 thermal cycler(Applied Biosystems)PCR扩增仪 美国ABI公司;D640核酸蛋白分析仪 美国Beckman公司;Gel Doc1000凝胶成相系统 美国Bio Rad公司;5804R型低温高速离心机 Ependoff公司。
1.2 实验方法
1.2.1 改良CTAB法提取DNA 果肉DNA的提取。取经液氮磨碎的苹果、桃、梨、柑橘、番木瓜、樱桃和草莓 200mg,各加入 2mL离心管中;加入 1000μL CTAB溶液,振荡均匀,65℃温育40min,1200r/min离心10min,吸取上清;加入等体积酚:三氯甲烷:异戊醇(25∶24∶1),振荡均匀,1200r/min 离心 10min。吸取上清液,加入另一新管中,再加入等体积酚:三氯甲烷:异戊醇(25∶24∶1),振荡均匀,1200r/min 离心10min;吸取上清加入等体积三氯甲烷:异戊醇(24∶1),吸取上清;加入2/3体积的异丙醇,-80℃沉淀20min或-20℃沉淀2h,1200r/min离心10min;弃去上清液,加入70%乙醇溶液洗涤,12000r/min离心2min。弃去上清液,干燥,用50μL TE溶液溶解沉淀;加入2μL RNA酶溶液,37℃温育30min;-20℃保存,备用。苹果汁和桃汁DNA的提取。取鲜榨果汁1mL,分别取1mL 100%各加入10mL离心管;加入4mL CTAB(加3.3%聚乙烯吡咯酮(K30)PVP)溶液,其余步骤与上同。
1.2.2 苹果和桃保守序列的确定 根据NCBI数据库公布的基因序列,查找苹果属和桃属特异性的基因,通过筛选得到苹果属抑制蛋白的mal d 4.02基因(登录号FM887031.1),桃属微卫星标记MA023a(登录号AB077132.1),通过BLAST比较具有品种特异性,同时以植物高度保守的叶绿体AccD基因(登录号EU326013.1)作为内标。
1.2.3 苹果和桃特异性引物的设计与筛选 据NCBI的引物在线设计软件结合BLAST比对,通过PCR扩增验证筛选获得苹果、桃特异性引物如表2所示。为了验证苹果和桃的定性PCR体系的特异性,同时以富士、红星、小国光、肥桃、水蜜桃、寒露桃、鸭梨、雪花梨、黄金梨、蜜桔、红桔、沙糖桔、番木瓜、樱桃、草莓基因组DNA为模板进行扩增。
1.2.4 特异性引物的PCR扩增条件 扩增采用反应体系为 30μL,含 1×PCR 缓冲液(50mmol/L KCl,10mmol/L Tris-HCl,pH8.3,1.5mmol/LMgCl2),0.2mmol/L dNTPmix,0.3μmol/L 引 物 GT1F 和GT1R,2.5 U Taq DNA聚合酶,100ng基因组 DNA。扩增程序为:预变性(5min/94℃);40循环:变性(30sec/94℃),退火(30s/58℃)延伸(30s/72℃);延伸(5min/72℃)。反应结束后取5μL PCR产物于2%的琼脂糖凝胶,1×TAE缓冲液中,稳压90V电泳30min,在紫外凝胶成像系统下检测。
1.2.5 PCR扩增产物测序 苹果和桃PCR扩增特异性产物送上海生工(北京)测序。
1.2.6 特异性引物的PCR扩增灵敏度分析 分别以富士苹果、水蜜桃的DNA为模板,按照100、50、25、10、5、2.5、0ng/μL 的模板添加量,参照 1.2.4 的反应体系和最佳退火温度进行PCR扩增,扩增结果在2%的琼脂糖凝胶中检测。
2 结果与分析
2.1 苹果和桃引物种类特异性的定性检测
根据NCBI数据库筛选设计的特异性的引物,优化PCR条件,建立苹果、桃种类特异性的定性检测体系,同时验证体系的特异性和灵敏度。
结果显示,扩增产物为242bp的ACC内源参照基因在所有扩增模板的体系中均有预期条带出现(图1)。这说明PCR体系没有受到抑制。大小为129bp的扩增条带,仅在以富士、红星、小国光为模板的时候出现;大小为179bp的扩增条带,仅在以肥桃、水蜜桃、寒露桃为模板的时候出现;而以其它非种类特异性水果为模板时,没有出现相应的扩增条带(图2,图3)。

图1 通用内标基因ACC扩增结果Fig.1 Amplification results of the endogenous gene ACC
由图1~图3可知,苹果和桃种特异性的扩增产物生工测序结果与理论序列一致,表明结果的可靠性。
2.2 苹果、桃、梨、柑橘种类特异性的PCR引物灵敏度
为了验证该苹果、桃、梨、柑橘的种类特异性引物的 PCR 灵敏性,分别稀释成 100、50、25、10、5、2.5、0ng/μL的模板DNA,以这些DNA样品为模板进行扩增。结果如图4、图5所示。
结果表明苹果、桃属特异性引物的最低检测限分别为5、10ng/μL。

图2 苹果属特异性引物定性检测结果Fig.2 The qualitative detection results of malues-specific primers

图3 桃属特异性引物定性检测结果Fig.3 The qualitative detection results of amygdalus-specific primers

图4 苹果属特异性引物定性检测的灵敏度Fig.4 The qualitative detection sensitivity of malues-specific primers
通过验证定性检测体系的特异性和灵敏性,说明苹果、桃属特异性引物在分子水平鉴定苹果、桃是可行的。这将为今后这两种水果的深加工产品提供技术支持。
2.3 苹果和桃鲜榨汁的应用检测
通过优化改进的CTAB法提取的鲜榨汁的基因组DNA,进行ACC内标基因、苹果汁和桃汁种类特异性基因的扩增,扩增结果见表3。
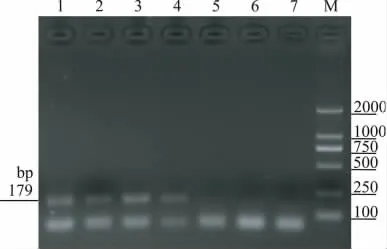
图5 桃属特异性引物定性检测的灵敏度Fig.5 The qualitative detection sensitivity of amygdalus-specific primers
从表3的扩增结果可以看出,7种鲜榨果汁仅仅富士苹果汁和水蜜桃汁的相对应种属特异性阳性扩增。表明此方法可以很好的应用于苹果汁和桃汁的种属特异性检测。
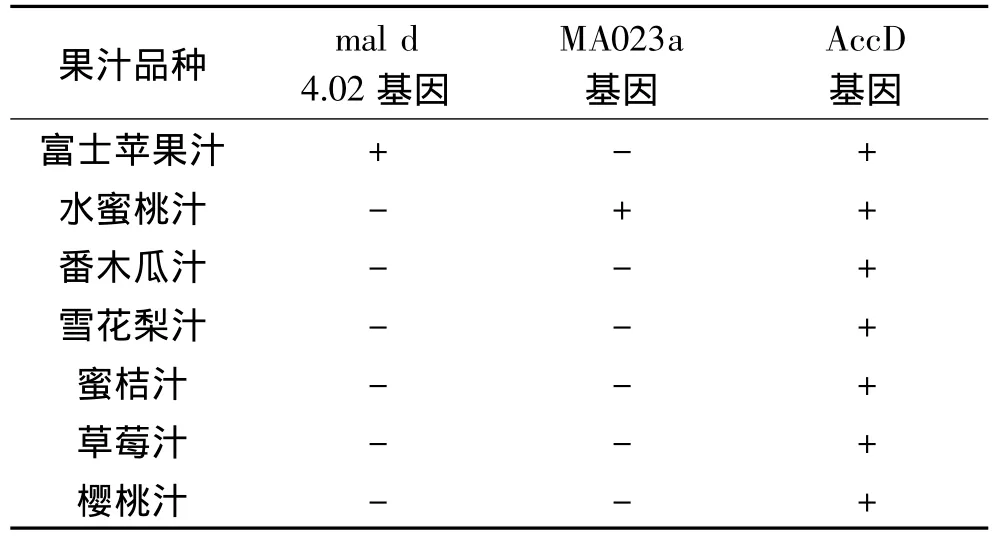
表3 苹果和桃鲜榨汁的种类特异性基因的扩增结果Table 3 Amplification results of the apple and peach fresh juice species-specific gene
3 结论与讨论
普通PCR方法是目前分子检测的最主要手段之一。它具有快速、高效、准确、灵敏、操作简单、成本低廉等优点,适用于开展水果种类特异性的鉴定。本研究以ACC基因为通用内标,建立了苹果、桃属种类特异性鉴定方法,并通过引物特异性验证实验进一步证实了该方法准确性。内标基因的设定,排除了由于DNA质量以及实验操作等因素对检测结果可靠性的影响,避免了假阴性结果的发生。
通过苹果、桃属特异性引物的PCR扩增条件的优化,两种水果引物的特异性PCR扩增和PCR灵敏度分析表明,苹果、桃属特异性引物除对各自属扩增出目的性条带外,对其它属均没有条带扩增,特异性引物的灵敏度均较高。因此,苹果、桃属种类特异性检测方法具有稳定性好、特异性强和灵敏度高的特点,适用于苹果、桃属种类鉴定并成功应用于苹果汁和桃汁的种属鉴定,具有重要应用价值。然而此方法仅能用来定性检测一大类物质,但对种属内的不同品种产品不能区分,而且也不能进行定量测定,因此,下一步需建立苹果汁和桃汁的定量检测方法研究。
[1]韩建勋,陈颖,黄文胜,等.苹果汁鉴伪技术研究进展[J].食品科技,2008(8):205-208.
[2]Versari A,Biesenbruch S,Barbanti D,et al.Adulteration of fruit juices:dihydrochalcones as quality markers for apple juice identification[J].LWT,1997,30:585-589.
[3]刘温喜.基于特征成分检测的浓缩苹果汁掺伪辨析[D].陕西:陕西师范大学,2009.
[4]胡耀星,袁林,周红艳.苹果汁的掺假鉴定[J].食品工业科技,1998(4):69-71.
[5]陈乃富,张莉,崔海涛,等.苹果汁掺假(梨汁)的研究[J].实验报告与理论研究,2005,27(12):13-15.
[6]Kuchmenko T A,Lisiskaya R P,Bobrova O S.Test method for detecting adulterated apple juice using piezoelectric resonators[J].Journal of Analytical Chemistry,2008,63(6):596-602.
[7]Wald B,Galensa R.Detection of fruit juice adulteration in apple and pear juice[J].Z Lebensm Unters Forsch.,1989,188(2):107-114.
[8]Muntean E.Simultaneous Carbohydrate Chromatography and Unsuppressed Ion Chromatography in detecting fruitjuices adulteration[J].Chromatographia Supplement,2010,71(1):69-74.
[9]Lukas V,Andre S,Ondrej L,et al.Liquid chromatographymass spectrometry- based metabolomics for authenticity assenssment of fruit juices[J].Metabolomics,2012(8):793-803.
[10]Lorenzo L,Danidl K,Gerard D.Detection of apple juice adulteration using near-infrared transflectance spectroscopy[J].Appled Spectroscopy,2005,59(5):593-598.
[11]Kelly J F,Downey G.Detection of sugar adulterants in apple juice using fourier transform infrared spectroscopy and chemometrics[J].JAgric Food Chem,2005,53(9):3281-3286.
[12]Luis E R S,Fredrick SF,Michael A M,et al.Rapid analysis of sugars in fruit juices by FT-NIR spectroscopy[J].Carbhoydrate Research,2001,336:63-74.
[13]高志明,徐怀德,罗杨合.中红外光谱鉴别苹果汁掺假[J].食品研究与开发,2009,30(11):130-133.
[14]Chaing C,Chang C C,Wu I C,et al.Rapid molecular identification of freshly squeezed and reconstituted orange juice[J].International Journal of Food Science and Techology,2006,41:646-651.
[15]韩建勋,黄文胜,吴亚君,等.果汁中梨成分分子生物学鉴伪-实时荧光 PCR方法研究[J].中国食品学报,2010,10(1):207-211.

